- Ocultos a simple vista
- Todos los colores del arco iris
- La princesa y el carruaje
- Aleación para un hierro mejor
- Tostadoras a tope: El cromo es el rey
- Demasiado caliente para manejarlo: Materiales refractarios
- El magnate americano del cromo
- ¿Riesgo de cáncer en el lugar de trabajo?
- El cromo en la gran pantalla
- Esencial para la vida
- Las fuentes incluyen:
Ocultos a simple vista

Desde el uso del cromado en los diseños art decó de los años 30 hasta su apogeo en los coches, muebles y electrodomésticos de los años 50 y 60, el cromo ha estado estrechamente asociado al acelerado mundo moderno. A diferencia de otros metales, el cromo no tenía usos antiguos o prehistóricos.
Altas cantidades de cromo se encuentran de forma natural en dos minerales. El más común, llamado cromita, es una piedra oscura y sin brillo que se pasaba por alto fácilmente. El segundo, un mineral llamado crocoíta, tiene un aspecto inusual pero es extremadamente raro. La crocoita, también conocida como cromato de plomo, fue descubierta por un geólogo en 1765 en la mina de Beresof, cerca de Ekaterinburgo (Siberia). De color naranja brillante, este mineral era muy apreciado por los primeros coleccionistas de piedras por sus cristales de cuatro caras. Los artistas también atesoraban fragmentos de crocoíta por su hermoso color naranja rojizo. Pero el mineral es demasiado raro para ser útil comercialmente. La cromita, el principal mineral comercial, no se descubrió hasta 1798.
Todos los colores del arco iris
El elemento cromo fue aislado en 1797 por el químico francés Louis Nicholas Vauquelin. El nombre del elemento proviene de la palabra griega para color, «chroma», porque cada compuesto de cromo que producía era de un color brillante. Encontró rojos, amarillos brillantes y verdes profundos y descubrió que las trazas de cromo en una esmeralda peruana eran las responsables de su color. Otros descubrieron más tarde que el rubí también toma su color rojo del cromo.
En 1799, un químico alemán que vivía en París encontró cromo en una piedra oscura y opaca que pasaría a llamarse cromita. Este mineral era más abundante que la crocoíta y la mayor disponibilidad de cromo facilitó la innovación y los descubrimientos en una amplia gama de industrias.
La princesa y el carruaje
Los coloridos productos químicos de cromo por los que Vauquelin dio nombre al cromo pronto encontraron una aplicación práctica en la industria textil. Antes de la llegada de los tintes sintéticos, todos los tintes procedían de fuentes naturales, como los minerales y las plantas. A menudo, estos tintes se desvanecían rápidamente si el material teñido se lavaba. Para fijar o estabilizar el color, se utilizaban agentes químicos llamados mordientes. Desde el punto de vista químico, el mordiente se une al tinte y a las fibras del material, evitando el sangrado y la decoloración. Ya en 1820, las industrias del algodón y la lana utilizaban grandes cantidades de compuestos de cromo, como el bicromato de potasio, en el proceso de teñido. Los pigmentos rojos y verdes desarrollados a partir de compuestos de cromo también se utilizaron para imprimir papel pintado durante este periodo.

En 1822, uno de los alumnos de Vauquelin, Andreas Kurtz, se trasladó a Inglaterra y comenzó a producir bicromato de potasio y a venderlo a la industria textil inglesa a 5 chelines la libra. Los fabricantes locales no tardaron en seguir su ejemplo y la competencia hizo que el precio bajara a 8 peniques, aproximadamente una octava parte del precio original. Esto no proporcionó a Kurtz un beneficio satisfactorio, por lo que comenzó a producir otros compuestos de cromo, concretamente pigmentos de cromo. Su amarillo de cromo se puso de moda cuando la popular princesa Charlotte, hija del monarca británico Jorge IV, lo utilizó para pintar su carruaje. Este fue quizás el origen del «taxi amarillo», una idea ejemplificada hoy en día en los taxis de Nueva York. Kurtz dejó su huella en el mundo del color; el «amarillo Kurtz» aún se encuentra en los catálogos de colores británicos.
Aleación para un hierro mejor
Mientras que los productos químicos del cromo ganaron importancia comercial rápidamente en las industrias de los pigmentos, el cromo tardó más en hacerse notar en otros sectores. Uno de ellos fue la industria metalúrgica (fabricación de metales). A partir de mediados del siglo XIX, los fabricantes de hierro descubrieron que añadiendo cromo al acero se obtenía un metal más duro y útil.

El acero es una mezcla de hierro con una pequeña cantidad de carbono, alrededor del 1 por ciento. Estas mezclas de metales se denominan aleaciones. El hierro, en su forma pura, puede ser calentado y luego doblado, martillado o «forjado» en muchas formas. Los objetos de hierro producidos de este modo son sólo moderadamente duros y pueden doblarse con el uso. Al fundir el hierro y verterlo en moldes se obtienen productos de «hierro fundido» que son frágiles una vez que se enfrían. Pero añadir carbono al hierro cambia su microestructura y sus propiedades. Cuando esta mezcla se calienta, alcanza un estado extremadamente dúctil y puede formarse fácilmente. A medida que el acero se enfría, gana fuerza y rigidez, llegando a ser más fuerte que el hierro. Este proceso se denomina revenido. Diferentes cantidades de carbono y la velocidad de enfriamiento determinan las propiedades finales del acero.
Añadir cromo a esta mezcla produce un acero más duro al retrasar la transformación que se produce al enfriar el acero, y a partir de 1865 se produjeron aceros con un 3 a 5 por ciento de cromo. No fue hasta principios del siglo XX cuando se observaron las propiedades de resistencia a la corrosión de los aceros con porcentajes de cromo superiores al 5%. En porcentajes más altos, el cromo hace que el acero sea muy resistente a muchos agentes y entornos corrosivos. Estos aceros «inoxidables» tienen muchas aplicaciones en materiales que requieren una gran fuerza y resistencia a la corrosión. Quizá los usos más conocidos del acero inoxidable sean los cubiertos y los utensilios de cocina. El sello «18-8», por ejemplo, indica que el acero contiene un 18% de cromo (para la resistencia) y un 8% de níquel (para el brillo). En la actualidad, el uso de cromo en la producción de acero inoxidable representa el 60% del consumo de cromo. Los utensilios y la cubertería de acero inoxidable se encuentran en las cocinas de todo Estados Unidos
Tostadoras a tope: El cromo es el rey
Las cocinas contienen cromo en otra forma: el cromo galvánico cubre los accesorios del fregadero y los electrodomésticos con una película similar a un espejo. La omnipresencia del cromo galvánico es impresionante si se tiene en cuenta que los principios fundamentales de la galvanoplastia del cromo no se descubrieron hasta 1924. La investigación comenzó mucho antes en Francia con el libro de Antoine Cesar Becquerel sobre electroquímica publicado en 1843. Sugirió que el cromo podía depositarse en superficies sumergidas en soluciones de cloruro de cromo y sulfato de cromo. En 1849, un francés obtuvo la patente de un proceso que hacía que el oro se adhiriera al hierro con una placa de cromo intermedia. R. W. von Bunsen, inventor del mechero Bunsen, investigó la galvanoplastia de cromo y produjo pequeñas muestras de cromo electrodepositado en 1854 a partir de soluciones de cloruro de cromo.

La mayor parte de los metales se platean a partir de sales (compuestos de cloruro y sulfato), pero el cromo es inusual porque se platea mejor a partir de ácidos crómicos. Los primeros experimentadores probaron soluciones de cloruro y sulfato de cromo con poco éxito. La solución correcta se descubrió por casualidad, cuando un profesor alemán electrolizó una solución de ácido crómico y observó un depósito de cromo. Este sorprendente descubrimiento llevó a Colin G. Fink y a varios estudiantes graduados de Cornell y Columbia a investigar el proceso.
La primera aplicación del cromado fue en la producción de joyas. El cromo se utilizó para revestir alianzas de platino macizo para protegerlas del desgaste. Aclamado como un metal milagroso que se parecía al platino pero se llevaba mucho mejor, las joyas cromadas no tardaron en llegar a las orejas y manos de las mujeres de moda de todo Estados Unidos.
A medida que el proceso de cromado se abarataba y se hacía más común, los accesorios de fontanería y los electrodomésticos se chapaban con cromo. La atractiva superficie brillante y la resistencia a la corrosión hicieron que los artículos chapados fueran estética y funcionalmente deseables. Pronto los consumidores exigieron adornos cromados en todos sus electrodomésticos, y los fabricantes de automóviles empezaron a fabricar los parachoques y las molduras cromados tan característicos de los diseños de los coches de los años 50. El «cromo», prácticamente desconocido 30 años antes, se había convertido en una palabra familiar.
Las aplicaciones industriales del cromado se descubrían al mismo tiempo que el cromado decorativo hacía su llamativo debut. El cromo es un metal muy duro y tiene un bajo coeficiente de fricción. Los fabricantes empezaron a revestir con una gruesa capa de cromo las piezas de las máquinas, como los cilindros de los coches, que sufrían mucho desgaste, lo que alargaba considerablemente su vida útil. El cromo también era útil en las tuberías de las calderas. Las tuberías de acero acumulaban incrustaciones -depósitos minerales liberados por el agua hirviendo- que se desprendían de la superficie de la tubería y obstruían el sistema. Sin embargo, las tuberías cromadas no desprendían la cal. Las placas de cobre y acero utilizadas para imprimir dinero se desgastaban rápidamente antes de la llegada del cromado, pero con una capa de cromo podían producir imágenes nítidas durante mucho más tiempo.
El uso generalizado del cromo en estas aplicaciones ha dificultado la medición de la cantidad de cromo en el medio ambiente, en los alimentos y en los tejidos humanos. Los científicos utilizan técnicas «limpias» extremadamente rigurosas sin metales para medir con precisión los niveles de trazas de cromo. Pero el cromo de los equipos de laboratorio de acero inoxidable y otros productos puede contaminar fácilmente las muestras que no se almacenan, procesan o analizan adecuadamente.
Demasiado caliente para manejarlo: Materiales refractarios
El acero al cromo, que resiste la deformación o la fusión en condiciones de calor extremo, es ideal para aplicaciones de alta temperatura, como los componentes de los motores a reacción. El principal mineral de cromo, la cromita, es igualmente resistente al calor. Es esta propiedad, junto con su estabilidad química, la que hace que el cromo sea útil como material refractario.
Los materiales refractarios se utilizan como aislantes para revestir el interior de los altos hornos y crisoles utilizados en la fabricación de metales, especialmente en el refinado de metales y la fabricación de acero y otras aleaciones. Las aleaciones se hacen cuando se mezclan dos o más metales para producir un nuevo metal que combina características deseables, como la dureza y la resistencia a los ambientes corrosivos.

Los altos hornos son altas torres cilíndricas con un crisol, una gran estructura en forma de cuenco, en la parte inferior y una parte superior ligeramente afilada. En la parte superior del horno se carga una mezcla de mineral y otros materiales (la carga) y se insufla aire caliente desde la parte inferior. Las reacciones químicas en la carga separan el metal del producto de desecho (escoria) y el metal purificado se acumula en el crisol. Por lo general, la escoria flota en la parte superior y el metal se vierte desde un pico en el fondo del crisol.
Mientras están en funcionamiento, los altos hornos están extremadamente calientes. Estas altas temperaturas son necesarias para facilitar las reacciones químicas que separan el metal del mineral. Pero este calor podría permitir que el mineral reaccionara con los materiales de las paredes del alto horno y el revestimiento del crisol, contaminando el metal que se está refinando. Y si las paredes se dilatan bajo este calor, la integridad estructural de la torre podría verse afectada. Por estas razones, las paredes deben tener una composición química adecuada. Los materiales de construcción habituales, como el hormigón y el cemento, no pueden soportar estas condiciones y, evidentemente, cualquier acero utilizado en el edificio debe estar protegido o se fundirá como el metal dentro del horno.
Por estas razones, los refractarios son indispensables para el proceso de fabricación del acero. Los refractarios, o materiales refractarios, tienen altos puntos de fusión y son químicamente estables. Esto los hace ideales para aislar los altos hornos que extraen el arrabio del mineral de hierro y para revestir los grandes crisoles que contienen el acero fundido.
La cromita se utilizó inicialmente como refractario en Francia junto con la magnesita y la dolomita (otros minerales refractarios). Hasta la década de 1890, se utilizaban ladrillos de cromita maciza cortada directamente de la mina, sin ningún tipo de refinamiento o procesamiento posterior. A medida que la industria del acero crecía en Estados Unidos e Inglaterra, los fabricantes desarrollaron ladrillos refractarios hechos de cromita o magnesita triturada. La fabricación de estos ladrillos era más barata que la de los bloques triturados, ya que los trozos de mineral rotos eran tan útiles como los grandes bloques sólidos necesarios para el tratamiento. El mineral triturado se mezclaba con una resina y se prensaba en forma de ladrillos. También se cocían a baja temperatura como la arcilla. En la década de 1930 se produjeron refractarios hechos con mezclas de cromita y magnesita en diversos porcentajes para diferentes aplicaciones. En el año 2000 se extrajeron cuatro millones de toneladas métricas de cromita en todo el mundo. En Estados Unidos se consumen unas 90.000 toneladas al año. En 1982, el 11 por ciento de la cromita se utilizaba en materiales refractarios, pero en 1989 la proporción había descendido al 7 por ciento.
Debido a los avances tecnológicos, la cromita es menos importante hoy en día como refractario que a principios del siglo XX. Sin embargo, sigue siendo insustituible como aleación crítica en el acero inoxidable. Incluso antes de que se apreciara el valor del cromo en la fabricación de acero, el descubrimiento del mineral en Estados Unidos hizo extremadamente rica a una familia y estableció al país como líder en la industria del cromo.
El magnate americano del cromo
Con la llegada de estas industrias basadas en el cromo, el mineral de cromo tuvo una gran demanda. Hasta aproximadamente 1830, la mayor parte de la cromita del mundo procedía de Siberia, donde Pallas encontró por primera vez crocoita. Como geólogo aficionado, Isaac Tyson era uno de los pocos estadounidenses que había estudiado la cromita y conocía su valor y su potencial comercial.

En el verano de 1827, se encontraba en un mercado de Baltimore cuando observó un carro que transportaba barriles de sidra de manzana. Entre los barriles había pesadas piedras negras que impedían que rodaran. Había estudiado piedras similares a seis millas de Baltimore, cerca de la casa de su padre, y reconoció estas rocas como el mineral cromita. Intrigado, Tyson descubrió rápidamente que las piedras procedían de la granja de Reed, a 27 millas al noreste de Baltimore, en el condado de Harford. Tyson compró la granja y pronto encontró una gran bolsa de mineral de cromita a dos metros bajo la superficie de la tierra. Convencido de que la zona de Baltimore contenía más mineral, buscó en círculos cada vez más amplios. Su corazonada fue acertada; en 1828 encontró mineral en la granja de Wood, en Pensilvania.
Tyson convirtió la propiedad en la mina de Wood, que llegó a producir 100.000 toneladas de mineral. Pronto, Tyson fue propietario de los derechos mineros de todos los yacimientos de Pennsylvania, Virginia y Maryland. Cuando los yacimientos de Siberia disminuyeron, su empresa disfrutó de un creciente monopolio internacional del mineral de cromo. Sin embargo, cuando se descubrió cromo en Turquía en 1848, Tyson perdió su monopolio. Al igual que Kurtz en Inglaterra, se dedicó a otros productos y comenzó a producir productos químicos de cromo para la industria textil. De este modo, se convirtió en un pionero de la industria química estadounidense.
¿Riesgo de cáncer en el lugar de trabajo?
La mayoría de los usos comerciales del cromo requieren la forma cromo+6, que se produce a partir de la cromita (cromo+3) mediante un proceso de tostación química en el que el mineral de cromita se tritura y se calienta con productos químicos reactivos. Este proceso produce una gran cantidad de polvo y cromo en el aire. Desgraciadamente, fueron los trabajadores de estas industrias los que descubrieron de primera mano los riesgos para la salud asociados a los polvos de cromo transportados por el aire.
Durante la primera mitad del siglo XX, los niveles de polvo en el aire durante el procesamiento del mineral eran tan altos que se decía que no se podía ver la pared opuesta al otro lado de la fábrica durante las horas de máxima producción. Los trabajadores respiraban polvos que contenían un nivel muy alto de cromo en el aire.
En la década de 1930, los higienistas industriales de Alemania empezaron a notar que la incidencia de cánceres respiratorios, como el de pulmón, era mayor en los trabajadores de la industria del mineral de cromo que en otras ocupaciones similares. En autopsias realizadas años después, se demostró que los pulmones de los trabajadores expuestos a estos polvos durante toda su vida contenían hasta un 10% de cromo en peso. El consumo de cigarrillos era poco frecuente en la población general entre 1900 y 1940 y el cáncer de pulmón seguía siendo relativamente raro en los hombres de mediana edad. Por lo tanto, los médicos señalaron que el aumento de las enfermedades pulmonares en estos trabajadores era inusual.

A partir de estas observaciones, los alemanes iniciaron una serie de medidas para reducir los niveles de polvo y la exposición personal en la industria del cromo, lo que marcó el inicio de lo que hoy son las prácticas modernas de higiene industrial. El inicio de la Segunda Guerra Mundial impidió que estas observaciones se difundieran ampliamente o fueran adoptadas por otros países, pero después de la guerra el resto del mundo occidental comenzó a investigar las enfermedades relacionadas con el cromo y a iniciar sus propios programas de higiene industrial.
Los estudios epidemiológicos más importantes sobre la exposición al cromo en el trabajo realizados en las décadas de 1950 y 1960 descubrieron que la exposición a polvos que contenían el cromo+6 producido industrialmente, en lugar del cromo+3 que se encuentra de forma natural en los minerales, estaba asociada al cáncer de pulmón. Estos estudios también sugerían que ciertas formas de polvo de cromo, en particular los compuestos de solubilidad intermedia en el agua, como el cromato de calcio, eran los más preocupantes. Las formas más solubles en agua, como el cromato de sodio o de potasio, y las formas altamente insolubles, como el cromato de plomo, no estaban estrechamente relacionadas con los efectos sobre la salud.
Durante este período se realizó un esfuerzo concertado para reducir la exposición de los trabajadores, mediante la modificación de los procesos de fabricación, la sustitución de formas de cromo, el uso de ropa de protección personal y otras medidas. Los organismos gubernamentales establecieron niveles aceptables de exposición, que se revisaban continuamente a medida que se obtenía nueva información de estudios adicionales. De este modo, se redujeron considerablemente los niveles de polvo y la exposición de los trabajadores. Estudios recientes indican que los trabajadores que empezaron a trabajar en estas industrias a partir de la década de 1960, después de la aplicación de estas prácticas, tienen niveles de cáncer respiratorio que no difieren significativamente de los de la población general.
El cromo en la gran pantalla
En la película Erin Brockovich (2001, Universal Studios) se retrata a Pacific Gas and Electric como un gigante empresarial que envenenó el agua de la pequeña ciudad de Hinkley, California. La película, que se basa en una demanda real, sugiere que los altos niveles de cromo-6 fueron los responsables de una ecléctica gama de enfermedades entre los residentes del lugar, incluyendo varios tipos de cáncer, abortos, la enfermedad de Hodgkin y hemorragias nasales.
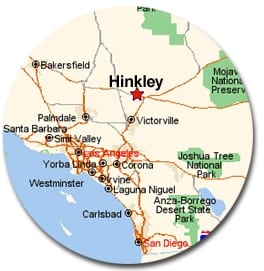
En la década de 1960 PG&E utilizaba dicromato de sodio, un compuesto de cromo-6, como preventivo de la oxidación en los fluidos refrigerantes. Las plantas petroquímicas y las refinerías modernas tienen grandes torres de refrigeración que eliminan el exceso de calor producido por los generadores, las unidades de refrigeración y otras máquinas. Con el tiempo, los fluidos refrigerantes de las torres pueden acumular corrosión o depósitos minerales. Estas acumulaciones disminuyen la eficiencia de la planta, haciendo necesario detener la producción para realizar limpiezas largas y costosas. Sin embargo, la adición de dicromato de sodio al fluido refrigerante casi elimina la corrosión y la acumulación de minerales.
Con el tiempo, el dicromato de sodio se degrada a cromo+3. A medida que esto sucede, la solución se vuelve cada vez menos eficaz como preventivo de la oxidación. Como resultado, PG&E pronto acumuló una gran cantidad de residuos de refrigerante. La empresa colocó los residuos en estanques poco profundos, con la intención de dragar los residuos de cromo del fondo del estanque cuando el resto de la solución se evaporara. Sin embargo, no se tuvo en cuenta la geología arenosa del desierto. El refrigerante se filtró rápidamente en el suelo, y el cromo contaminó las aguas subterráneas que alimentan los pozos de Hinkley.
Hoy en día, los niveles de cromo+6 son más altos de lo normal en algunos pozos de Hinkley. ¿Podría este compuesto tener efectos adversos para la salud?
Los cánceres respiratorios y las enfermedades relacionadas que se observaron en los trabajadores del mineral de cromo a principios del siglo XX son los únicos efectos nocivos bien documentados asociados a la exposición al cromo. No se ha informado de ningún otro efecto adverso de la exposición al cromo en el agua potable en seres humanos o en animales de experimentación por parte de grupos nacionales o internacionales como la Agencia de Protección Medioambiental de EE.UU., los Centros para el Control y la Prevención de Enfermedades de EE.UU., la Organización Mundial de la Salud o la Agencia Internacional para la Investigación del Cáncer.
En parte como respuesta a la demanda en la que se basó la película Erin Brockovich, California consideró recientemente la posibilidad de reducir la cantidad permitida de cromo en el agua potable. Sin embargo, un panel de expertos convocado por la Agencia de Protección Medioambiental de California para revisar esta decisión concluyó en su informe que la norma actual protege la salud humana y que no hay pruebas de que el cromo en el agua potable aumente el riesgo de enfermedad. Otros estudios independientes sobre Hinkley y otras ciudades de California con torres de refrigeración similares indican que no ha habido un aumento del cáncer en estas ciudades durante el periodo de exposición.
Esencial para la vida
Al igual que las vitaminas y los minerales, incluidos el hierro, el calcio, el zinc y el selenio, el cromo es un oligoelemento esencial: lo necesitamos en nuestra dieta para gozar de una salud normal. La mayoría de las fórmulas vitamínicas diarias contienen entre 50 y 200 microgramos de cromo. Pero, ¿cómo sabemos que algo como el cromo es esencial para la salud?
Estudios realizados en la década de 1950 sugirieron que el cromo podría estar implicado en la regulación de los niveles de glucosa en nuestra sangre. La glucosa es el azúcar que nuestro cuerpo utiliza como combustible. Los niveles de glucosa en sangre se regulan principalmente mediante la liberación de insulina. La falta de control adecuado de la glucosa por parte de la insulina es la base de la diabetes. Los estudios en animales realizados en la década de 1960 por el investigador de Dartmouth Henry Schroeder demostraron que el cromo era necesario para la regulación normal de la glucosa, al menos en los animales de experimentación. Esto se demostró eliminando primero el cromo por completo de la dieta, lo que provocó un problema de glucosa similar al de la diabetes en los animales, y luego añadiendo de nuevo cromo a la dieta, lo que eliminó el problema. Este experimento básico es la forma en que se ha demostrado que la mayoría de las sustancias dietéticas esenciales son necesarias para la salud normal.
Por supuesto, la prueba científica definitiva sería la evidencia directa de que una sustancia es esencial en los seres humanos (como las observaciones británicas sobre el escorbuto), y esta evidencia faltó para el cromo durante muchos años. Sin embargo, en los años 70, un joven médico realizó un experimento audaz e inusual para ayudar a una joven que estaba en coma. La mujer no podía comer ni beber, por lo que estaba sometida a una nutrición parenteral total o NPT; en otras palabras, toda su nutrición se le administraba a través de un tubo intravenoso desde una bolsa de plástico que contenía azúcar, aminoácidos y otros nutrientes. A lo largo de muchas semanas, desarrolló una enfermedad similar a la diabetes que no respondía a las inyecciones de insulina como cabría esperar. El médico que la trataba había leído sobre estudios en animales con cromo y decidió probar a añadir cromo+3 a su bolsa de NPT. En pocos días su condición de diabética desapareció por completo. Esta observación se repitió en varios otros pacientes, demostrando directamente en humanos la necesidad del cromo+3 para la regulación normal de la glucosa. El cromo es ahora un ingrediente estándar en la NPT y en otras dietas artificiales.
La mayoría de los estudios sugieren que obtenemos todo el cromo que necesitamos de una dieta normal y bien equilibrada de carne, cereales, fruta y verduras. Sin embargo, se ha demostrado que la administración de suplementos es beneficiosa para los diabéticos y otras personas con desequilibrios en la regulación de la glucosa, en los ancianos y en quienes tienen una mala nutrición.
Las fuentes incluyen:
Tabla periódica de los elementos Incluye amplia información sobre las propiedades químicas del plomo, desde las más simples hasta las más complejas. Diseñada para estudiantes y para ciudadanos curiosos y con ciertos conocimientos científicos.
Chromium, Vols. 1 y 2, Udy, Martin J., ed. Reinhold Pub. Co., New York 1956.
Kirk-Othmer Encyclopedia of Chemical Technology. 4th Edition. Vol. 3, pg 820- 875. Wiley & Sons, New York 1998.
Escrito por:
Erik Jacobson Science Writing Intern
