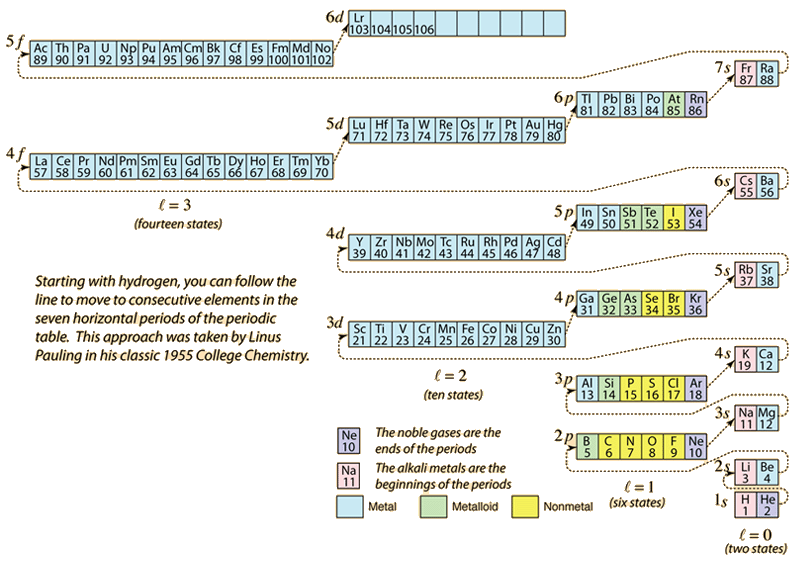
Pe măsură ce tabelul periodic al elementelor este alcătuit prin adăugarea electronilor necesari pentru a corespunde numărului atomic, electronii vor lua cea mai mică energie în concordanță cu principiul de excludere Pauli. Populația maximă a fiecărei învelișuri este determinată de numerele cuantice, iar diagrama de mai sus este o modalitate de a ilustra ordinea de umplere a stărilor energetice ale electronilor.
Pentru un singur electron, energia este determinată de numărul cuantic principal n, iar acest număr cuantic este folosit pentru a indica „învelișul” în care locuiesc electronii. Pentru o anumită cochilie în atomii cu mai mulți electroni, acei electroni cu numărul cuantic orbital l mai mic vor avea o energie mai mică, din cauza pătrunderii mai mari în norul de protecție al electronilor din cochiliile interioare. Aceste niveluri de energie sunt specificate prin numerele cuantice principale și orbitale folosind notația spectroscopică. Când se ajunge la nivelul 4s, dependența de numărul cuantic orbital este atât de mare încât 4s este mai mic decât 3d. Natura trecerii de nivel urmează linia punctată din diagramă, care arată punctele în care se trece la învelișul următor, mai degrabă decât să se treacă la un număr cuantic orbital mai mare în același înveliș.
Configurația electronică a majorității elementelor poate fi dedusă din diagrama de mai sus, dar nu a tuturor. Configurația electronică pentru orice element poate fi găsită făcând clic pe elementul respectiv în tabelul periodic. Prima excepție de la schema de mai sus care se întâlnește este cromul, unde este ocupată a cincea stare electronică 3d în loc de a doua stare 4s. Cuprul este, de asemenea, o excepție, ocupând toate cele 10 stări 3d în loc de a doua stare 4s. Niobiul ocupă a patra stare 4d înainte de a ocupa a doua stare 5s.
