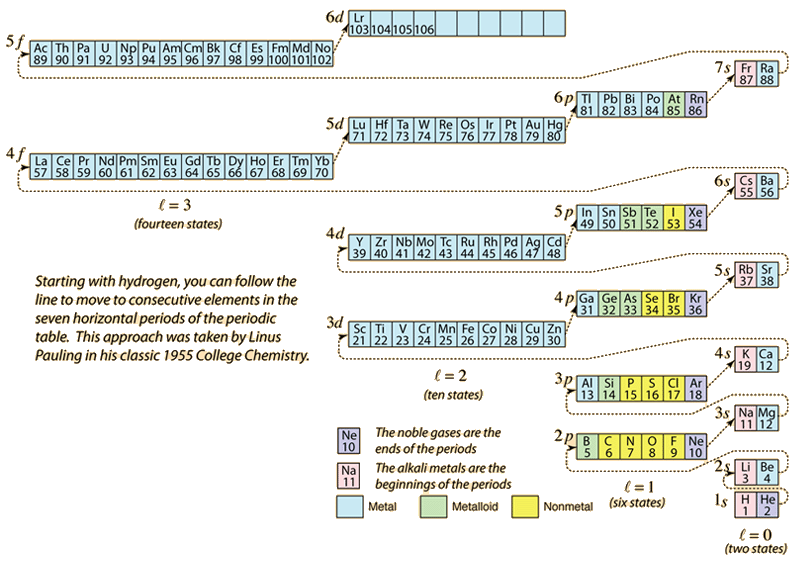
A medida que se construye la tabla periódica de los elementos añadiendo los electrones necesarios para que coincida el número atómico, los electrones tomarán la energía más baja consistente con el principio de exclusión de Pauli. La población máxima de cada cáscara está determinada por los números cuánticos y el diagrama anterior es una forma de ilustrar el orden de llenado de los estados energéticos de los electrones.
Para un solo electrón, la energía está determinada por el número cuántico principal n y ese número cuántico se utiliza para indicar la «cáscara» en la que residen los electrones. Para una cáscara dada en los átomos multielectrónicos, aquellos electrones con un número cuántico orbital l más bajo tendrán una energía más baja debido a la mayor penetración de la nube de protección de los electrones en las cáscaras interiores. Estos niveles de energía se especifican mediante los números cuánticos principales y orbitales utilizando la notación espectroscópica. Cuando se llega al nivel 4s, la dependencia del número cuántico orbital es tan grande que el 4s es más bajo que el 3d. La naturaleza del cruce de niveles sigue la línea discontinua en el diagrama, que muestra los puntos en los que se pasa a la siguiente cáscara en lugar de proceder a un número cuántico orbital más alto en la misma cáscara.
La configuración electrónica de la mayoría de los elementos se puede deducir del diagrama anterior, pero no de todos. La configuración de los electrones de cualquier elemento se puede encontrar haciendo clic en ese elemento en la tabla periódica. La primera excepción al esquema anterior que se encuentra es el cromo, donde se ocupa el quinto estado electrónico 3d en lugar del segundo estado 4s. El cobre también es una excepción, ya que ocupa los 10 estados 3d en lugar del segundo estado 4s. El niobio llena el cuarto estado 4d antes de llenar el segundo estado 5s.
