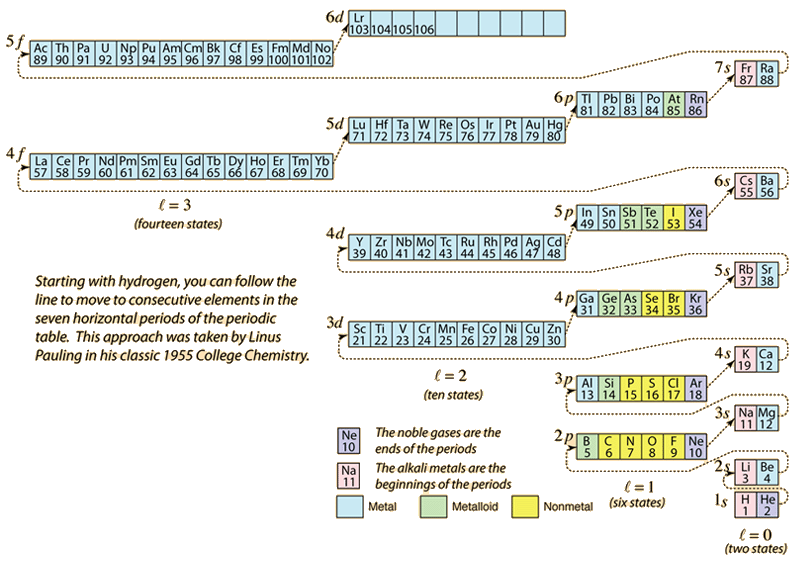
A mesure que l’on construit le tableau périodique des éléments en ajoutant les électrons nécessaires pour correspondre au numéro atomique, les électrons prennent l’énergie la plus faible compatible avec le principe d’exclusion de Pauli. La population maximale de chaque coquille est déterminée par les nombres quantiques et le diagramme ci-dessus est une façon d’illustrer l’ordre de remplissage des états énergétiques des électrons.
Pour un électron unique, l’énergie est déterminée par le nombre quantique principal n et ce nombre quantique est utilisé pour indiquer la « coquille » dans laquelle les électrons résident. Pour une coquille donnée dans les atomes à plusieurs électrons, les électrons dont le nombre quantique orbital l est inférieur auront une énergie plus faible en raison de la plus grande pénétration du nuage protecteur des électrons dans les coquilles intérieures. Ces niveaux d’énergie sont spécifiés par les nombres quantiques principaux et orbitaux en utilisant la notation spectroscopique. Lorsque l’on atteint le niveau 4s, la dépendance vis-à-vis du nombre quantique orbital est si importante que le 4s est inférieur au 3d. La nature du franchissement du niveau suit la ligne pointillée du diagramme, qui montre les points auxquels on passe à la coquille suivante plutôt que de procéder à un nombre quantique orbital plus élevé dans la même coquille.
La configuration électronique de la plupart des éléments peut être impliquée à partir du diagramme ci-dessus, mais pas tous. La configuration électronique de tout élément peut être trouvée en cliquant sur cet élément dans le tableau périodique. La première exception au schéma ci-dessus que l’on rencontre est le chrome, où le cinquième état électronique 3d est occupé au lieu du deuxième état 4s. Le cuivre est également une exception, car il occupe les 10 états 3d au lieu du deuxième état 4s. Le niobium remplit le 4e état 4d avant de remplir le deuxième état 5s.
