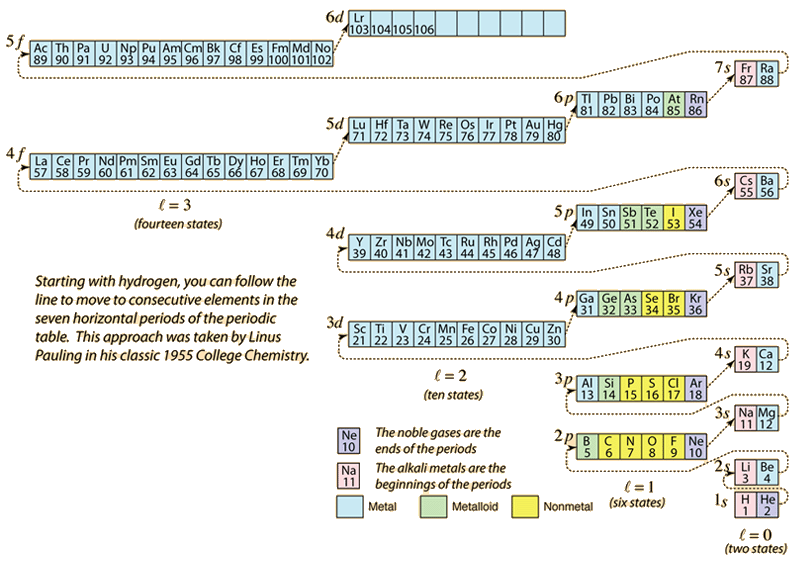
Während das Periodensystem der Elemente durch Hinzufügen der für die jeweilige Ordnungszahl erforderlichen Elektronen aufgebaut wird, nehmen die Elektronen die niedrigste Energie an, die mit dem Pauli-Ausschlussprinzip vereinbar ist. Die maximale Besetzung jeder Schale wird durch die Quantenzahlen bestimmt und das obige Diagramm ist eine Möglichkeit, die Reihenfolge der Besetzung der Elektronenenergiezustände zu veranschaulichen.
Für ein einzelnes Elektron wird die Energie durch die Hauptquantenzahl n bestimmt, und diese Quantenzahl wird zur Angabe der „Schale“ verwendet, in der sich die Elektronen befinden. Bei einer bestimmten Schale von Atomen mit mehreren Elektronen haben die Elektronen mit einer niedrigeren Orbitalquantenzahl l eine niedrigere Energie, da sie die abschirmende Elektronenwolke der inneren Schalen stärker durchdringen. Diese Energieniveaus werden durch die Haupt- und Orbitalquantenzahlen in der spektroskopischen Notation angegeben. Beim Erreichen des 4s-Niveaus ist die Abhängigkeit von der orbitalen Quantenzahl so groß, dass das 4s-Niveau niedriger ist als das 3d-Niveau. Die Art des Niveauübergangs folgt der gestrichelten Linie im Diagramm, die die Punkte anzeigt, an denen man in die nächste Schale wechselt, anstatt zu einer höheren Orbitalquantenzahl in derselben Schale überzugehen.
Die Elektronenkonfiguration der meisten Elemente kann aus dem obigen Diagramm abgeleitet werden, aber nicht aller. Die Elektronenkonfiguration für jedes Element kann durch Anklicken des Elements im Periodensystem ermittelt werden. Die erste Ausnahme vom obigen Schema ist Chrom, wo der fünfte 3d-Elektronenzustand anstelle des zweiten 4s-Zustands besetzt ist. Kupfer ist ebenfalls eine Ausnahme, da es alle 10 3d-Zustände und nicht den zweiten 4s-Zustand besetzt. Niob besetzt den vierten 4d-Zustand, bevor es den zweiten 5s-Zustand besetzt.
