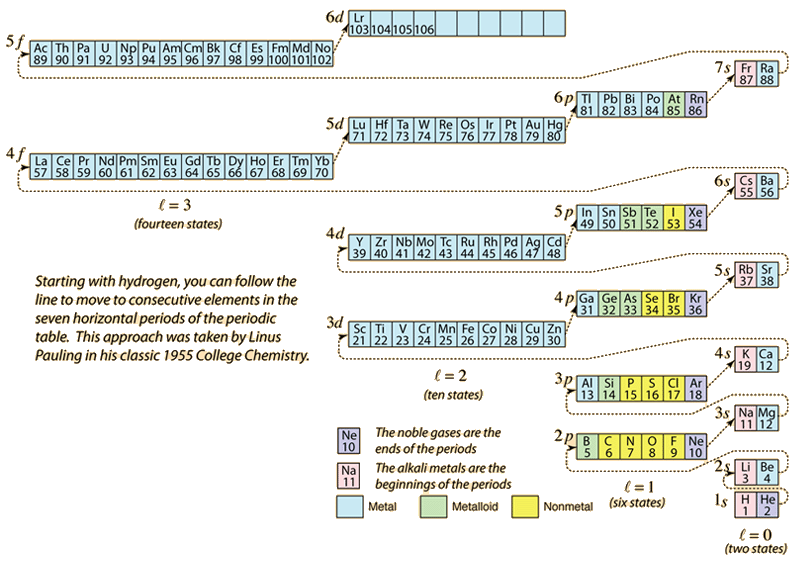
Při sestavování periodické tabulky prvků přidáváním elektronů potřebných k dosažení atomového čísla budou elektrony nabývat nejnižší energie v souladu s Pauliho vylučovacím principem. Maximální populace jednotlivých slupek je určena kvantovými čísly a výše uvedený diagram je jedním ze způsobů, jak znázornit pořadí zaplňování energetických stavů elektronů.
Pro jeden elektron je energie určena hlavním kvantovým číslem n a toto kvantové číslo se používá k označení „slupky“, ve které se elektrony nacházejí. Pro danou slupku ve víceelektronových atomech budou mít ty elektrony s nižším orbitálním kvantovým číslem l nižší energii z důvodu většího průniku stínícího oblaku elektronů ve vnitřních slupkách. Tyto energetické hladiny jsou určeny hlavním a orbitálním kvantovým číslem pomocí spektroskopického zápisu. Při dosažení hladiny 4s je závislost na orbitálním kvantovém čísle tak velká, že 4s je nižší než 3d. Charakter přechodu hladin sleduje čárkovaná čára v diagramu, která ukazuje body, v nichž se přechází do další slupky, místo aby se postupovalo k vyššímu orbitálnímu kvantovému číslu ve stejné slupce.
Z výše uvedeného diagramu lze odvodit elektronovou konfiguraci většiny prvků, ale ne všech. Elektronovou konfiguraci libovolného prvku lze zjistit kliknutím na daný prvek v periodické tabulce. První výjimkou z výše uvedeného schématu, se kterou se setkáme, je chrom, kde je místo druhého stavu 4s obsazen pátý stav 3d elektronů. Výjimkou je také měď, která obsazuje všech deset 3d stavů namísto druhého 4s stavu. Niob zaplní 4. 4d stav před zaplněním druhého 5s stavu.
