Generiskt namn: lidokainhydroklorid
Doseringsform: aktuellt gelé
Medicinskt granskad av Drugs.com. Senast uppdaterad den 1 oktober 2020.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Interaktioner
- Mer
Endast på recept
- Beskrivning
- KLINISK FARMACOLOGI
- INDIKATIONER OCH ANVÄNDNING
- KONTRAINDIKATIONER
- VARNINGAR
- Försiktighetsåtgärder
- Användning under graviditet:
- Biverkningar
- ÖVERDOSERING
- DOSERING OCH ADMINISTRATION
- MAXIMAL DOSERING
- Hur levereras
- Mer om lidokain aktuellt
- Konsumentresurser
- Professionella resurser
- Relaterade behandlingsguider
Beskrivning
Lidokain HCI 2% gelé är en steril, vattenhaltig produkt som innehåller ett lokalbedövningsmedel och administreras lokalt. (Se INDIKATIONER för specifika användningsområden.)
Lidokain HCI 2% gelé innehåller lidokain HCI som kemiskt betecknas som acetamid, 2-(dietylamino)-N-(2,6-dimetylfenyl)-, monohydrochlorid och har följande strukturformel:
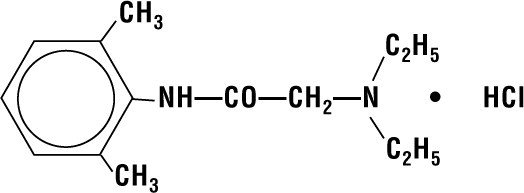
Dess molekylformel är C14H22N2O – HCI och dess molekylvikt är 270.80.
Lidokain HCI 2% gelé innehåller också hypromellos, och den resulterande blandningen maximerar kontakten med slemhinnan och ger smörjning för instrumentering. Den oanvända delen ska kasseras efter första användning.
Sammansättning av Lidocaine HCI 2% Jelly 30 mL och 5 mL tuber: Varje mL innehåller 20 mg lidokain HCI. Formuleringen innehåller också metylparaben, propylparaben, hypromellos och natriumhydroxid och/eller saltsyra för att justera pH mellan 6,0 och 7,0.
KLINISK FARMACOLOGI
Aktionsmekanism: Lidokain stabiliserar neuronmembranet genom att hämma de joniska flöden som krävs för initiering och ledning av impulser och därigenom åstadkomma lokalbedövning.
Inträde av verkan: Verkningsdebuten är 3 till 5 minuter. Det är ineffektivt när det appliceras på intakt hud.
Hemodynamik: För höga blodnivåer kan orsaka förändringar i hjärtminutvolym, totalt perifert motstånd och genomsnittligt arteriellt tryck. Dessa förändringar kan bero på en direkt deprimerande effekt av det lokalanestetiska medlet på olika komponenter i det kardiovaskulära systemet.
Farmakokinetik och metabolism: Lidokain kan absorberas efter topisk administrering på slemhinnor, och dess absorptionshastighet och omfattning beror på koncentrationen och den totala dosen som administreras, den specifika applikationsstället och exponeringstiden. I allmänhet sker absorptionen av lokalanestetiska medel efter topisk applicering snabbast efter intratrakeal administrering. Lidokain absorberas också väl från mag-tarmkanalen, men lite intakt läkemedel kan förekomma i cirkulationen på grund av biotransformation i levern.
Lidokain metaboliseras snabbt av levern och metaboliter och oförändrat läkemedel utsöndras av njurarna. Biotransformationen omfattar oxidativ N-dealkylering, ringhydroxylering, klyvning av amidbindningen och konjugering. N-dealkylering, en viktig väg för biotransformation, ger metaboliterna monoetylglycinexylidididid och glycinexylididid. De farmakologiska/toxikologiska effekterna av dessa metaboliter liknar lidokain, men är mindre potenta än lidokain. Ungefär 90 % av det administrerade lidokainet utsöndras i form av olika metaboliter och mindre än 10 % utsöndras oförändrat. Den primära metaboliten i urinen är en konjugat av 4-hydroxi-2, 6-dimetylanilin.
Plasmabindningen av lidokain är beroende av läkemedelskoncentrationen och den bundna fraktionen minskar med ökande koncentration. Vid koncentrationer på 1 till 4 mcg fri bas per mL är 60 till 80 procent av lidokain proteinbundet. Bindningen är också beroende av plasmakoncentrationen av alfa-I-syraglykoproteinet.
Lidokain passerar blod-hjärn- och placentabarriärerna, förmodligen genom passiv diffusion.
Studier av lidokainmetabolismen efter intravenösa bolusinjektioner har visat att elimineringshalveringstiden för detta medel är typiskt 1,5 till 2,0 timmar. På grund av den snabba hastigheten med vilken lidokain metaboliseras kan alla tillstånd som påverkar leverfunktionen förändra lidokainkinetiken. Halveringstiden kan förlängas dubbelt eller mer hos patienter med leverdysfunktion. Njurdysfunktion påverkar inte lidokainkinetiken men kan öka ackumuleringen av metaboliter.
Faktorer som acidos och användning av CNS-stimulerande och depressiva medel påverkar de CNSnivåer av lidokain som krävs för att ge uppenbara systemiska effekter. Objektiva negativa manifestationer blir allt tydligare med ökande venösa plasmanivåer över 6 mcg fri bas per mL. Hos rhesusapan har arteriella blodnivåer på 18 till 21 mcg/ml visat sig vara tröskelvärde för krampaktig aktivitet.
INDIKATIONER OCH ANVÄNDNING
Lidokain HCI 2 % gelé är indicerat för att förebygga och kontrollera smärta vid ingrepp som involverar manliga och kvinnliga urinrör, för lokal behandling av smärtsam urinrörsinflammation och som ett bedövande smörjmedel vid endotrakeal intubation (oralt och nasalt).
KONTRAINDIKATIONER
Lidokain är kontraindicerat hos patienter med en känd historia av överkänslighet mot lokalbedövningsmedel av amidtyp eller mot andra beståndsdelar i Lidokain HCI 2% gelé.
VARNINGAR
EXCESSIV DOSERING, ELLER KORT INTERVALL MELLAN DOSERNA, KAN FÖREBARA HÖGA PLASMASKANALISERINGAR OCH SJÄVARIGA BOTENSKAPER. PATIENTERNA SKA INSTRUERAS ATT STRIKT FÖLJA DE REKOMMENDERADE RIKTLINJERNA FÖR DOSERING OCH ADMINISTRERING SOM ANGES I DENNA BIPACKSEDEL. HANTERINGEN AV SERIÖSA BOTNA REAKTIONER KAN KRAVA ANVÄNDNING AV RESUSKITATIVA UTRUSTNINGAR, OXYGEN OCH ANDRA RESUSKITATIVA LÄKEMEDEL.
Lidokain HCI 2 % gelé ska användas med yttersta försiktighet vid sepsis eller svårt traumatiserad slemhinna i applikationsområdet, eftersom det under sådana förhållanden finns en potential för snabb systemisk absorption.
När produkten används för smörjning av endotrakealtuben ska man se till att undvika att föra in produkten i tubens lumen. Använd inte gelén för att smörja de endotrakeala styletterna. Om gelén tillåts komma in i det inre lumen kan den torka in på den inre ytan och lämna en rest som tenderar att klumpa ihop sig vid flexion, vilket förtränger lumenet. Det har funnits sällsynta rapporter där denna rest har orsakat att lumen har slutits. (Se även BOTNA REAKTIONER och DOSERING OCH ADMINISTRATION.)
Försiktighetsåtgärder
Allmänt: Säkerheten och effekten av lidokain är beroende av korrekt dosering, korrekt teknik, adekvata försiktighetsåtgärder och beredskap för nödsituationer. (Se varningar och biverkningar.) Den lägsta dosen som leder till effektiv anestesi ska användas för att undvika höga plasmanivåer och allvarliga biverkningar. Upprepade doser av lidokain kan orsaka betydande ökningar av blodnivåerna med varje upprepad dos på grund av långsam ackumulering av läkemedlet eller dess metaboliter. Toleransen för förhöjda blodnivåer varierar med patientens status. Svaga, äldre patienter, akut sjuka patienter och barn ska ges reducerade doser i proportion till deras ålder och fysiska status. Lidokain ska också användas med försiktighet hos patienter med svår chock eller hjärtblock.
Lidokain HCI 2% gelé ska användas med försiktighet hos patienter med känd läkemedelsöverkänslighet. Patienter som är allergiska mot para-aminobensoesyraderivat (prokain, tetrakain, bensokain etc.) har inte visat korsöverkänslighet mot lidokain.
Många läkemedel som används under genomförandet av anestesi anses vara potentiella utlösande medel för familjär malign hypertermi. Eftersom man inte vet om lokalbedövningsmedel av amidtyp kan utlösa denna reaktion och eftersom behovet av kompletterande allmän anestesi inte kan förutsägas i förväg, föreslås det att ett standardprotokoll för hantering bör finnas tillgängligt. Tidiga oförklarliga tecken på takykardi, takypné, instabilt blodtryck och metabolisk acidos kan föregå temperaturhöjningen. Framgångsrikt resultat är beroende av tidig diagnos, snabbt avbrytande av de misstänkta utlösande agenserna och insättande av behandling, inklusive syrgasbehandling, indikerade stödåtgärder och dantrolen (konsultera bipacksedeln för dantrolennatrium intravenöst innan användning).
Information till patienterna: När lokalbedövningsmedel används i munnen ska patienten vara medveten om att produktionen av lokalbedövning kan försämra sväljningen och därmed öka risken för aspiration. Av denna anledning ska mat inte intas under 60 minuter efter användning av lokalanestetiska preparat i mun- eller halsområdet. Detta är särskilt viktigt hos barn eftersom de äter så ofta.
Nymning av tungan eller buccalslemhinnan kan öka risken för oavsiktligt betttrauma. Mat eller tuggummi ska inte tas medan mun- eller halsområdet är sövt.
Carcinogenes – Långtidsstudier på djur har inte utförts för att utvärdera den karcinogena potentialen hos lidokain.
Mutagenes – Lidokains mutagena potential har testats i Ames Salmonella reverse mutation assay, och in vitro kromosomaberrationer assay i humana lymfocyter och i ett in vivo musmikronukleus assay. Det fanns inga indikationer på någon mutagen effekt i dessa studier.
Fertilitetsnedsättning – Lidokains effekt på fertiliteten undersöktes i råttmodellen. Administrering av 30 mg/kg, s.c. (180 mg/m2) till parningsparet gav inte upphov till förändringar i fertilitet eller allmän reproduktionsförmåga hos råttor. Det finns inga studier som undersöker effekten av lidokain på spermieparametrar. Det fanns inga tecken på förändrad fertilitet.
Användning under graviditet:
Teratogena effekter: Graviditetskategori B.
Reproduktionsstudier för lidokain har utförts på både råttor och kaniner. Det fanns inga tecken på skador på fostret vid subkutana doser på upp till 50 mg/kg lidokain (300 mg/m2 på basis av kroppsytan) i råttmodellen. I kaninmodellen fanns det inga tecken på skador på fostret vid en dos på 5 mg/kg, s.c. (60 mg/m2 på basis av kroppsytan). Behandling av kaniner med 25 mg/kg (300 mg/m2) gav bevis för maternell toxicitet och bevis för försenad fosterutveckling, inklusive en icke-signifikant minskning av fostervikten (7 %) och en ökning av mindre skelettanomalier (skalle- och sternebraldefekt, minskad förbening av phalanger). Effekten av lidokain på den postnatala utvecklingen undersöktes hos råttor genom att behandla dräktiga honråttor dagligen subkutant i doser på 2, 10 och 50 mg/kg (12, 60 och 300 mg/m2) från dag 15 i dräktigheten och upp till 20 dagar post partum. Inga tecken på skadliga effekter sågs vare sig hos moderdjuret eller hos valparna upp till och med dosen 10 mg/kg (60 mg/m2); antalet överlevande valpar minskade dock vid dosen 50 mg/kg (300 mg/m2), både vid födseln och under laktationsperioden, och effekten är troligen sekundär till maternell toxicitet. Inga andra effekter på kullstorlek, kullvikt, abnormiteter hos valparna och valparnas fysiska utveckling sågs i denna studie.
I en andra studie undersöktes effekterna av lidokain på postnatal utveckling hos råtta som omfattade bedömning av valparna från avvänjning till könsmognad. Råttor behandlades i 8 månader med 10 eller 30 mg/kg, s.c. lidokain (60 mg/m2 respektive 180 mg/m2 på basis av kroppsytan). Denna tidsperiod omfattade tre parningsperioder. Det fanns inga tecken på förändrad postnatal utveckling hos någon avkomma; dock minskade båda doserna av lidokain signifikant det genomsnittliga antalet valpar per kull som överlevde fram till avvänjning av avkomman från de 2 första parningsperioderna.
Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid är förutsägande för respons hos människor bör detta läkemedel användas under graviditet endast om det är klart nödvändigt.
Förlossning och förlossning: Lidokain är inte kontraindicerat vid arbete och förlossning. Om Lidocaine HCl 2% gelé används samtidigt med andra produkter som innehåller lidokain måste den totala dosen som alla formuleringar bidrar med beaktas.
Sjuksköterskor som ammar: Lidokain utsöndras i mänsklig mjölk. Den kliniska betydelsen av denna observation är okänd. Försiktighet bör iakttas när lidokain administreras till en ammande kvinna.
Pediatrisk användning: Även om säkerheten och effektiviteten av Lidocaine 2% gelé hos pediatriska patienter inte har fastställts, fann man i en studie av 19 för tidigt födda nyfödda barn (gestationsålder <33 veckor) ingen korrelation mellan plasmakoncentrationen av lidokain eller monoetylglycinexylididid och spädbarnets kroppsvikt när måttliga mängder lidokain (dvs. 0,3 mL/kg lidokaingel 20 mg/ml) användes för smörjning av både intranasala och endotrakeala tuber. Inget nyfött barn hade plasmanivåer av lidokain över 750 mcg/L. Doserna till barn bör minskas, i proportion till ålder, kroppsvikt och fysisk kondition. (Se DOSERING OCH ADMINISTRATION.)
Biverkningar
Biverkningar efter administrering av lidokain är av liknande slag som de som observerats för andra lokalbedövningsmedel av amid-typ. Dessa biverkningar är i allmänhet dosrelaterade och kan bero på höga plasmanivåer orsakade av överdriven dosering eller snabb absorption, eller kan bero på en överkänslighet, idiosynkrasi eller minskad tolerans hos patienten. Allvarliga biverkningar är i allmänhet av systemisk karaktär. Följande typer är de som oftast rapporteras:
Det har förekommit sällsynta rapporter om ocklusion av endotrakealtuben i samband med förekomst av torkade gelérester i tubens inre lumen. (Se även VARNINGAR och DOSERING OCH ADMINISTRATION.)
Centrala nervsystemet: CNS-manifestationer är excitatoriska och/eller depressiva och kan kännetecknas av lätt huvudvärk, nervositet, oro, eufori, förvirring, yrsel, dåsighet, tinnitus, suddig eller dubbel syn, kräkningar, känslor av värme, kyla eller domningar, ryckningar, skakningar, kramper, konvulsioner, medvetslöshet, andningsdepression och hjärtstillestånd. De excitatoriska manifestationerna kan vara mycket korta eller kan inte förekomma alls, i vilket fall den första manifestationen av toxicitet kan vara dåsighet som övergår i medvetslöshet och andningsstillestånd.
Dåsighet efter administrering av lidokain är vanligen ett tidigt tecken på en hög blodnivå av läkemedlet och kan uppträda som en följd av snabb absorption.
Hjärt- och kärlsystem: Kardiovaskulära manifestationer är vanligtvis depressiva och kännetecknas av bradykardi, hypotoni och kardiovaskulär kollaps som kan leda till hjärtstillestånd.
Allergiskt: Allergiska reaktioner kännetecknas av kutana lesioner, urtikaria, ödem eller anafylaktoida reaktioner. Allergiska reaktioner kan uppstå till följd av känslighet antingen för det lokalanestetiska medlet eller andra komponenter i formuleringen. Allergiska reaktioner till följd av känslighet för lidokain är extremt sällsynta och om de inträffar bör de hanteras med konventionella metoder. Detektion av känslighet genom hudtest är av tveksamt värde.
ÖVERDOSERING
Akuta nödsituationer till följd av lokalanestetika är i allmänhet relaterade till höga plasmanivåer som påträffas vid terapeutisk användning av lokalanestetika. (Se BOTSE REAKTIONER, VARNINGAR och FÖRSIKTIGHETER.)
Hantering av nödsituationer med lokalbedövningsmedel: Det första övervägandet är att förebygga, vilket bäst uppnås genom noggrann och konstant övervakning av kardiovaskulära och respiratoriska vitala tecken och patientens medvetandetillstånd efter varje administrering av lokalbedövningsmedel. Vid första tecken på förändring bör syre administreras.
Det första steget i hanteringen av kramper består av omedelbar uppmärksamhet på upprätthållandet av öppna luftvägar och assisterad eller kontrollerad ventilation med syre och ett leveranssystem som kan möjliggöra omedelbart positivt luftvägstryck via mask. Omedelbart efter införandet av dessa ventilationsåtgärder bör cirkulationens tillräcklighet utvärderas, med tanke på att läkemedel som används för att behandla kramper ibland trycker ned cirkulationen när de administreras intravenöst. Om kramperna kvarstår trots adekvat andningsstöd, och om cirkulationen tillåter det, kan små doser av en ultrakortverkande barbiturat (t.ex. tiopental eller tiamylal) eller en bensodiazepin (t.ex. diazepam) administreras intravenöst. Klinikern bör känna till dessa antikonvulsiva läkemedel innan lokalbedövning används. Understödjande behandling av cirkulationsdepression kan kräva administrering av intravenösa vätskor och, när det är lämpligt, en vasopressor som styrs av den kliniska situationen (t.ex. efedrin).
Om inte behandling sker omedelbart kan både kramper och kardiovaskulär depression leda till hypoxi, acidos, bradykardi, arytmier och hjärtstillestånd. Om hjärtstillestånd skulle inträffa ska standardåtgärder för kardiopulmonell återupplivning sättas in.
Dialys är av försumbart värde vid behandling av akut överdosering med lidokain.
Den orala LD50 av lidokain HCI hos icke-nyktra honråttor är 459 (346-773) mg/kg (som salt) och 214 (159-324) mg/kg (som salt) hos fastande honråttor.
DOSERING OCH ADMINISTRATION
När lidokain HCI 2 % gelé används samtidigt med andra produkter som innehåller lidokain måste den totala dosen som alla formuleringar bidrar med hållas i åtanke.
Dosen varierar och är beroende av det område som ska bedövas, vävnadernas kärlkänslighet, den individuella toleransen och anestesitekniken. Den lägsta dos som behövs för att ge effektiv anestesi bör administreras. Doserna bör minskas för barn och för äldre och försvagade patienter. Även om förekomsten av biverkningar med Lidocaine HCI 2% Jelly är ganska låg bör försiktighet iakttas, särskilt vid användning av stora mängder, eftersom förekomsten av biverkningar är direkt proportionell mot den totala dosen av lokalt anestetiskt medel som administreras.
För ytlig anestesi av den manliga vuxna urinröret: Vid användning av 30 mL tuber med Lidocaine 2% gelé, sterilisera plastkonen i kokande vatten i 5 minuter, svalna och fäst den på tuben. Konen kan gassteriliseras eller kallsteriliseras, beroende på vad som föredras. Instillera långsamt cirka 15 mL (300 mg lidokain HCI) i urinröret eller tills patienten har en känsla av spänning. En penisklämma appliceras sedan i flera minuter vid koronan. En ytterligare dos på högst 15 mL (300 mg) kan instilleras för adekvat anestesi.
För sondering eller cystoskopi bör en penisklämma appliceras i 5-10 minuter för att uppnå adekvat anestesi. En total dos på 30 mL (600 mg) krävs vanligtvis för att fylla och dilatera det manliga urinröret.
För kateterisering är mindre volymer på 5 till 10 mL (100 till 200 mg) vanligtvis tillräckliga för smörjning.
För ytlig anestesi av kvinnliga vuxnas urinrör: Vid användning av 30 mL tuber med Lidocaine 2% gelé, sterilisera plastkonen i 5 minuter i kokande vatten, svalna och fäst den på tuben. Konen kan gassteriliseras eller kallsteriliseras, beroende på vad som föredras. Instillera långsamt 3 till 5 mL (60 till 100 mg lidokain HCI) av gelén i urinröret. Om så önskas kan lite gelé läggas på en bomullspinne och föras in i urinröret. För att erhålla adekvat anestesi bör man vänta flera minuter innan man utför urologiska ingrepp.
Lubrication for Endotracheal Intubation (smörjning för endotrakeal intubation): Applicera en måttlig mängd gelé på den yttre ytan av endotrakealtuben strax före användning. Man bör vara försiktig så att produkten inte kommer in i tubens lumen. Använd inte gelén för att smörja endotrakeala styletter. Se VARNINGAR och BIDRADSREAKTIONER angående sällsynta rapporter om ocklusion av inre lumen. Det rekommenderas också att användning av endotrakealtuber med torkad gelé på den yttre ytan undviks på grund av bristande smörjverkan.
MAXIMAL DOSERING
Inte mer än 600 mg lidokain HCI bör ges under en 12-timmarsperiod.
Barn: Det är svårt att rekommendera en maximal dos av något läkemedel för barn eftersom denna varierar som en funktion av ålder och vikt. För barn under tio år som har en normal muskelmassa och en normal muskelutveckling kan den maximala dosen bestämmas genom tillämpning av en av de standardiserade pediatriska läkemedelsformlerna (t.ex. Clarks regel). Till exempel bör dosen av lidokainhydroklorid hos ett barn på fem år som väger 50 pund inte överstiga 75 till 100 mg när den beräknas enligt Clarks regel. I vilket fall som helst bör den maximala mängden Lidocaine HCI som administreras inte överstiga 4,5 mg/kg (2 mg/lb) kroppsvikt.
Hur levereras
Lidocaine HCI 2% gelé levereras i de angivna doseringsformerna.
NDC 17478-840-30 30 mL aluminiumtub
NDC 17478-840-05 5 mL aluminiumtub
En avtagbar applikatorkon och en nyckel för att uttrycka innehållet ingår i 30 mL kartong.
Lagring: Förvaring: Förvaras vid 20° till 25°C (68° till 77°F) .
PREMIERProRx®
Hanterat av:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® är ett registrerat varumärke som tillhör Premier Inc, som används under licens.
PLD00N Rev. 10/15
Principal Display Panel Text for Container Label:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Sterile 5 mL

Principal Display Panel Text for Carton Label:
NDC 17478-840-05 Steril 5 mL
Lidokainhydrokloridgelé USP, 2%
Rx only
Premier Logo

| LIDOCAINE lidokainhydrokloridhydrokloridgelé |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiketterare – Akorn, Inc. (117696770)
Registrant – Akorn Operating Company LLC (117693100)
| Etablering | |||
| Namn | Adress | ID/FEI | Operations |
| Akorn, Inc | 117696840 | FÄRGNING(17478-840), ANALYS(17478-840), STERILISERA(17478-840), FÖRVARING(17478-840), FÖRPACKNING(17478-840), ETIKALISERA(17478-840) | |
Mer om lidokain aktuellt
- Biverkningar
- Under graviditet eller amning
- Doseringsinformation
- Läkemedelsinteraktioner
- Växelalternativ
- Prissättning & Kuponger
- En Español
- 208 Recensioner
- Läkemedelsklass: Aktuella bedövningsmedel
- FDA-varningar (5)
Konsumentresurser
- Patientinformation
- Lidokain Lokal applikation (Avancerad läsning)
Professionella resurser
- Förskrivningsinformation
- Lidokain (topisk) (Professionell patientrådgivning)
- Lidokainkräm (FDA)
- Lidokaingel (FDA)
- Lidokain Laryngotrakeal lösning (FDA)
- … +9 mer
Andra varumärken Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 mer
Relaterade behandlingsguider
- Anal klåda
- Gastrointestinal kirurgi
- Anestesi
- Brännskador, yttre
- … +9 mer
Medicinsk ansvarsfriskrivning
