 |
|
Syra/basreaktioner är allestädes närvarande. I vattenlösningar ökar syror koncentrationen av vätejoner (H+). Baser å andra sidan ökar koncentrationen av hydroxidjoner (OH-). När en syra och en bas reagerar i en vattenlösning förenas H+- och OH- jonerna och bildar vatten. Dessa joner ”neutraliserar” alltså varandra:
De flesta syror har den allmänna formeln HA, där A- är en anjon och de flesta baser har formen BOH, där B+ är en lämplig katjon. Syror och baser kan delas in i två allmänna typer: starka och svaga syror och baser. Skillnaden mellan de två är enkel: en stark syra i en vattenlösning sönderdelas till 100 % till en proton (H+) och en anjon (A-)
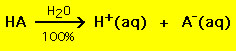
Däremot sönderdelas de flesta svaga syror betydligt mindre än 100 % i en vattenlösning:
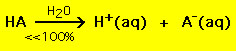 .
.Med andra ord förblir de flesta svaga syramolekyler intakta i vatten. Liknande kemiska ekvationer gäller för starka och svaga baser.
Det finns bara några få svaga syror och baser, de är:
| |
|
|
HCl (saltsyra) HNO3 (salpetersyra) HClO4 (perklorsyra) . H2SO4 (svavelsyra) |
NaOH (natriumhydroxid) KOH (kaliumhydroxid) Ca(OH)2 (kalciumhydroxid) |
Alla andra syror och baser är svaga. En svag syra uppstår av vilken anjon som helst. Exempel ges nedan
| |
|
|
F- (fluorid) Br- (bromid) I- (jodid) HCO3- (bikarbonat) C2H3O2- (acetat) MnO4- (permanganat) PO4-3 (fosfat) CrO4-2 (kromat) CN- (cyanid) NO2- (nitrit) SO3-2 (sulfit) |
HF (fluorvätesyra) HBr (bromvätesyra) HI (jodväte) H2CO3 (kolsyra) HC2H3O2 (ättiksyra) HMnO4 (permangansyra) H3PO4 (fosforsyra) syra) H2CrO4 (kromsyra) HCN (cyanväte) HNO2 (salpetersyra) H2SO3 (svavelsyra) |
I en typisk syra-basreaktion reagerar syran och basen och bildar ett salt och vatten e.g., cyanväte och natriumhydroxid:
