15.4 Fysikaliska egenskaper hos karboxylsyror
Lärandemål
- Genomföra kokpunkterna hos karboxylsyror med alkoholer med liknande molmassa.
- Genomföra lösligheten av karboxylsyror i vatten med lösligheten av jämförbara alkaner och alkoholer i vatten.
Många karboxylsyror är färglösa vätskor med obehaglig lukt. Karboxylsyrorna med 5 till 10 kolatomer har alla en ”getliknande” lukt (vilket förklarar lukten av Limburgerost). Dessa syror produceras också av hudbakterier när de påverkar människans talg (hudoljor), vilket förklarar lukten i dåligt ventilerade omklädningsrum. Syror med mer än 10 kolatomer är vaxliknande fasta ämnen, och deras lukt avtar med ökande molmassa och därmed minskande flyktighet.
Karboxylsyror uppvisar stark vätebindning mellan molekylerna. De har därför höga kokpunkter jämfört med andra ämnen med jämförbar molarmassa.
Karboxylgruppen går lätt in i vätebindning med vattenmolekyler (Figur 15.3 ”Vätebindning mellan en ättiksyramolekyl och vattenmolekyler”). Syrorna med en till fyra kolatomer är helt blandbara med vatten. Lösligheten minskar när kolkedjelängden ökar eftersom dipolkrafterna blir mindre viktiga och dispersionskrafterna blir mer dominerande. Hexansyra är knappt löslig i vatten (ca 1,0 g/100 g vatten). Palmitinsyra, med sin stora opolära kolvätekomponent, är i princip olöslig i vatten. Karboxylsyrorna är i allmänhet lösliga i organiska lösningsmedel som etanol, toluen och dietyleter.
Figur 15.3 Vätebindning mellan en ättiksyramolekyl och vattenmolekyler
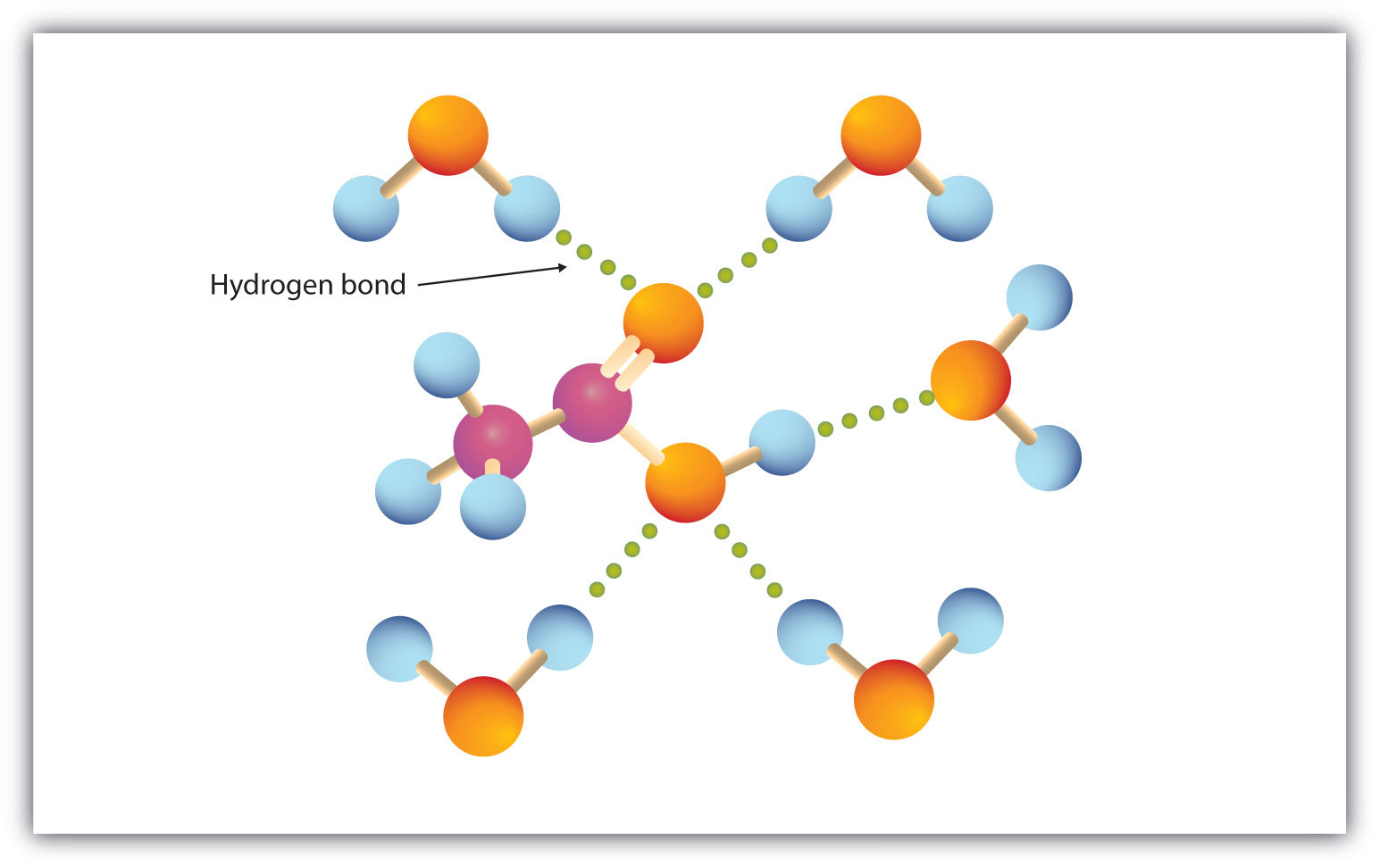
Karboxylsyror med låg molarmassa är ganska lättlösliga i vatten.
Tabell 15.2 ”Fysikaliska konstanter för karboxylsyror” listar några fysikaliska egenskaper för utvalda karboxylsyror. De sex första är homologer. Lägg märke till att kokpunkterna ökar med ökande molarmassa, men att smältpunkterna inte visar något regelbundet mönster.
Tabell 15.2 Fysikaliska konstanter för karboxylsyror
| Kondenserad strukturformel | Namn på syra | Smältpunkt (°C) | Kokpunkt (°C) | Löslighet (g/100 g vatten) |
|---|---|---|---|---|
| HCOOH | myrsyra | 8 | 100 | blandbar |
| CH3COOH | ättiksyra | 17 | 118 | blandbar |
| CH3CH2COOH | propionsyra | -22 | 141 | blandbar |
| CH3(CH2)2COOH | mörsyra | -5 | 163 | blandbar |
| CH3(CH2)3COOH | ervärinsyra | -35 | 187 | 5 |
| CH3(CH2)4COOH | kapronsyra | -3 | 205 | 1.1 |
| C6H5COOH | benzoesyra | 122 | 249 | 0.29 |
Begreppsgenomgångsövningar
-
Vilken förening har högre kokpunkt-butansyra (molmassa 88) eller 2-pentanon (molmassa 86)? Förklara.
-
Vill du förvänta dig att smörsyra (butansyra) är mer eller mindre löslig än 1-butanol i vatten? Förklara.
Svar
-
Buttersyra på grund av vätebindning (Det finns ingen intermolekylär vätebindning i 2-pentanon.)
-
mer löslig eftersom det finns mer omfattande vätebindning
Nyckelresultat
- Karboxylsyror har hög kokpunkt jämfört med andra ämnen med jämförbar molmassa. Kokpunkten ökar med molarmassan.
- Karboxylsyror med en till fyra kolatomer är helt blandbara med vatten. Lösligheten minskar med molarmassan.
Övningar
-
Vilken förening har den högre kokpunkten-CH3CH2CH2CH2OCH2CH3 eller CH3CH2CH2COOH? Förklara.
-
Vilken förening har den högre kokpunkten-CH3CH2CH2CH2CH2CH2OH eller CH3CH2CH2COOH? Förklara.
-
Vilken förening är mer löslig i vatten-CH3COOH eller CH3CH2CH2CH2CH3? Förklara.
-
Vilken förening är mer löslig i vatten-CH3CH2COOH eller CH3CH2CH2CH2CH2CH2COOH? Förklara.
Svar
-
CH3CH2CH2CH2COOH på grund av vätebindning (Det finns ingen intermolekylär vätebindning med CH3CH2CH2OCH2CH3.)
-
CH3COOH på grund av att den har vätebindning med vatten (Det finns ingen intermolekylär vätebindning med CH3CH2CH2CH3.)
