Kliniker har länge varit frustrerade över den oproportionerliga roll som det intraokulära trycket (IOP) spelar i glaukomvården. Eftersom det är den enda faktorn som är möjlig att ingripa medicinskt eller kirurgiskt är dess roll avgörande. Ändå är tonometri i sig begränsad: En enda mätning som görs med några månaders mellanrum kan inte skildra IOP:s dygnsmässiga ebb och flod. Inte ens att ta in patienter för flera tonometriavläsningar ger en idealisk bild av patientens IOP-egenskaper.

|
|
| Denna implanterbara mikrofluidiska dygnet-runt-IOP-övervakningssensor är för närvarande under utveckling vid Stanford University. Foto: Ishmail E. Araci |
Experter tror att man så småningom kommer att utrusta patienter med en liten sensor som sitter på en kontaktlins eller ett par glasögon, eller skicka dem till en ögonläkare för att få en sådan implanterad i ögat. Den skulle kontinuerligt mäta IOP, vilket exponentiellt ökar kvantiteten – och förhoppningsvis värdet – av de data som du får. Om det nuvarande tillvägagångssättet för IOP-dokumentation är som att ta en ögonblicksbild, är kontinuerlig IOP-övervakning dygnet runt mer likt en videoinspelning som registrerar förändringar över tiden än att bara ge en statisk avläsning.
Dessa prylar är fortfarande under utveckling. Är de redo för prime time? Låt oss ta en titt på hur IOP fluktuerar, de kliniska utmaningar det skapar och den nuvarande toppmoderna tekniken som försöker följa IOP bättre för att möjliggöra större klinisk förståelse.
Ett rörligt mål
Att sätta upp en behandlingsplan som bygger på att uppnå ett mål för IOP är knepigt när själva målet är rörligt. IOP fluktuerar under hela dagen – timme för timme, minut för minut, till och med sekund för sekund – baserat på en mängd olika endogena och exogena faktorer.
I det okulära systemet kan IOP bero på balansen mellan produktion av kammarvattenhumör, utflödesförmåga (hur lätt kammarvattenhumör lämnar ögat), episkleralt venöst tryck (trycket i venerna på ögats yta) och uveoskleralt utflöde (en sekundär väg för kammarvattenhumör att lämna ögat).
En ökning av utflödet eller en minskning av produktionen av kammarvatten skulle till exempel sänka IOP, säger Arthur J. Sit, MD, glaukomforskare vid Mayo Clinic i Rochester, Minn. Kortsiktiga hopp i IOP kan också uppstå på grund av tryck på ögat när man blinkar eller gnuggar ögat eller till och med under ögonrörelser eller blodtryckspulser.
Intraokulärt tryck fluktuerar också på grund av kroppsposition, tid på dygnet (toppar på natten, dalar under dagen), blodtryck och det relaterade begreppet okulärt perfusionstryck (OPP), stress- eller smärtnivåer, vatten- och koffeinintag.
För övrigt kan kraftig aktivitet och stress få blodtryck, IOP och OPP att nå toppar, säger Kaweh Mansouri, MD, MPH, ögonläkare vid universitetet i Genève och University of Colorado Denver. Mätning av blodtrycket i samband med IOP har ett värde för att fastställa hur blodtrycket påverkar IOP, säger Dr Mansouri. Forskare använder för närvarande IOP-övervakningsenheter som övervakar IOP dygnet runt för att undersöka dessa effekter på glaukomutvecklingen.
|
Dos and Don’ts of IOP Measurement Diagnostisera eller behandla inte efter bara en mätning. Dr Sowka råder optiker att inte påbörja behandling omedelbart om inte trycket är överdrivet högt eller om synnerverna redan är allvarligt skadade och sårbara; mät i stället trycket flera gånger. Det är också en bra idé att få flera tryckmätningar efter att behandlingen har inletts för att avgöra om medicinen fungerar, säger Dr Sowka. En IOP-mätning efter att man börjat med en medicinering är verkligen inte tillräckligt för att bedöma verklig effekt. Säg till patienterna att slappna av. Som tidigare nämnts kan patienterna anstränga sig eller hålla andan under tonometrin. Säg regelbundet till dem att slappna av och andas normalt under processen, uppmanar dr Mansouri. Släpp inte taget om dina misstankar. Om patientens IOP-mätningar inte verkar stämma överens med dina bedömningar av synfältet och synnerven kan det vara mer på gång med patientens IOP än vad du insåg, säger dr Hartwick. Be dem komma tillbaka och mäta sitt IOP vid en annan tidpunkt på dagen, tillägger han. Överväg en dygnskurva hos utvalda patienter. Att registrera en dygnskurva tonometriskt är opraktiskt och omständligt för de flesta patienter. Men om IOP-nivån och skadans omfattning verkar ojämna – till exempel när du misstänker normalspänningsglaukom – kan du överväga möjligheten, säger dr Davey. Om patienten är villig, ta in honom eller henne tidigt på morgonen och registrera IOP varje timme under åtta till tio timmar. ”Det ger dig kontorets dygnskurva, som kanske inte är helt representativ för dag/natt-värdena, men det ger dig åtminstone mer än en mätning”, säger han. |
Här är hur dessa variabler påverkar IOP:
– Kroppsposition. Beroende på patientens position i stolen kan trycket öka eller minska. IOP är till exempel lägst när patienten sitter i ett neutralt läge. ”Nästan allt annat får IOP att öka, inklusive att böja nacken framåt, böja huvudet bakåt, vrida huvudet åt sidan, ligga ner, böja sig framåt, blinka eller gnugga ögonen”, säger dr Sit.
– Vattenförbrukning. Att dricka en stor mängd vatten gör att patientens blodvolym ökar under en kort tid. Det venösa trycket stiger också när patienten konsumerar mer vatten. ”Allt de behöver göra är att konsumera 16 till 32 oz, vilket är en eller två små flaskor vatten, och inom fem minuter kommer trycket att stiga med 6 mm Hg”, säger Pinakin Gunvant Davey, PhD, OD, professor och glaukomexpert vid College of Optometry vid Western University of Health Sciences i Pomona, Kalifornien.
– Tid på dagen. Litteraturen har visat att det högsta IOP-värdet inträffar på natten hos två tredjedelar av patienterna. Orsaken är att vattenkärl inte utsöndras tillräckligt mycket på natten, säger Joseph Sowka, OD, professor i optometri vid Nova Southeastern University College of Optometry i Ft. Lauderdale, Fla.
Till exempel observerade dr Mansouri patienter i 24 timmar i sömnlaboratorier och fann att IOP var som högst på natten. Även om dina patienter inte blir föremål för sömnstudier kan de komma till din mottagning på kvällen – om så är fallet kan du förvänta dig att se förhöjda IOP i förhållande till andra tider på dygnet.
– Blodtryck. Baslinje IOP baseras på hjärtcykel, systoliskt och diastoliskt blodtryck. Den kraft som används för att föra in blod i ögat är det okulära perfusionstrycket, förklarar James L. Fanelli, OD, vid Cape Fear Eye Institute i Wilmington, NC.
Om blodtrycket är lågt finns det mindre kraft för att ”trycka” blodet in i ögat, och därmed mindre perfusionstryck till ögat. Faktorer som får IOP att stiga kommer att ha en effekt på att sänka perfusionstrycket, och faktorer som sänker blodtrycket kommer också att resultera i lägre perfusionstryck – eller en kombination av någon av dessa faktorer kan spela en roll, säger Dr Fanelli. Blodtrycket tenderar att sänkas under sömntimmarna tidigt på morgonen, vilket också är den tid på dygnet då IOP tenderar att vara högst.1 Dessa två motsatta faktorer kan ha en dubbel effekt när det gäller att sänka OPP under nattliga timmar, vilket kan möjliggöra en ökad skada på okulära nervhuvudet.
– Stress. En ökning eller minskning av stress orsakar hormonella förändringar som driver upp eller ner IOP-nivåerna. En av dr Mansouris patienter – som studerades med hjälp av en sensor för 24-timmars IOP-övervakning på en kontaktlins – hade tryckspikar när hennes hund hade epileptiska anfall på natten.
– Allmänt om ”nerver”. Det är möjligt att hos vissa patienter kan stressen i samband med själva ögonundersökningen – till exempel om de är oroliga för att få diagnosen glaukom – få deras IOP att stiga, säger Andrew Hartwick, OD, PhD, docent vid Ohio State University College of Optometry i Columbus. De kan till exempel knipa ihop ögonen för att de är stressade över undersökningen och IOP-värdena stiger.
– Smärta orsakar också ökningar av IOP eftersom den orsakar stress. En av dr Mansouris patienter slog hårt mot sitt ben på en parkeringsplats. Det fanns en topp i hennes IOP-nivå i exakt det ögonblick då hon mindes att olyckan inträffade, enligt data från 24-timmarsövervakningen.
Konsekvenser av felaktiga IOP-avläsningar
Studier har indikerat att toppar i IOP kan bidra till glaukomutvecklingen.2,3 Men om du undersöker en patient när IOP är som lägst eller högst, kan du över- eller underskatta diagnosen av glaukom eller den behandling som krävs för patienten.
”Om vi fångar en patient när IOP är som lägst kan det leda oss bort från att överväga glaukom”, särskilt om avläsningen faller inom ett statistiskt normalt intervall, säger Dr Sowka. ”Andra gånger kan vi få tag på dem vid en IOP-topp, där den ligger lite över det normala – ett scenario som tenderar att få behandlare att oroa sig i onödan.”
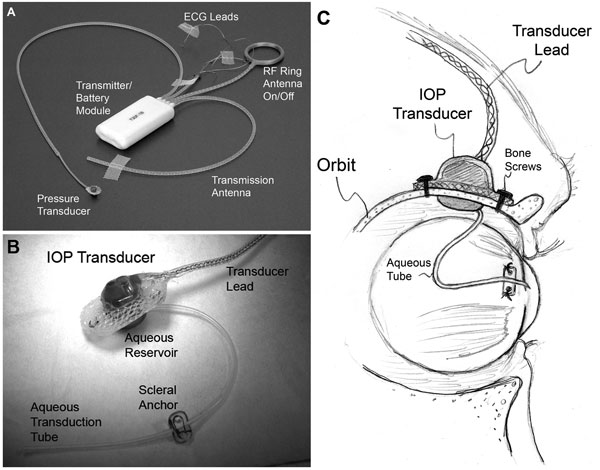
|
|
| (A) Ett typiskt T30F totalimplantatsystem (Konigsberg Instruments). (B) Den extraorbitala ytan på det anpassade IOP-transducerhöljet. (C) Ett 23-gauge silikonrör levererar vatten från den främre kammaren till en vätskebehållare på den intraorbitala sidan av transduktorn (delvis dold från bild i B); Röret (med lämplig slapphet för att möjliggöra ögonrörelse) trimmades och fördes in i den främre kammaren. |
Registrering av ett IOP-intervall skulle potentiellt kunna möjliggöra en förbättring av glaukomdiagnostik och -hantering. ”Om forskarna kan visa att specifika IOP-mönster under 24 timmar är relaterade till utvecklingen av glaukom finns det hopp om att upptäckten av dessa mönster skulle kunna hjälpa till att identifiera patienter med ökad risk för utveckling och göra det möjligt för oss att anpassa deras behandling i enlighet med detta”, säger Dr Mansouri.
Glaukom skulle kunna identifieras tidigare, vilket skulle göra det möjligt att påbörja operation eller medicinering snabbare, tillägger han. Ögonläkare skulle också kunna avgöra om IOP-sänkande läkemedel är effektiva på natten eller under specifika aktiviteter som höjer IOP.
För att fastställa ett verkligt IOP-intervall krävs kontinuerlig IOP-övervakning dygnet runt. Detta är en utmaning, eftersom en enda IOP-mätning som samlas in under normala kontorstider inte fångar upp området för en patients IOP, dess toppar eller förändringar under dagen.4
Inteftersom IOP-området bestäms är det just nu möjligt att använda Goldman-applanationstonometri (GAT) med hjälp av en dygnsspänningskurva (DTC), där IOP-avläsningar fångas upp vid olika tidpunkter under klinikens timmar. Men detta är problematiskt för både behandlare och patient. Nattliga kurvor registreras inte, och färre än 1 % av patienterna genomgår DTC eller IOP-övervakning i ett sömnlaboratorium.4
Förvisso mätte forskare IOP i 24 timmar och dokumenterade inte bara att IOP når toppar nattetid, utan också att IOP-fluktuationerna var mycket större under icke-kontorstid.5 I en studie av 35 patienter vars IOP registrerades med hjälp av en pneumatonometer i ett sömnlaboratorium i 24 timmar registrerades de flesta topparna i IOP nattetid hos äldre glaukompatienter jämfört med friska personer, vare sig de satt eller låg ner.6
På senare tid har forskare som använder sig av 24-timmarsövervakning lärt sig att det genomsnittliga IOP inte bara stiger på natten, utan att det faktiskt är en konstant ökning – och mer under dagen än på natten.7 Forskare vid Devers Eye Institute i Portland, Ore, använde sig av ett telemetrisystem som var implanterat i apornas ögon för att registrera 500 IOP-mätningar per sekund.
De fann att IOP fluktuerar mycket mer än vad man tidigare trott. ”Blinkningar och ögonrörelser genererar stora IOP-spikar som inträffar cirka 12 000 gånger per timme och utgör cirka 12 % av den totala IOP-energi som ögat måste absorbera under vakna timmar”, konstaterade forskarna. De tror att dessa uppgifter hos aporna kommer att vara ungefär desamma hos människor. ”IOP måste nu betraktas som dynamiskt och ständigt föränderligt, och IOP-fluktuationer kan visa sig vara en viktig bidragande orsak till glaukom. ”8
De fann också att dygnscykeln inte upprepas från dag till dag. Därav behovet av kontinuerlig IOP-övervakning. De nuvarande prototyperna omfattar implanterade sensorer och kontaktlinsbaserade anordningar.
Intelligent Implantables
Flera nystartade företag har utvecklat telemetriska trycksensorer som kan implanteras under katarakt- eller glaukomkirurgi. ”Telemetrisk innebär att tryckmätningarna registreras på distans (dvs. från insidan av ögat) och överförs trådlöst till en extern läsare”, säger Dr Sit.
Implanterbara anordningar som för närvarande studeras är bland annat:

|
|
|
Pro-IOP-sensor är en telemetrisk anordning som implanteras som en IOL. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. Tyska Implandata Ophthalmic Products arbetar med Pro-IOP, en trådlös intraokulär tryckgivare (WIT) som drivs telemetriskt av en handhållen enhet. WIT:n liknar en liten plastring och mäter 11,3 mm i diameter.9 Den innehåller trycksensorer, en temperatursensor, en identifieringskodare, en analog-till-digital-kodare och en telemetrienhet i ett enda mikroelektromekaniskt system.9
Ett RFID-chip med inbyggd antenn sänder 24-timmars IOP-avläsningar till en extern handhållen läsare. Patienten och läkaren kan också så småningom få möjlighet att ta emot uppgifterna via en smartphone-app. Patienten skulle också kunna kommunicera med läkaren om IOP-avläsningar i appen.
Anordningen har ännu inte fått CE-märkning i Europa eller FDA-godkännande i USA, men forskare i Tyskland satte nyligen in Pro-IOP i den första mänskliga försökspersonen, en kvinna i 60-årsåldern; inga data har publicerats ännu.9
– AcuMEMs. AcuMEMs är ett implantat som håller på att utvecklas av ett amerikanskt företag med samma namn och fungerar på samma sätt som Pro-IOP. Sensorn är en kapacitiv trycksensor som ändrar form med fluktuationer i IOP. ”När den ändrar form förändras den elektriska kapacitansen och detta kan detekteras externt med läsaren”, säger Dr Sit.
Sensorn kan implanteras i främre kammaren som ett fristående ingrepp eller som en del av glaukomkirurgi; den kan också sättas in i kapselsäcken vid kataraktkirurgi.
– Mikrofluidiskt IOL-implantat. Forskare vid Stanford University och Bar-Ilan University i Israel utvecklar tillsammans en implanterbar mikrofluidisk sensor. IOP skulle mätas ”baserat på ett etablerat jämviktstryck mellan en intraokulär vätska och gas” som finns i kamrarna i sensorn, enligt patentet på anordningen. Patienter och läkare skulle kunna använda sina smarttelefoner eller en extern läsare för att kontrollera sitt IOP.10 Uppfinnarna väntar på patentgodkännande för sensorn.
Signalen som överförs från enheter som är implanterade i ögat kan i teorin vara mer exakt än de som är fästade på kontaktlinser, säger dr Davey. Signalstyrkan beror på hur mycket energi enheten avger. ”Vi implanterade båda enheterna (Pro-IOP och AcuMEMs) och de fungerade inte så bra”, säger Dr Davey.
Både Pro-IOP- och AcuMEMs-läsarna skulle eventuellt kunna fästas på ett par glasögon, och data skulle samlas in på samma sätt, säger Dr Sit.
Clever Contact Lenses
Forskare undersökte först kontaktlinsensensorer på 1970-talet, men de hårda kontaktlinser som fanns tillgängliga var för obekväma och förändrade den strukturella integriteten hos patientens öga, enligt Dr Davey.
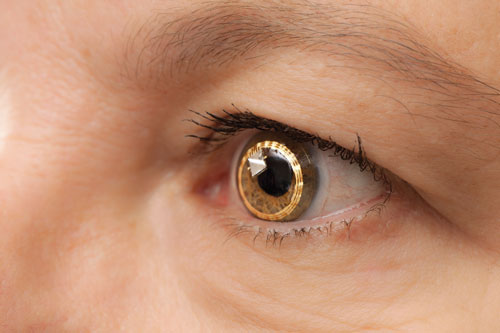
|
|
| Sensimed Triggerfish på ögat. Den genomgår fortfarande kliniska försök i USA. |
Sensorerna var inte heller tillräckligt känsliga. ”Personen med ett ”mjukare” öga hade mer exakta avläsningar än en person med ett styvare öga”, säger dr Davey. ”Tekniken var inte tillräckligt bra för att få fram IOP-värden.” En tjockare hornhinna reagerar mindre lätt på IOP-förändringar, vilket gör tonometri (och kontaktlinsensensorer) mindre exakt.
Kontaktlinsbaserade IOP-sensorer inkluderar:
– Triggerfish (Sensimed). Vid universitetet i Genève i Schweiz genomförde ögonläkare tidiga undersökningar av en kontaktlins kallad Triggerfish, under ledning av Dr. Mansouri och andra.
The Triggerfish är en hydrofil mjuk kontaktlins utrustad med en kontaktlinsensensor (CLS). CLS har två sträckmätare som är placerade runt limbus och som registrerar förändringar i okulär omkrets. ”Dessa förändringar i okulär omkrets tros vara relaterade till förändringar i IOP och intraokulär volym, och detta har bevisats i enukleerade ögon”, säger Dr Mansouri. Apparaten mäter en blandning av IOP, intraokulär volym och förändringar av biomekaniska egenskaper (en kombination av hornhinnans och sklerans hysteres och styvhet) som korrelerar med fluktuationer i IOP. En extern läsare registrerar data under en 24-timmarsperiod.
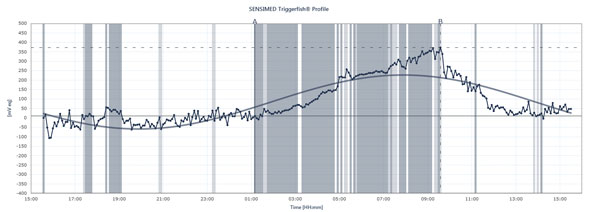
Flödesschemat visar toppar och dalar i IOP hos en patient som bär Sensimed Triggerfish under en 24-timmarsperiod.
Triggerfish är CE-märkt i Europa. FDA-godkännande har inte uppnåtts i USA och enheten genomgår fortfarande kliniska prövningar.
|
Triggerfish spårar IOP annorlunda Data som visas på den externa läsaren är en kombination av intraokulärt tryck, intraokulär volym och biomekaniska egenskaper hos ögat, förklarar Dr Mansouri. ”Det är användbart för att ge dig en uppfattning om de kvalitativa förändringarna under 24 timmar mer än de kvantitativa förändringarna eftersom vi inte kan översätta dem till millimeter kvicksilver”, säger han. Triggerfisken ger ändå värdefull information. Framtida studier med hjälp av apparaten kan hjälpa till att förklara hur instabilt eller stabilt trycket har varit under 24 timmar, när nattliga IOP-toppar inträffar, hur införande av behandling eller behandlingsförändringar påverkar 24-timmars IOP-mönster och hur specifika aktiviteter påverkar 24-timmars IOP-mönster, t.ex. yogapositioner, koffeinintag, stressiga situationer och andra orsaker till IOP-toppar som beskrivs ovan. Dr Mansouri låter också normala eller lågintensiva glaukompatienter genomgå samtidig 24-timmars blodtrycksmätning och 24-timmars IOP-mätning, eftersom toppar kan påverka OPP. Men kommer Triggerfish att visa ett samband mellan 24-timmars IOP-mönster och glaukomutveckling? Många studier pågår för att besvara denna viktiga fråga.
|
– Resonanskrets sensorkontaktlins. En annan smart CLS-anordning som håller på att utvecklas är en resonanskrets som består av en tunnfilmskondensator i kombination med en sensorspole som känner av hornhinnans krökningsdeformation. Den befinner sig i ett tidigt utvecklingsstadium under ledning av David C.C. Lam vid institutionen för mekanisk teknik och flygteknik vid Hong Kong University of Science and Technology.
I en studie från september 2014 testades CLS på en ögonmodell av silikongummi. Det visade sig att sensorn korrekt följde fluktuerande IOP.11
Likt mätning av glukosnivåer en gång om dagen för patienter med diabetes eller blodtryck en gång om dagen för patienter med hjärtsjukdomar, kan beroendet av en enda IOP-mätning resultera i felaktiga IOP-data. Men kanske kan du i en inte alltför avlägsen framtid med hjälp av apparater direkt från en science fiction-film – kontaktlinser och implanterbara sensorer – följa IOP med större förståelse och mindre krångel för dig och dina patienter.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Laboratoriebedömning av dygns- och nattliga okulära perfusionstryck hos människor. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Samband mellan intraokulära trycktoppar och progression av synfältsförlust. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Är 24-timmars övervakning av det intraokulära trycket nödvändigt vid glaukom? Semin Opththalmol. Maj 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Korrelation mellan högsta nattliga intraokulära tryck hos friska personer och glaukompatienter. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate: implantatsystemets prestanda och inledande karakterisering av IOP på flera tidsskalor. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Nya trender och heta ämnen. Presenterades måndagen den 5 maj 2014 vid ARVO:s årsmöte. Tillgänglig på: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Tillgänglig den 19 november 2014.
9. Melki S, Todani A, Cherfan G. An Implantable Intraocular Pressure Transducer Initial Safety Outcomes. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Implanterbar mikrofluidisk anordning för övervakning av intraokulärt tryck. Tillgänglig på: www.google.com/patents/WO2014137840A1?cl=en. Tillgänglig den 17 oktober 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Mjuk bärbar kontaktlinsensensor för kontinuerlig övervakning av intraokulärt tryck. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24-hour intraocular pressure rhythm in young healthy subjects evaluated with continuous monitoring using a contact lens sensor. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
