Lärandemål
- Definiera oktettregeln och dess roll i kemiska bindningar
Inte alla grundämnen har tillräckligt med elektroner för att fylla sina yttersta skal, men en atom är som mest stabil när alla elektronpositioner i det yttersta skalet är fyllda. På grund av dessa vakanser i de yttersta skalen ser vi bildandet av kemiska bindningar, eller interaktioner mellan två eller flera av samma eller olika grundämnen som resulterar i bildandet av molekyler. För att uppnå större stabilitet tenderar atomer att fylla sina yttersta skal helt och hållet och binder sig till andra grundämnen för att uppnå detta mål genom att dela elektroner, ta emot elektroner från en annan atom eller donera elektroner till en annan atom. Eftersom de yttersta skalen hos grundämnen med låga atomnummer (upp till kalcium, med atomnummer 20) kan rymma åtta elektroner, kallas detta för oktettregeln. Ett grundämne kan donera, acceptera eller dela elektroner med andra grundämnen för att fylla sitt yttersta skal och uppfylla oktettregeln.
En tidig modell av atomen utvecklades 1913 av den danske vetenskapsmannen Niels Bohr (1885-1962). Bohrs modell visar atomen som en central kärna som innehåller protoner och neutroner, med elektronerna i cirkulära elektronskal på specifika avstånd från kärnan, likt planeter som kretsar runt solen. Varje elektronskal har en annan energinivå, där de skal som ligger närmast kärnan har lägre energi än de som ligger längre bort från kärnan. Enligt konvention tilldelas varje skal ett nummer och symbolen n- – till exempel kallas elektronskalet närmast kärnan för 1n. För att förflytta sig mellan skalen måste en elektron absorbera eller avge en energimängd som exakt motsvarar skillnaden i energi mellan skalen. Om en elektron till exempel absorberar energi från en foton kan den bli exciterad och flytta sig till ett skal med högre energi; omvänt, när en exciterad elektron faller tillbaka till ett skal med lägre energi kommer den att avge energi, ofta i form av värme.
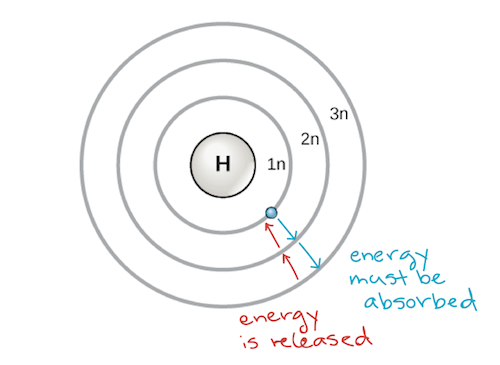
Bohrs modell av en atom, som visar energinivåer som koncentriska cirklar som omger atomkärnan. Energi måste tillföras för att flytta en elektron utåt till en högre energinivå, och energi frigörs när en elektron faller ner från en högre energinivå till en närmare energinivå. Bild: modifierad från OpenStax Biology
Atomer, liksom andra saker som styrs av fysikens lagar, tenderar att anta den mest stabila konfigurationen med lägst energi som de kan. Elektronskalen i en atom fylls således inifrån och ut, där elektronerna fyller de lågenergiska skalen närmare kärnan innan de flyttar in i de högenergiska skalen längre ut. Skalet närmast kärnan, 1n, kan rymma två elektroner, medan nästa skal, 2n, kan rymma åtta och det tredje skalet, 3n, kan rymma upp till arton.
Antalet elektroner i det yttersta skalet hos en viss atom bestämmer dess reaktivitet, eller benägenhet att bilda kemiska bindningar med andra atomer. Detta yttersta skal kallas för valensskalet, och de elektroner som finns i det kallas för valenselektroner. I allmänhet är atomer mest stabila och minst reaktiva när deras yttersta elektronskal är fullt. De flesta grundämnen som är viktiga inom biologin behöver åtta elektroner i sitt yttersta skal för att vara stabila, och denna tumregel är känd som oktettregeln. Vissa atomer kan vara stabila med en oktett trots att deras valensskal är 3n-skalet, som kan rymma upp till 18 elektroner. Vi kommer att utforska orsaken till detta när vi diskuterar elektronorbitaler nedan.
Exempel på några neutrala atomer och deras elektronkonfigurationer visas nedan. I den här tabellen kan du se att helium har ett fullt valensskal, med två elektroner i sitt första och enda, 1n, skal. På samma sätt har neon ett fullständigt yttre 2n-hölje med åtta elektroner. Dessa elektronkonfigurationer gör helium och neon mycket stabila. Även om argon tekniskt sett inte har ett fullständigt yttre skal, eftersom 3n-skalet kan innehålla upp till arton elektroner, är det stabilt som neon och helium eftersom det har åtta elektroner i 3n-skalet och därmed uppfyller oktettregeln. Däremot har klor endast sju elektroner i sitt yttersta skal, medan natrium endast har en. Dessa mönster fyller inte det yttersta skalet eller uppfyller oktettregeln, vilket gör klor och natrium reaktiva, ivriga att få eller förlora elektroner för att nå en stabilare konfiguration.
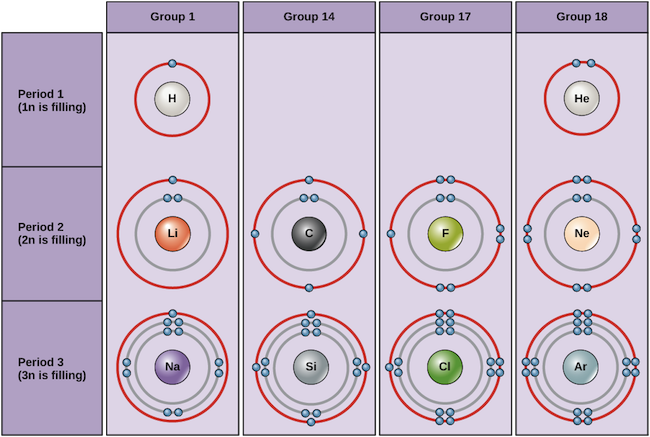
Bohrdiagram för olika grundämnen Bildkredit: OpenStax Biology
Elektronkonfigurationer och det periodiska systemet
Grundämnen placeras i ordning på det periodiska systemet baserat på deras atomnummer, hur många protoner de har. I en neutral atom kommer antalet elektroner att vara lika med antalet protoner, så vi kan enkelt bestämma elektronantalet från atomnumret. Dessutom ger ett grundämnes position i det periodiska systemet – dess kolumn, eller grupp, och rad, eller period – användbar information om hur dessa elektroner är ordnade.
Om vi bara betraktar de tre första raderna i tabellen, som innehåller de viktigaste grundämnena som är viktiga för livet, motsvarar varje rad fyllningen av ett annat elektronskal: helium och väte placerar sina elektroner i 1n-skalet, medan grundämnen i andra raden, som Li, börjar fylla 2n-skalet, och grundämnen i tredje raden, som Na, fortsätter med 3n-skalet. På samma sätt ger ett grundämnes kolumnnummer information om dess antal valenceelektroner och reaktivitet. I allmänhet är antalet valenceelektroner detsamma inom en kolumn och ökar från vänster till höger inom en rad. Grundämnen i grupp 1 har bara en valenselektron och grundämnen i grupp 18 har åtta, med undantag för helium som bara har två elektroner totalt. Gruppnumret är således en bra förutsägelse för hur reaktivt varje grundämne kommer att vara:
- Helium (He), neon (Ne) och argon (Ar), som grundämnen i grupp 18, har yttre elektronskal som är fulla eller uppfyller oktettregeln. Detta gör dem mycket stabila som enskilda atomer. På grund av att de inte är reaktiva kallas de inerta gaser eller ädelgaser.
- Hydrogen (H), litium (Li) och natrium (Na), som är grundämnen i grupp 1, har bara en elektron i sina yttersta elektronskal. De är instabila som enskilda atomer, men kan bli stabila genom att förlora eller dela sin ena valenselektron. Om dessa grundämnen helt förlorar en elektron – vilket Li och Na vanligtvis gör – blir de positivt laddade joner: Li+, Na+.
- Fluor (F) och klor (Cl) har som grundämnen i grupp 17 sju elektroner i sina yttersta skal. De tenderar att uppnå en stabil oktett genom att ta en elektron från andra atomer och blir negativt laddade joner: F- och Cl-.
- Kol (C), som är ett grundämne i grupp 14, har fyra elektroner i sitt yttersta skal. Kol delar vanligtvis elektroner för att uppnå ett komplett valensskal och bildar bindningar med flera andra atomer.
Så speglar kolumnerna i det periodiska systemet antalet elektroner som finns i varje grundämnes valensskal, vilket i sin tur avgör hur grundämnet kommer att reagera.
Att prova
Bidraga!
Förbättra den här sidanLär dig mer
