Lärandemål
- Skriv den kemiska formeln för en enkel jonisk förening.
- Känn igen polyatomära joner i kemiska formler.
Vi har redan stött på några kemiska formler för enkla joniska föreningar. En kemisk formel är en kortfattad förteckning över grundämnena i en förening och förhållandena mellan dessa grundämnen. För att bättre förstå vad en kemisk formel betyder måste vi se på hur en jonisk förening är uppbyggd av sina joner.
Ioniska föreningar existerar som omväxlande positiva och negativa joner i regelbundna, tredimensionella arrayer som kallas kristaller (figur \(\PageIndex{1}\)). Som du kan se finns det inga enskilda NaCl-”partiklar” i matrisen; i stället finns det ett kontinuerligt nät av omväxlande natrium- och kloridjoner. Vi kan dock använda förhållandet mellan natriumjoner och kloridjoner, uttryckt i lägsta möjliga heltal, som ett sätt att beskriva föreningen. I fallet med natriumklorid är förhållandet mellan natriumjoner och kloridjoner, uttryckt i lägsta möjliga heltal, 1:1, så vi använder NaCl (en Na-symbol och en Cl-symbol) för att beskriva föreningen. NaCl är alltså den kemiska formeln för natriumklorid, vilket är ett kortfattat sätt att beskriva det relativa antalet olika joner i föreningen. Ett makroskopiskt prov består av myriader av NaCl-par; varje par kallas en formelenhet. Även om det är bekvämt att tro att NaCl-kristaller består av enskilda NaCl-enheter, visar figur \(\PageIndex{1}\) att ingen enskild jon är exklusivt associerad med någon annan enskild jon. Varje jon är omgiven av joner med motsatt laddning.
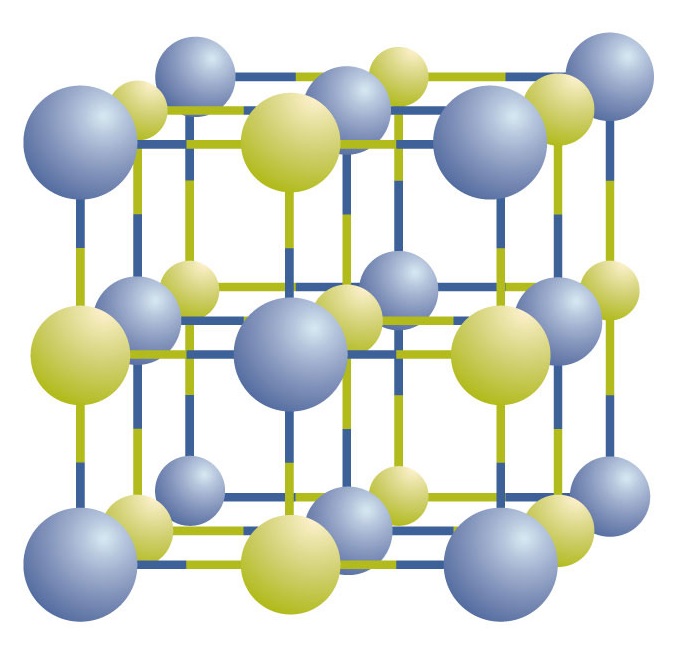
Figur \(\PageIndex{1}\) En natriumkloridkristall. En kristall innehåller en tredimensionell uppsättning av omväxlande positiva och negativa joner. Det exakta mönstret beror på föreningen. En kristall av natriumklorid, som visas här, är en samling alternerande natrium- och klorjoner.
Formeln för en jonisk förening följer flera konventioner. För det första skrivs katjonen före anjonen. Eftersom de flesta metaller bildar katjoner och de flesta icke-metaller bildar anjoner, anges i formlerna vanligen metallen först och sedan icke-metallen. För det andra skrivs inte laddningar i en formel. Kom ihåg att i en jonisk förening är de ingående arterna joner, inte neutrala atomer, även om formeln inte innehåller laddningar. Slutligen följer den korrekta formeln för en jonisk förening alltid följande regel: den totala positiva laddningen måste vara lika stor som den totala negativa laddningen. För att bestämma den korrekta formeln för en kombination av joner, bestäm hur många av varje jon som behövs för att balansera de totala positiva och negativa laddningarna i föreningen.
Denna regel är i slutändan baserad på det faktum att materia överlag är elektriskt neutral.
Som konvention antas det att det bara finns en atom om det inte finns ett subscript. Vi använder inte 1 som subscript.
Om vi tittar på den joniska förening som består av litiumjoner och bromidjoner ser vi att litiumjonen har en 1+ laddning och bromidjonen har en 1- laddning. Det behövs bara en jon av vardera för att balansera dessa laddningar. Formeln för litiumbromid är LiBr.
När en jonisk förening bildas av magnesium och syre har magnesiumjonen en 2+ laddning och syreatomen en 2- laddning. Även om båda dessa joner har högre laddningar än jonerna i litiumbromid, balanserar de ändå varandra i ett ett ett-till-ett-förhållande. Därför är den korrekta formeln för denna joniska förening MgO.
Tänk nu på den joniska förening som bildas av magnesium och klor. En magnesiumjon har en 2+ laddning, medan en klorjon har en 1- laddning:
Mg2+ Cl-
Att kombinera en jon av varje jon balanserar inte helt de positiva och negativa laddningarna. Det enklaste sättet att balansera dessa laddningar är att anta att det finns två kloridjoner för varje magnesiumjon:
Mg2+ Cl- Cl-
Nu är de positiva och negativa laddningarna balanserade. Vi skulle kunna skriva den kemiska formeln för denna joniska förening som MgClCl, men konventionen är att använda en numerisk subscript när det finns mer än en jon av en viss typ-MgCl2. Denna kemiska formel säger att det finns en magnesiumjon och två kloridjoner i denna formel. (Läs inte ”Cl2”-delen av formeln som en molekyl av det tvåatomiga grundämnet klor. Klor existerar inte som ett diatomärt grundämne i denna förening. Det existerar snarare som två enskilda kloridjoner). Enligt konvention används det lägsta hela talförhållandet i formlerna för joniska föreningar. Formeln Mg2Cl4 har balanserade laddningar med jonerna i förhållandet 1:2, men det är inte det lägsta heltalsförhållandet.
Enligt konvention används det lägsta heltalsförhållandet mellan jonerna i jonformler. Det finns undantag för vissa joner, till exempel Hg22+
Exempel \(\PageIndex{1}\)
Skriv den kemiska formeln för en jonisk förening som består av varje jonpar.
- natriumjonen och svaveljonen
- aluminiumjonen och fluoridjonen
- 3+ järnjonen och syrejonen
Lösning
- För att erhålla en valensskaloktett bildar natrium en jon med laddning 1+, medan svaveljonen har laddning 2-. Två natrium 1+-joner behövs för att balansera svaveljonens 2- laddning. I stället för att skriva formeln som NaNaS förkortar vi den enligt konvention till Na2S.
- Aluminiumjonen har en 3+-laddning, medan fluoridjonen som bildas av fluor har en 1- laddning. Det behövs tre fluor 1-joner för att balansera aluminiumjonens 3+-laddning. Denna kombination skrivs som AlF3.
- Iron kan bilda två möjliga joner, men jonen med 3+ laddning anges här. Syreatomen har en 2- laddning som jon. För att balansera de positiva och negativa laddningarna tittar vi på den minst gemensamma multipeln-6: två järn-3+-joner ger 6+, medan tre 2-syrejoner ger 6-, vilket balanserar de totala positiva och negativa laddningarna. Formeln för denna joniska förening är alltså Fe2O3.
Övningsuppgift \(\PageIndex{1}\)
Skriv den kemiska formeln för en jonisk förening som består av varje jonpar.
- kalciumjonen och syrejonen
- 2+ kopparjonen och svaveljonen
- 1+ kopparjonen och svaveljonen
Polyatomära joner
Vissa joner består av grupper av atomer som är bundna till varandra och som har en övergripande elektrisk laddning. Eftersom dessa joner innehåller mer än en atom kallas de för polyatomära joner. Polyatomära joner har karakteristiska formler, namn och laddningar som man bör memorera. NO3- är till exempel nitratjonen; den har en kväveatom och tre syreatomer och en total laddning på 1-. Tabell \(\PageIndex{1}\) listar de vanligaste polyatomära jonerna.
| Namn | Formel |
|---|---|
| ammoniumjon | NH4+ |
| acetatjon | C2H3O2- |
| karbonatjon | CO32- |
| vätekarbonatjon (bikarbonatjon) | HCO3- |
| cyanidjon | CN- |
| hydroxidjon | OH- |
| fosfatjon | PO43- |
| vätefosfatjon | HPO42- |
| divätefosfatjon | H2PO4- |
| nitratjon | NO3- |
| sulfitjon | SO32- |
Regeln för att konstruera formler för jonföreningar som innehåller polyatomära joner är densamma som för formler som innehåller monatomära (enatomära) joner.atom) joner: De positiva och negativa laddningarna måste balansera. Om fler än en av en viss polyatomär jon behövs för att balansera laddningen måste hela formeln för den polyatomära jonen omslutas av parenteser, och det numeriska subscriptet placeras utanför parenteserna. Detta är för att visa att subscriptet gäller för hela den polyatomära jonen. Ett exempel är Ba(NO3)2.
Exempel \(\PageIndex{2}\)
Skriv den kemiska formeln för en jonisk förening som består av varje jonpar.
- kaliumjonen och sulfatjonen
- kalciumjonen och nitratjonen
Lösning
- Kaliumjoner har laddningen 1+, medan sulfatjoner har laddningen 2-. Vi behöver två kaliumjoner för att balansera laddningen på sulfatjonen, så den korrekta kemiska formeln är K2SO4.
- Kalciumjoner har en laddning på 2+, medan nitratjoner har en laddning på 1-. Vi behöver två nitratjoner för att balansera laddningen på varje kalciumjon. Formeln för nitrat måste anges inom parentes. Vi skriver alltså Ca(NO3)2 som formel för denna jonförening.
Övningsuppgift \(\PageIndex{2}\)
Skriv den kemiska formeln för en jonförening som består av varje par joner.
- Magnesiumjonen och karbonatjonen
- Aluminiumjonen och acetatjonen
Att känna igen joniska föreningar
Det finns två sätt att känna igen joniska föreningar. För det första är föreningar mellan metalliska och icke-metalliska grundämnen vanligtvis joniska. CaBr2 innehåller till exempel ett metalliskt grundämne (kalcium, en metall i grupp 2A) och ett icke-metalliskt grundämne (brom, en icke-metallisk metall i grupp 7A). Därför är det sannolikt en jonisk förening. (Den är faktiskt jonisk.) Däremot innehåller föreningen NO2 två element som båda är ickemetaller (kväve, från grupp 5A, och syre, från grupp 6A). Det är inte en jonisk förening; den tillhör kategorin kovalenta föreningar som diskuteras på annat håll. Observera också att denna kombination av kväve och syre inte har någon specificerad elektrisk laddning, så det är inte nitritjonen.
För det andra, om du känner igen formeln för en polyatomär jon i en förening är föreningen jonisk. Om du till exempel ser formeln Ba(NO3)2 kan du känna igen ”NO3”-delen som nitratjonen, \(\rm{NO_3^-}\). (Kom ihåg att konventionen för att skriva formler för joniska föreningar är att inte inkludera den joniska laddningen). Detta är en ledtråd om att den andra delen av formeln, Ba, i själva verket är Ba2+ -jonen, där 2+ -laddningen balanserar den totala 2- laddningen från de två nitratjonerna. Denna förening är alltså också jonisk.
Exempel \(\PageIndex{3}\)
Identifiera varje förening som jonisk eller inte jonisk.
- Na2O
- PCl3
- NH4Cl
- OF2
Lösning
- Natrium är en metall och syre är en ickemetall; därför förväntas Na2O vara jonisk.
- Både fosfor och klor är ickemetaller. Därför är PCl3 inte joniskt.
- NH4 i formeln representerar ammoniumjonen, NH4+, vilket tyder på att denna förening är jonisk.
- Både syre och fluor är icke-metaller. OF2 är därför inte jonisk.
Övningsuppgift \(\PageIndex{3}\)
Identifiera varje förening som jonisk eller icke jonisk.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Närmare granskning: Blod och havsvatten
Vetenskapen har länge insett att blod och havsvatten har liknande sammansättning. Båda vätskorna har trots allt joniska föreningar som är lösta i dem. Likheten kan vara mer än en ren tillfällighet; många forskare tror att de första formerna av liv på jorden uppstod i haven. En närmare titt visar dock att blod och havsvatten är helt olika. En 0,9-procentig lösning av natriumklorid motsvarar ungefär den saltkoncentration som finns i blodet. Havsvatten däremot består huvudsakligen av en 3-procentig natriumkloridlösning, vilket är mer än tre gånger så mycket som koncentrationen i blodet. Här är en jämförelse av mängden joner i blod och havsvatten:
| Ion | Procent i havsvatten | Procent i blod |
|---|---|---|
| Na+ | 2.36 | 0,322 |
| Cl- | 1,94 | 0,366 |
| Mg2+ | 0,13 | 0,002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0,01 |
De flesta joner är rikligare i havsvatten än i blod, med några viktiga undantag. Det finns betydligt fler vätekarbonatjoner (HCO3-) i blodet än i havsvatten. Denna skillnad är viktig eftersom vätekarbonatjonen och vissa besläktade joner har en avgörande roll när det gäller att kontrollera syra-basegenskaperna i blodet. Mängden vätefosfatjoner – HPO42- och H2PO4 – i havsvatten är mycket liten, men de förekommer i större mängder i blodet, där de också påverkar syra-basegenskaperna. En annan anmärkningsvärd skillnad är att blodet inte har betydande mängder av sulfatjonen (SO42-), men denna jon finns i havsvatten.
Nyckelresultat
- Riktiga kemiska formler för joniska föreningar balanserar den totala positiva laddningen med den totala negativa laddningen.
- Grupper av atomer med en total laddning, så kallade polyatomära joner, finns också.
Bidragsgivare och tillskrivningar
-
Anonym
.
