 |
|
Reacções ácido-base são omnipresentes. Em soluções aquosas os ácidos aumentam a concentração do íon hidrogênio (H+). Por outro lado, as bases aumentam a concentração do ião hidróxido (OH-). Quando um ácido e uma base reagem em uma solução aquosa, os íons H+ e OH- se combinam para formar água. Estes íons assim “neutralizam-se” uns aos outros:
Mais ácidos têm a fórmula geral HA, onde A- é um ânion e a maioria das bases tem a forma BOH, onde B+ é um catião apropriado. Ácidos e bases podem ser agrupados em dois tipos gerais: ácidos e bases fortes e fracos. A diferença entre os dois é simples: um ácido forte numa solução aquosa decompõe-se 100% em próton (H+) e ânion (A-)
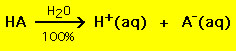
Por outro lado, a maioria dos ácidos fracos decompõe-se significativamente menos do que 100% numa solução aquosa:
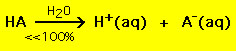 .
.Por outras palavras, a maioria das moléculas de ácidos fracos mantêm-se intactas na água. Equações químicas semelhantes mantêm-se para bases fortes e fracas.
Existem apenas alguns ácidos e bases fracas, eles são:
| |
|
|
HCl (ácido clorídrico) HNO3 (ácido nítrico) HClO4 (ácido perclórico) H2SO4 (ácido sulfúrico) |
NaOH (hidróxido de sódio) KOH (hidróxido de potássio) Ca(OH)2 (hidróxido de cálcio) |
Todos os outros ácidos e bases são fracos. Um ácido fraco resulta de qualquer ânion. Exemplos são dados abaixo
| |
|
|
F- (flúor) Br- (brometo) I- (iodeto) HCO3- (bicarbonato) C2H3O2- (acetato) MnO4- (permanganato) PO4-3 (fosfato) CrO4-2 (cromato) CN- (cianeto) NO2- (nitrito) SO3-2 (sulfito) |
HF (ácido fluorídrico) HBr (ácido hidrobrómico) HI (ácido hidroídrico) H2CO3 (ácido carbónico) HC2H3H3O2 (ácido acético) HMnO4 (ácido permangânico) H3PO4 (fosfórico ácido) H2CrO4 (ácido crómico) HCN (ácido cianídrico) HNO2 (ácido nitroso) H2SO3 (ácido sulfuroso) |
Numa reacção típica ácido/base o ácido e a base reagem para formar um sal e água e.g., ácido cianídrico e hidróxido de sódio:
