15.4 Propriedades Físicas dos Ácidos Carboxílicos
Objectivos de Aprendizagem
- Comparar os pontos de ebulição dos ácidos carboxílicos com álcoois de massa molar semelhante.
- Comparar as solubilidades dos ácidos carboxílicos na água com as solubilidades dos alcanos e álcoois comparáveis na água.
Muitos ácidos carboxílicos são líquidos incolores com odores desagradáveis. Os ácidos carboxílicos com 5 a 10 átomos de carbono têm todos odores “de cabra” (explicando o odor do queijo Limburger). Estes ácidos também são produzidos pela acção das bactérias da pele sobre o sebo humano (óleos de pele), o que explica o odor dos vestiários mal ventilados. Os ácidos com mais de 10 átomos de carbono são sólidos semelhantes a ceras, e o seu odor diminui com o aumento da massa molar e consequente diminuição da volatilidade.
Ácidos carboxílicos apresentam uma forte ligação de hidrogénio entre as moléculas. Eles têm, portanto, pontos de ebulição elevados em comparação com outras substâncias de massa molar comparável.
O grupo carboxílico se envolve prontamente na ligação de hidrogênio com moléculas de água (Figura 15.3 “Ligação de hidrogênio entre uma molécula de ácido acético e moléculas de água”). Os ácidos com um a quatro átomos de carbono são completamente miscível com água. A solubilidade diminui à medida que o comprimento da cadeia de carbono aumenta porque as forças dipolo se tornam menos importantes e as forças de dispersão se tornam mais predominantes. O ácido hexanóico mal é solúvel em água (cerca de 1,0 g/100 g de água). O ácido palmítico , com seu grande componente de hidrocarbonetos não-polares, é essencialmente insolúvel em água. Os ácidos carboxílicos geralmente são solúveis em solventes orgânicos como etanol, tolueno, e éter dietílico.
Figure 15.3 Ligação de hidrogênio entre uma molécula de ácido acético e moléculas de água
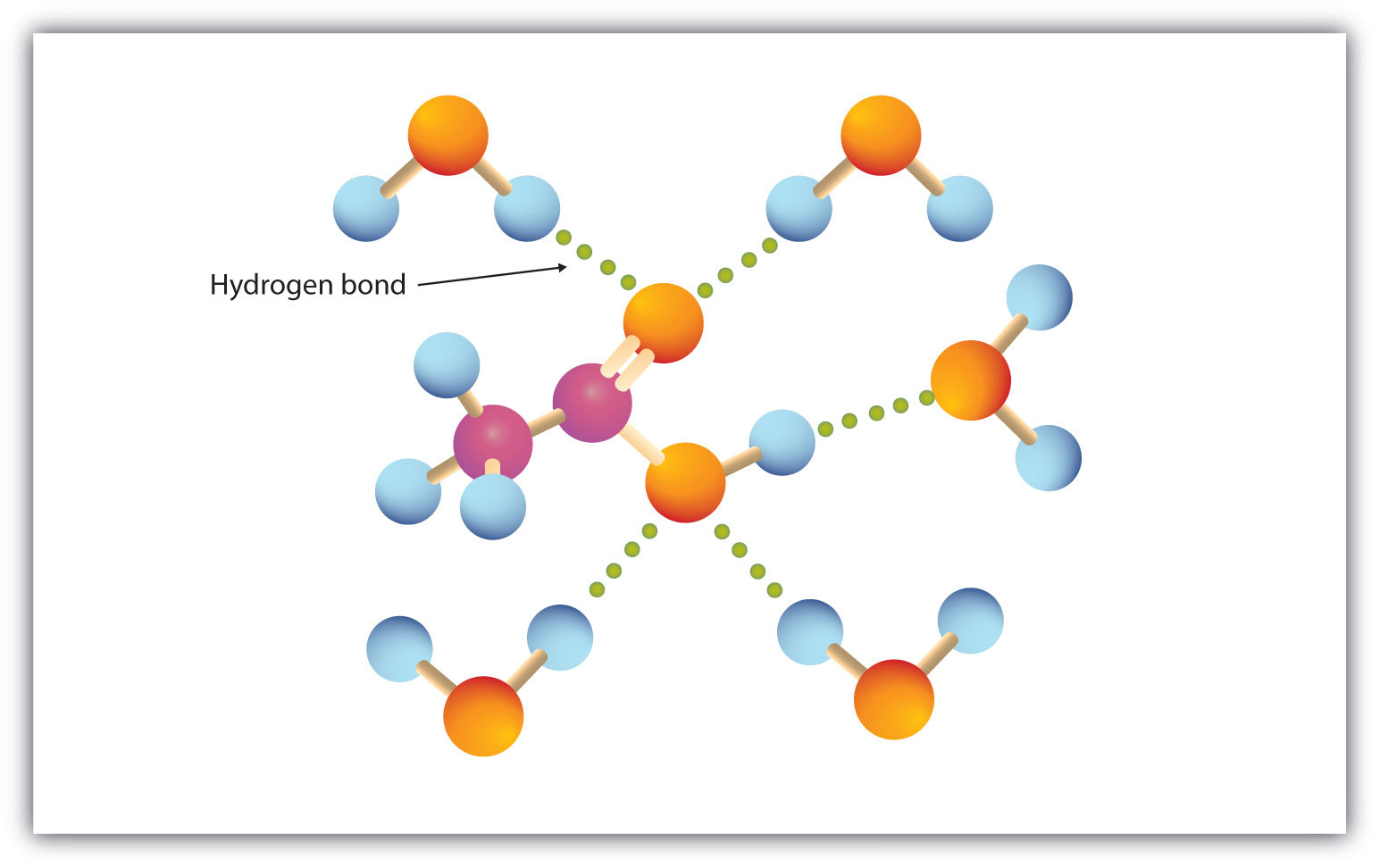
Ácidos carboxílicos de baixa massa molar são bastante solúveis em água.
Quadro 15.2 “Constantes Físicas de Ácidos Carboxílicos” lista algumas propriedades físicas para ácidos carboxílicos selecionados. Os primeiros seis são homólogos. Note que os pontos de ebulição aumentam com o aumento da massa molar, mas os pontos de fusão não mostram padrão regular.
Tabela 15.2 Constantes Físicas de Ácidos Carboxílicos
| Fórmula Estrutural Condensada | Nome do Ácido | Ponto de fusão (°C) | Solubilidade (g/100 g de Água) | ||
|---|---|---|---|---|---|
| HCOOH | ácido fórmico | 8 | 100 | miscível | |
| CH3COOH | ácido acético | 17 | 118 | miscível | |
| CH3CH2COOH | ácido propiónico | -22 | 141 | miscível | |
| CH3(CH2)2COOH | ácido butírico | -5 | 163 | miscível | |
| CH3(CH2)3COOH | ácido valérico | -35 | 187 | 5 | |
| CH3(CH2)4COOH | ácido caproico | -3 | 205 | 1.1 | |
| C6H5COOH | ácido benzóico | 122 | 249 | 0.29 |
Exercícios de Revisão de Conceito
-
Que composto tem o maior ponto de ebulição – ácido butanóico (massa molar 88) ou 2-pentanona (massa molar 86)? Explique.
-
Pode esperar que o ácido butanóico (ácido butanóico) seja mais ou menos solúvel que o 1-butanol na água? Explique.
Respostas
-
Ácido butírico por causa da ligação de hidrogénio (Não há ligação de hidrogénio intermolecular em 2-pentanona.)
-
mais solúvel porque existe uma ligação mais extensa de hidrogénio
Key Takeaways
- Ácidos carboxílicos têm pontos de ebulição elevados em comparação com outras substâncias de massa molar comparável. Os pontos de ebulição aumentam com a massa molar.
- Ácidos carboxílicos com um a quatro átomos de carbono são completamente miscível com água. A solubilidade diminui com a massa molar.
Exercícios
-
Que composto tem o ponto de ebulição mais alto -CH3CH2CH2OCH2CH3 ou CH3CH2CH2COOH? Explique.
-
Qual o composto que tem o ponto de ebulição mais alto -CH3CH2CH2CH2CH2CH2OH ou CH3CH2CH2CH2COOH? Explique.
-
Que composto é mais solúvel em água-CH3COOH ou CH3CH2CH2CH2CH3? Explique.
-
Que composto é mais solúvel em água-CH3CH2COOH ou CH3CH2CH2CH2CH2CH2COOH? Explique.
Respostas
-
CH3CH2CH2CH2COOH por causa da ligação de hidrogénio (Não há ligação de hidrogénio intermolecular com CH3CH2CH2OCH2CH3.)
-
CH3COOH porque se liga ao hidrogénio com água (Não há ligação intermolecular de hidrogénio com CH3CH2CH2CH3.)
