- o-Xileno Propriedades Químicas,Utilizações,Produção
- Xileno
- Destilação de precisão para separação de O-xileno e p-xileno
- Propriedades químicas
- Usos
- Método de produção
- Categoria
- Classe de toxicidade
- Toxicidade aguda
- EXPLOSIVOS e CARACTERÍSTICAS PERIGOSAS
- Flamabilidade e características perigosas
- Características de armazenamento e transporte
- Agente extintor de incêndio
- Padrão excupacional
- Propriedades químicas
- Propriedades físicas
- Uses
- Definição
- Síntese Referência(s)
- Descrição Geral
- Air &Reacções na água
- Perfil de reatividade
- Perigo para a saúde
- Perigo de Fogo
- Reactividade química
- Perfil de Segurança
- Fonte
- Environmental Fate
- Métodos de purificação
o-Xileno Propriedades Químicas,Utilizações,Produção
Xileno
Xileno refere-se ao hidrocarboneto aromático com os dois átomos de hidrogénio no anel do benzeno sendo substituídos por dois grupos metilo. Tem três isómeros o-xileno (1, 2-Dimetilbenzeno), m-xileno e p-xileno. Os produtos industriais são as misturas dos três isómeros com 10% o-10%, 70% m-, e 20% p-. Na indústria de coqueificação, é um dos produtos refinados de benzeno bruto.
Xileno é uma espécie de líquido inflamável incolor; o ponto de fusão do o-, m- e p-xileno é-25,2 ℃,-47,9 ℃ e 13,3 ℃; os pontos de ebulição são respectivamente 144.4 ℃, 139,1 ℃ e 138,3 ℃; a densidade relativa é de 0,8802, 0,8642 e 0,8611, respectivamente; não é solúvel em água, mas miscível com muitos tipos de solventes orgânicos imiscíveis. Na oxidação catalítica, respectivamente, geram anidrido ftálico, ácido isoftálico e ácido tereftálico.
Xileno é um tipo de matéria-prima importante de produtos químicos orgânicos, naturalmente existente no alcatrão de carvão e em alguns tipos de petróleo. Ele pode ser obtido através do fracionamento da parte de óleo leve do alcatrão de carvão ou da gasolina leve de reforma catalítica. A indústria realiza principalmente a extração utilizando a fração C8 nos reformados da nafta. Pode ser fabricado alternativamente através da reação desproporcional do tolueno na presença de catalisador e alta temperatura, alta pressão. Atualmente, a indústria aplica principalmente o método de cristalização criogênica, adsorção e formação de complexos ou peneiras moleculares para separá-los. O O-xileno tem um ponto de ebulição relativamente alto, podendo ser separado por destilação. O p-xileno também tem um alto ponto de fusão e pode ser purificado através da purificação por cristalização fracionada. O xileno misturado sem separação pode ser utilizado diretamente como solvente, sendo complementado com a gasolina capaz de melhorar as propriedades anti-explosivas. São componentes da gasolina de aviação. O xileno é utilizado principalmente para a preparação de anidrido ftálico, que é uma importante matéria-prima para a fabricação de uma variedade de corantes e indicadores (como o fenolftaleína). Além disso, o o-xileno também pode ser utilizado na preparação de resina de poliéster, repelente de insetos, plastificantes e corantes. O M-xileno, através de nitração e redução, pode gerar 4, 6-dimetil-1, 3-fenilenodiamina, que é o intermediário para corantes sintéticos. O M-xileno também pode ser usado como matéria-prima para fragrâncias sintéticas (como o almíscar de xileno). O P-xileno é usado principalmente na fabricação de ácido tereftálico, que é uma importante matéria-prima para a fibra sintética de poliéster (poliéster).
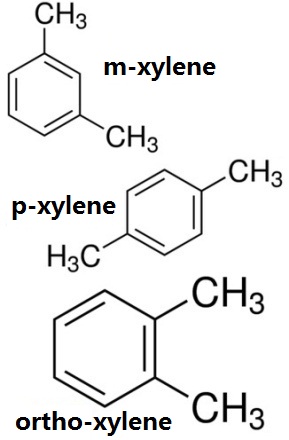
Figure 1 a estrutura química dos três isômeros de xileno, ortho-xylene, m-xylene, estrutura química do p-xileno.
A informação acima é editada pela Chemicalbook.
Destilação de precisão para separação de O-xileno e p-xileno
O xileno é apresentado em benzeno bruto de coque e óleo de petróleo craqueado. Benzeno bruto, após destilação inicial, lavagem com ácido sulfúrico e destilação para separação de benzeno e tolueno, seguido de destilação, podemos obter xileno, também conhecido como coque de xileno. A qualidade do xileno coqueado depende da capacidade de separação da coluna de destilação, da temperatura no topo da coluna e da relação de refluxo. A China classificou o xileno de coquefacção em três níveis. O xileno de coque geralmente contém 16% de o-xileno, 50% de m-xileno, 21% de p-xileno e 7% de etilbenzeno. O xileno produzido na indústria do petróleo tem um baixo teor de m-xileno e um alto teor de etilbenzeno. O xileno industrial não é apenas o solvente e aditivo da indústria da borracha e dos revestimentos, mas também os aditivos da aviação e do combustível de energia. O-xileno, m-xileno e p-xileno separado do xileno industrial são as matérias-primas do ácido ftálico, ácido isoftálico e ácido tereftálico, respectivamente. O ácido ftálico e o ácido tereftálico são utilizados na produção de plastificantes, resinas de poliéster e fibras de poliéster. O M-xileno pode ser usado sozinho como solvente e aditivo de combustível. O o-xileno contido no xileno industrial tem uma diferença superior a 5,2 ℃ com outros isómeros. Com a destilação de precisão, podemos obter o o-xileno com uma pureza superior a 95%, seguido de sulfonação e destilação para purificação para que possamos obter um o-xileno mais puro.
Xileno pertence à base de Lewis, que pode formar um complexo polar com HF-BF3 (ácido Lewis). A alcalinidade do M-xileno é cerca de 100 vezes mais forte do que a de outros aromáticos C8. Quando a mistura de isômeros de xileno entra em contato com o solvente HF-BF3, o m-xileno pode formar um complexo com flúor e é preferencialmente extraído para a fase de flúor. A fase de m-xileno contendo flúor é aquecida a uma pressão menor para decompor o complexo, separando assim o m-xileno da mistura. O solvente HF-BF3 pode ser recuperado por destilação para reciclagem. Se a matéria-prima for uma mistura de orto-xileno, m-xileno e p-xileno, após a extração do m-xileno, podemos ainda utilizar a destilação de precisão para separar o o-xileno e o p-xileno.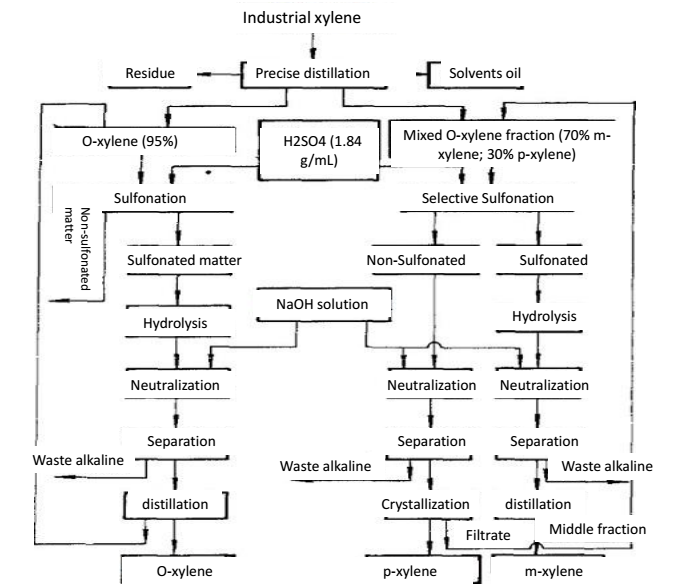
Figure 2 o método de destilação de precisão para separação do o-xileno e p-xileno.
Propriedades químicas
Aparece como um líquido transparente incolor com odor aromático. É miscível com etanol, éter etílico, acetona e benzeno, mas insolúvel em água.
Usos
(1) É usado principalmente na produção de anidrido ftálico
(2) O-xileno é a matéria-prima para a produção de fenramina germicida, peptídeo tetraclorofenil e o herbicida bensulfurão-metilo. É usado como intermediário para a fabricação de ácido o-metil benzóico.
(3) É usado principalmente como matéria-prima química e solventes. Pode ser usado para produzir anidrido ftálico, corantes, pesticidas e drogas, tais como vitaminas. Também pode ser usado como aditivo para gasolina de aviação.
(4) Usado como padrão cromatográfico e solventes
(5) Como matéria-prima de síntese de anidrido e outras sínteses orgânicas;
Método de produção
Método de superdestilação aplicado pela indústria para separar o o-xileno do xileno misturado. O-xileno tem uma diferença superior a 5 ℃ no ponto de ebulição em relação a outros componentes do xileno misturado. Para a destilação, o número de bandejas necessário é cerca de 150; a razão de refluxo é de 5-8 e consome relativamente muita energia.
O-xileno foi originalmente produzido principalmente a partir de alcatrão de carvão. Atualmente a maior parte da produção interna e externa de o-xileno é principalmente por extração a partir da reforma catalítica do petróleo e craqueamento térmico do hidrocarboneto aromático. Devido a isso as estruturas de o-xileno, p-xileno, e m-xileno no xileno são muito semelhantes; seus parâmetros físicos também são bastante semelhantes. A separação industrial do o-xileno adota principalmente o método de super-destilação; primeiro separa o o-xileno e etilbenzeno do xileno misturado que exige o uso de torre de destilação de 100~150 bandejas; seguido pela separação do o-xileno e etilbenzeno para obter o o-xileno puro.
Categoria
Líquidos inflamáveis
Classe de toxicidade
Envenenamento
Toxicidade aguda
Rato oral LDL0: 5000 mg/kg; Rato de injecção abdominal LD50: 1364 mg/kg
EXPLOSIVOS e CARACTERÍSTICAS PERIGOSAS
ser explosivo quando misturado com o ar
Flamabilidade e características perigosas
ser inflamável à chama, calor, oxidante Inflamável com combustão libertando fumo irritante
Características de armazenamento e transporte
Armazém: ventilado, a baixa temperatura e seco; carregar e descarregar suavemente; armazenar separadamente de oxidantes e ácidos.
Agente extintor de incêndio
Água de nebulização, espuma, areia, dióxido de carbono, 1211 agente extintor
Padrão excupacional
TLV-TWA 100 PPM (440 mg/m 3); STEL 150; PPM (655 mg/m 3)
Propriedades químicas
Líquido incolor
Propriedades físicas
Líquido incolor, incolor e com odor aromático. Uma concentração limite de odor de 380 ppbv foi relatada por Nagata e Takeuchi (1990).
Uses
Preparação de ácido ftálico, anidrido ftálico, ácido tereftálico, ácido isoftálico; solvente para resinas alquídicas, lacas, esmaltes, cimentos de borracha; fabricação de corantes, farmacêuticos, andinsecticidas; combustíveis motores.
Definição
ChEBI: Um xileno substituído por grupos metilo nas posições 1 e 3.
Síntese Referência(s)
Journal of the American Chemical Society, 97, p. 7262, 1975 DOI: 10.1021/ja00858a011
The Journal of Organic Chemistry, 44, p. 2185, 1979 DOI: 10.1021/jo01327a032
Descrição Geral
Um líquido incolor e aquoso com odor doce. Menos denso que a água. Insolúvel na água. Vapor irritante.
Air &Reacções na água
Altamente inflamável. Insolúvel em água.
Perfil de reatividade
1,2-Dimetilbenzeno pode reagir com materiais oxidantes. .
Perigo para a saúde
Vapores causam dores de cabeça e tonturas. O líquido irrita os olhos e a pele. Se tomado nos pulmões, causa tosse grave, angústia e edema pulmonar em rápido desenvolvimento. Se ingerido, causa náuseas, vômitos, cãibras, dor de cabeça e coma. Pode ser fatal. Podem ocorrer danos renais e hepáticos.
Perigo de Fogo
Comportamento no Fogo: O vapor é mais pesado que o ar e pode percorrer uma distância considerável até uma fonte de ignição e voltar a piscar.
Reactividade química
Reactividade com água Sem reacção; Reactividade com materiais comuns: Sem reacção; Estabilidade durante o transporte: Estável; Agentes Neutralizantes para Ácidos e Cáusticos: Não pertinente; Polimerização: Não pertinente; Inibidor da Polimerização: Não pertinente.
Perfil de Segurança
Via bj7intraperitoneal moderadamente tóxica. Byingestion e inalação de toxicidade média. Umteratogénio experimental. Um contaminante comum do ar. Um perigo de incêndio muito perigoso quando exposto a calor ou chamas. Explosivo na forma de vapor quando exposto ao calor ou à chama. Incompatível com materiais oxidantes, quando aquecido para decomposição emite fumos ácidos e fumos irritantes. Comité de materiais de construção modernos (CENEAR69,22,91). Ver também outras entradas de xileno.
Fonte
Detectado em frações destiladas solúveis em água de 87 octanas de gasolina (3,83 mg/L), 94 octanegasolina (11,4 mg/L), Gasool (8,49 mg/L), óleo combustível No. 2 (1,73 mg/L), jet fuel A (0.87 mg/L), gasóleo (1,75 mg/L), JP-4 (1,99 mg/L) (Potter, 1996), óleo de motor novo (16,2 a 17,5 μg/L), e óleo de motor usado (294 a 308 μg/L) (Chen et al, 1994). O percentual médio de volume e a fração molar estimada na gasolina PS-6 do American Petroleum Institute são 2,088 e 0,01959, respectivamente (Poulsen et al., 1992). Schauer et al. (1999) reportaram o o-xileno em um escapamento de caminhão movido a diesel a uma taxa de emissão de 830 μg/km. O diesel obtido de uma estação de serviço em Schlieren, Suíça, continha o-xileno a uma concentração de 223 mg/L (Schluep etal., 2001).
California Phase II reformulada a gasolina continha o-xileno a uma concentração de 19,7 g/kg.As taxas de emissão de gases de escape de automóveis movidos a gasolina com e sem catalisadores foram de 5,41 e 562 mg/km, respectivamente (Schauer et al, 2002).
Thomas e Delfino (1991) equilibraram as águas subterrâneas livres de contaminantes coletadas de Gainesville, FL com frações individuais de três produtos petrolíferos individuais a 24-25 °C durante 24 h. A fase aquosa foi analisada para compostos orgânicos através do método de teste aprovado pela EPA dos EUA602. As concentrações médias de m+p-xileno relatadas em frações solúveis em água de gasolina sem chumbo, querosene e diesel foram de 8,611, 0,658 e 0,228 mg/L, respectivamente. Quando os autores analisaram a fase aquosa através do método de ensaio 610 aprovado pela EPA, a média de m+p-xilenoconcentrações nas frações solúveis em água de gasolina sem chumbo, querosene e diesel, ou seja, 6.068, 0.360 e 0.222 mg/L, respectivamente. Com base na análise laboratorial de sete amostras de alcatrão de carvão, as concentrações de o-xileno variaram de 2 a 2.000 ppm (EPRI, 1990). Um alcatrão de carvão de alta temperatura continha o-xileno a uma concentração média de 0,04 wt % (McNeil, 1983).
Schauer et al. (2001) mediram as taxas de emissão de compostos orgânicos voláteis para compostos orgânicos voláteis, compostos orgânicos semivoláteis fase-gás e compostos orgânicos fase-particulares da combustão residencial (lareira) de pinheiro, carvalho e eucalipto. A taxa de emissão fase-gás de o-xileno foi de 18,1 mg/kg de pinho queimado. As taxas de emissão de o-xileno não foram medidas durante a combustão de carvalho e eucalipto.
Padrão de água potável (final): Para todos os xilenos, o MCLG e o MCL são ambos 10 mg/L. Além disso, foi recomendado um DWEL de 70 mg/L (U.S. EPA, 2000).
Environmental Fate
Biological. Produtos de biodegradação relatados do produto comercial contendo xilenoinclui α- ácido hidroxi-p-tolúico, álcool p-metilbenzil, álcool benzílico, 4-metilcatecol, ácidos mandp-tolúicos (Fishbein, 1985). o-Xileno também foi cometabolizado, resultando na formação de ácido o-tolúico (Pitter e Chudoba, 1990). Em águas subterrâneas anóxicas perto de Bemidji, MI, o-xilenoanaerobicamente biodegradado ao ácido o-toluico intermediário (Cozzarelli et al., 1990). Em águas subterrâneas gasolinecontaminadas, o ácido metilbenzillsuccínico foi identificado como o primeiro intermediário de degradação anaeróbia dos xilenos (Reusser e Field, 2002).
Fotolítico. Cox et al. (1980) relataram uma constante de taxa de 1,33 x 10-11 cm3/molécula?sec para a reação de o-xileno gasoso com radicais OH baseado em um valor de 8 x 10-12 cm3/molécula?sec para a reação de etileno com radicais OH.
Água Superficial. A semi-vida de evaporação do o-xileno em água superficial (1 m de profundidade) a 25 °C é estimada em 5,18 h (Mackay e Leinonen, 1975).
Água subterrânea. Nielsen et al. (1996) estudaram a degradação do o-xileno em um aquífero de areia rasa, glaciofluvial e não confinada na Jutlândia, Dinamarca. Como parte do estudo in situ do microcosmo, um cilindro que foi aberto na parte inferior e peneirado na parte superior foi instalado através de um furo de casedouro aproximadamente 5 m abaixo do grau. Cinco litros de água foram arejados com ar atmosférico para garantir condições aeróbicas. As águas subterrâneas foram analisadas semanalmente durante aproximadamente 3 meses para determinar as concentrações de o-xileno com o tempo. A taxa de degradação de primeira ordem constante e meia-vida correspondente após uma fase de 7-d de atraso foi de 0,1/d e 6,93 d, respectivamente.
Fotolítica. Quando ar sintético contendo ácido nitroso gasoso e o-xileno foi exposto à luz solar artificial (λ = 300-450 nm) biacetílico, nitrato de peroxiácido e nitrato de metilo formaram asprodutos (Cox et al., 1980). Uma solução de n-hexano contendo o-xileno e espalhada como uma película fina (4mm) sobre água fria (10 °C) foi irradiada por uma lâmpada de média pressão de mercúrio. Em 3 h, 13,6% do o-xileno fotooxidado em o-metilbenzaldeído, álcool o-benzílico, ácido o-benzóico e omethylacetofenona (Moza e Feicht, 1989). Irradiação do o-xileno em ≈ 2537 ? a 35 °C e 6mmHg isomeriza a m-xileno (Calvert e Pitts, 1966). Glioxal, metilglioxal e biacety sempre foram produzidos a partir da fotooxidação do o-xileno por radicais OH no ar a 25 °C (Tuazon et al.,1986a).
Chemical/Physical. Sob condições atmosféricas, a reação gás-fásica do o-xileno com OHradicais e óxidos de nitrogênio resultou na formação de o-tolualdeído, o-metilbenzil nitrato, nitro-o-xilenos, 2,3 e 3,4-dimetilfenol (Atkinson, 1990). Kanno et al. (1982) estudaram a reação aquosa do o-xileno e outros hidrocarbonetos aromáticos (benzeno, tolueno, m- e p-xileno e naftaleno) com ácido hipocloroso na presença de íon amônio. Eles relataram que o anel aromático não foi clorado como esperado, mas foi clivado por cloramina formando cianogêncloro. A quantidade de cloreto de cianogênio formado aumentou a pHs mais baixos (Kanno et al., 1982). Na fase gasosa, o o-xileno reagiu com radicais nitratos no ar purificado formando os seguintes produtos:5-nitro-2-metiltolueno e 6-nitro-2-metiltolueno, o-metilbenzaldeído e um nitrato de arilo (Chiodini et al., 1993).
Métodos de purificação
o-Xileno (4,4Kg) é sulfonado por agitação durante 4 horas com 2,5L de conc H2SO4 a 95o. Após arrefecimento e separação do material não sulfonado, o produto é diluído com 3L de água e neutralizado com 40% de NaOH. No arrefecimento, o o-xilenossulfonato de sódio separa-se e é recristalizado a partir de metade do seu peso de água. O sal é dissolvido na quantidade mínima de água fria, depois misturado com a mesma quantidade de água fria, e com o mesmo volume de conc H2SO4 e aquecido a 110o. o-Xileno é regenerado e o vapor destila. O destilado é saturado com NaCl, a camada orgânica é separada, seca e redestilada.
