>
Nome genérico: cloridrato de lidocaína
Forma de dosagem: geléia tópica
Revisado medicamente por Drugs.com. Última atualização em 1º de outubro de 2020.
- Visão geral
- Efeitos secundários
- Dosagem
- Profissional
- Interacções
- Mais
Apenas Rx
DESCRIÇÃO
Lidocaína A geleia 2% HCI é estéril, produto aquoso que contém um agente anestésico local e que é administrado topicamente. (Veja INDICAÇÕES para usos específicos.)
Lidocaína HCI 2% Geléia contém lidocaína HCI que é quimicamente designada como acetamida, 2-(dietilamino)-N-(2,6-dimetilfenil)-,monoidrocloreto e tem a seguinte fórmula estrutural:
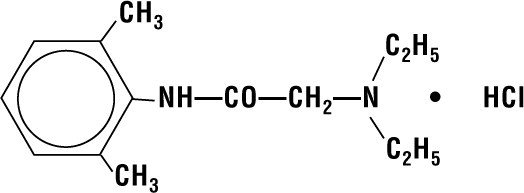
Fórmula molecular é C14H22N2O – HCI e seu peso molecular é 270.80.
Lidocaína HCI 2% Geléia também contém hipromelose, e a mistura resultante maximiza o contato com a mucosa e fornece lubrificação para instrumentação. A porção não utilizada deve ser descartada após o uso inicial.
Composição de Lidocaína HCI 2% Geléia 30 mL e 5 mL tubos: Cada mL contém 20 mg de Lidocaína HCI. A formulação também contém metilparabeno, propilparabeno, hipromelose e hidróxido de sódio e/ou ácido clorídrico para ajustar o pH entre 6,0 e 7,0,
FARMACOLOGIA CLÍNICA
Mecanismo de Ação: A lidocaína estabiliza a membrana neuronal inibindo os fluxos iônicos necessários para o início e condução dos impulsos, afetando assim a ação anestésica local.
Inset de ação: O início da acção é de 3 a 5 minutos. É ineficaz quando aplicado em pele intacta.
Hemodinâmica: Níveis excessivos de sangue podem causar alterações no débito cardíaco, resistência periférica total, e pressão arterial média. Estas alterações podem ser atribuíveis a um efeito depressor directo do agente anestésico local em vários componentes do sistema cardiovascular.
Farmacocinética e Metabolismo: A lidocaína pode ser absorvida após a administração tópica às mucosas, sua taxa e extensão de absorção dependendo da concentração e da dose total administrada, do local específico de aplicação e da duração da exposição. Em geral, a taxa de absorção dos agentes anestésicos locais após a aplicação tópica ocorre mais rapidamente após a administração intratraqueal. A lidocaína também é bem absorvida do trato gastrointestinal, mas pouca droga intacta pode aparecer na circulação devido à biotransformação no fígado.
Lidocaína é metabolizada rapidamente pelo fígado e os metabólitos e a droga inalterada é excretada pelos rins. A biotransformação inclui N-dealquilação oxidativa, hidroxilação do anel, clivagem da ligação amida, e conjugação. A N-dealquilação, uma das principais vias de biotransformação, produz os metabólitos monoetilglicinexilidida e glicinexilidida. As acções farmacológicas/toxicológicas destes metabolitos são semelhantes, mas menos potentes do que as da lidocaína. Aproximadamente 90% da lidocaína administrada é excretada sob a forma de vários metabolitos, e menos de 10% é excretada sem alterações. O metabolito primário na urina é um conjugado de 4-hidroxi-2, 6-dimetilanilina.
A ligação plasmática da lidocaína é dependente da concentração da droga, e a fração ligada diminui com o aumento da concentração. Em concentrações de 1 a 4 mcg de base livre por mL, 60 a 80 por cento da lidocaína é ligada à proteína. A ligação também depende da concentração plasmática da glicoproteína alfa-I-ácida.
Lidocaína atravessa as barreiras hemato-encefálicas e placentárias, presumivelmente por difusão passiva.
Estudos do metabolismo da lidocaína após injeções intravenosas em bolus mostraram que a meia-vida de eliminação deste agente é tipicamente de 1,5 a 2,0 horas. Devido à rapidez com que a lidocaína é metabolizada, qualquer condição que afete a função hepática pode alterar a cinética da lidocaína. A meia-vida pode ser prolongada duas ou mais vezes em pacientes com disfunção hepática. A disfunção renal não afeta a cinética da lidocaína mas pode aumentar o acúmulo de metabólitos.
Fatores como acidose e o uso de estimulantes e depressivos do SNC afetam os níveis de lidocaína necessários para produzir efeitos sistêmicos evidentes. Manifestações adversas objetivas tornam-se cada vez mais aparentes com o aumento dos níveis plasmáticos venosos acima de 6 mcg de base livre por mL. No macaco rhesus os níveis sanguíneos arteriais de 18 a 21 mcg/mL têm se mostrado limiar para atividade convulsiva.
INDICAÇÕES E UTILIZAÇÃO
Lidocaína HCI 2% Geléia é indicada para prevenção e controle da dor em procedimentos envolvendo a uretra masculina e feminina, para tratamento tópico da uretrite dolorosa e como lubrificante anestésico para intubação endotraqueal (oral e nasal).
CONTRAINDICAÇÕES
Lidocaína está contra-indicada em pacientes com história conhecida de hipersensibilidade aos anestésicos locais do tipo amida ou a outros componentes da Lidocaína HCI 2% Geléia.
AVISOS
DOSAGEMEXCESSIVA, OU INTERVALOS CURTOS ENTRE DOSES, PODEM RESULTAR EM ALTOS NÍVEIS DE PLASMA E EFEITOS SÉRIOS ADVERSOS. OS PACIENTES DEVEM SER INSTRUÍDOS A ADERIR RIGOROSAMENTE ÀS DIRETRIZES DE DOSAGEM E ADMINISTRAÇÃO RECOMENDADAS, CONFORME ESTABELECIDO NESTE FOLHETO INFORMATIVO. A GESTÃO DAS REACÇÕES SÉRIAS ADVERSAS PODEM SOLICITAR A UTILIZAÇÃO DE EQUIPAMENTOS RESUSCITATIVOS, OXIGÉNIO E OUTROS RESUSCITATIVOS.
Lidocaína HCI 2% Geleia deve ser usada com extremo cuidado na presença de sepse ou mucosa gravemente traumatizada na área de aplicação, uma vez que sob tais condições existe o potencial de rápida absorção sistêmica.
Quando usado para lubrificação endotraqueal do tubo deve ser tomado cuidado para evitar a introdução do produto no lúmen do tubo. Não utilizar a gelatina para lubrificar os tubos endotraqueais. Se permitido no lúmen interno, a geléia pode secar na superfície interna deixando um resíduo que tende a se aglomerar com a flexão, estreitando o lúmen. Tem havido relatos raros em que este resíduo causou a oclusão do lúmen. (Ver também REACÇÕES ADVERSAS e DOSAGEM E ADMINISTRAÇÃO.)
PRECAUÇÕES
Geral: A segurança e eficácia da lidocaína dependem da dosagem adequada, da técnica correta, das precauções adequadas e da prontidão para emergências. (Ver AVISOS e REACÇÕES ADVERSAS.) A dosagem mais baixa que resulta em anestesia eficaz deve ser usada para evitar altos níveis plasmáticos e efeitos adversos graves. As doses repetidas de lidocaína podem causar aumentos significativos nos níveis sanguíneos com cada dose repetida devido ao acúmulo lento da droga ou de seus metabólitos. A tolerância a níveis elevados de sangue varia com o estado do paciente. Pacientes debilitados, idosos, doentes agudos e crianças devem receber doses reduzidas, proporcionais à sua idade e estado físico. Lidocaína também deve ser usada com cautela em pacientes com choque grave ou bloqueio cardíaco.
Lidocaína HCI 2% Geleia deve ser usada com cautela em pacientes com sensibilidades conhecidas de drogas. Pacientes alérgicos aos derivados do ácido para-aminobenzóico (procaína, tetracaína, benzocaína, etc.) não demonstraram sensibilidade cruzada à lidocaína.
Muitas drogas usadas durante a condução da anestesia são consideradas potenciais agentes desencadeantes da hipertermia maligna familiar. Como não se sabe se em meio a anestésicos locais do tipo anestésico pode desencadear essa reação e como a necessidade de anestesia geral suplementar não pode ser prevista com antecedência, sugere-se a disponibilidade de um protocolo padrão para o manejo. Os primeiros sinais inexplicáveis de taquicardia, taquipneia, pressão arterial lábios e acidose metabólica podem preceder a elevação da temperatura. O sucesso do tratamento depende do diagnóstico precoce, da descontinuidade imediata do(s) agente(s) desencadeante(s) suspeito(s) e da instituição do tratamento, incluindo oxigenoterapia, medidas de suporte indicadas e dantrolene (consultar a bula intravenosa de dantrolene sódio antes de usar).
Informações para os pacientes: Quando são usados anestésicos tópicos na boca, o paciente deve estar ciente de que a produção de anestesia tópica pode prejudicar a deglutição e, assim, aumentar o perigo de aspiração. Por este motivo, os alimentos não devem ser ingeridos durante 60 minutos após o uso de preparações anestésicas locais na área da boca ou da garganta. Isto é particularmente importante em crianças devido à sua frequência de ingestão.
A tontura da língua ou da mucosa bucal pode aumentar o perigo de traumas de mordedura não intencionais. O alimento ou pastilha elástica não deve ser tomado enquanto a área da boca ou garganta estiver anestesiada.
Carcinogênese – Estudos a longo prazo em animais não foram realizados para avaliar o potencial carcinogênico da lidocaína.
Mutagênese – O potencial mutagênico da lidocaína tem sido testado no ensaio de mutação reversa Ames Salmonella, e no ensaio in vitro de aberrações cromossômicas em linfócitos humanos e em um ensaio in vivo de micronúcleo em camundongos. Não houve indicação de qualquer efeito mutagênico nestes estudos.
Impairment of Fertility – O efeito da lidocaína na fertilidade foi examinado no modelo de rato. A administração de 30 mg/kg, s.c. (180 mg/m2) ao par de ratos acasalados não produziu alterações na fertilidade ou no desempenho reprodutivo geral dos ratos. Não há estudos que examinem o efeito da lidocaína sobre os parâmetros espermáticos. Não houve evidências de alteração da fertilidade.
Uso na Gravidez:
Efeitos Teratogênicos: Categoria de Gravidez B.
Estudos de reprodução da lidocaína foram realizados tanto em ratos como em coelhos. Não houve evidência de danos ao feto em doses subcutâneas de até 50 mg/kg de lidocaína (300 mg/m2 na superfície corporal) no modelo de rato. No modelo de coelho, não houve evidência de dano ao feto na dose de 5 mg/kg, s.c. (60 mg/m2 em base de área de superfície corporal). O tratamento de coelhos com 25 mg/kg (300 mg/m2) produziu evidência de toxicidade materna e evidência de atraso no desenvolvimento fetal, incluindo uma diminuição não significativa do peso fetal (7%) e um aumento das anomalias esqueléticas menores (crânio e defeito esternebral, diminuição da ossificação das falanges). O efeito da lidocaína no desenvolvimento pós-natal foi examinado em ratos através do tratamento diário subcutâneo de ratos fêmeas grávidas em doses de 2, 10 e 50 mg/kg (12, 60 e 300 mg/m2) a partir do 15º dia de gravidez e até 20 dias pós-parto. Não foram observados sinais de efeitos adversos nem nas mães nem nos filhotes até a dose de 10 mg/kg (60 mg/m2), inclusive; entretanto, o número de filhotes sobreviventes foi reduzido em 50 mg/kg (300 mg/m2), tanto ao nascimento quanto ao período de lactação, sendo o efeito mais provável ser secundário à toxicidade materna. Nenhum outro efeito sobre o tamanho da ninhada, peso da ninhada, anormalidades nos filhotes e desenvolvimento físico dos filhotes foi observado neste estudo.
Um segundo estudo examinou os efeitos da lidocaína no desenvolvimento pós-natal no rato que incluiu a avaliação dos filhotes desde o desmame até a maturidade sexual. Ratos foram tratados durante 8 meses com 10 ou 30 mg/kg, s.c. de lidocaína (60 mg/m2 e 180 mg/m2 de superfície corporal, respectivamente). Este período de tempo abrangeu 3 períodos de acasalamento. Não houve evidências de alterações no desenvolvimento pós-natal de qualquer descendência; entretanto, ambas as doses de lidocaína reduziram significativamente o número médio de filhotes sobreviventes por ninhada até o desmame dos 2 primeiros períodos de acasalamento.
Não há, entretanto, estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução animal nem sempre são preditivos da resposta humana, esta droga deve ser usada durante a gravidez apenas se claramente necessária.
Laboral e parto: A lidocaína não está contra-indicada no parto e no parto. Caso a Lidocaína HCl 2% Geléia seja utilizada concomitantemente com outros produtos contendo lidocaína, a dose total contribuída por todas as formulações deve ser mantida em mente.
Mães amamentadoras: A lidocaína é secretada no leite humano. O significado clínico desta observação é desconhecido. Cuidado deve ser tomado quando a lidocaína é administrada a uma mulher lactante.
Uso pediátrico: Embora a segurança e eficácia da Lidocaína 2% Geléia em pacientes pediátricos não tenha sido estabelecida, um estudo com 19 neonatos prematuros (idade gestacional <33 semanas) não encontrou correlação entre a concentração plasmática de lidocaína ou monoetilglicinexilidida e o peso corporal infantil quando quantidades moderadas de lidocaína (ou seja, 0,3 mL/kg de gel de lidocaína 20 mg/mL) foram utilizadas para lubrificar tanto os tubos intranasais quanto endotraqueais. Nenhum neonato apresentava níveis plasmáticos de lidocaína acima de 750 mcg/L. As doses em crianças devem ser reduzidas, proporcionais à idade, peso corporal e condição física. (Ver DOSAGEM E ADMINISTRAÇÃO.)
Reações adversas
As experiências adversas após a administração de lidocaína são de natureza semelhante àquelas observadas em outros agentes anestésicos locais amídicos. Essas experiências adversas são, em geral, relacionadas à dosagem e podem resultar de altos níveis plasmáticos causados por dosagem excessiva ou absorção rápida, ou podem resultar de uma hipersensibilidade, idiossincrasia ou tolerância diminuída por parte do paciente. As experiências adversas graves são geralmente de natureza sistêmica. Os seguintes tipos são os mais comumente relatados:
Existiram relatos raros de oclusão do tubo endotraqueal associada à presença de resíduo de geléia seca na luz interna do tubo. (Ver também ADVERTÊNCIAS e DOSAGEM E ADMINISTRAÇÃO.)
Sistema Nervoso Central: As manifestações do SNC são excitatórias e/ou depressivas e podem ser caracterizadas por cabeça leve, nervosismo, apreensão, euforia, confusão, tontura, sonolência, zumbido, visão turva ou dupla, vómitos, sensação de calor, frio ou dormência, tremores, tremores, convulsões, inconsciência, depressão respiratória e paragem. As manifestações excitatórias podem ser muito breves ou podem não ocorrer, neste caso a primeira manifestação de toxicidade pode ser sonolência fundindo-se em inconsciência e parada respiratória.
A sonolência após a administração de lidocaína é geralmente um sinal precoce de um nível sanguíneo elevado da droga e pode ocorrer como consequência de absorção rápida.
Sistema Cardiovascular: As manifestações cardiovasculares são geralmente depressivas e caracterizam-se por bradicardia, hipotensão e colapso cardiovascular, o que pode levar à parada cardíaca.
Alérgico: Reações alérgicas são caracterizadas por lesões cutâneas, urticária, edema ou reações anafilactóides. Reações alérgicas podem ocorrer como resultado da sensibilidade ao agente anestésico local ou a outros componentes da formulação. As reacções alérgicas resultantes da sensibilidade à lidocaína são extremamente raras e, se ocorrerem, devem ser geridas por meios convencionais. A detecção da sensibilidade através de testes cutâneos é de valor duvidoso.
OVERDOSAGEM
As emergências agudas de anestésicos locais estão geralmente relacionadas com altos níveis plasmáticos encontrados durante o uso terapêutico de anestésicos locais. (Ver REACÇÕES ADVERSAS, AVISOS e PRECAUÇÕES.)
Gestão de emergências anestésicas locais: A primeira consideração é a prevenção, melhor realizada pela monitorização cuidadosa e constante dos sinais vitais cardiovasculares e respiratórios e do estado de consciência do paciente após cada administração anestésica local. Ao primeiro sinal de mudança, deve-se administrar oxigênio.
O primeiro passo no manejo das convulsões consiste na atenção imediata à manutenção de uma via aérea patente e ventilação assistida ou controlada com oxigênio e um sistema de fornecimento capaz de permitir pressão positiva imediata das vias aéreas por máscara. Imediatamente após a instituição destas medidas ventilatórias, deve ser avaliada a adequação da circulação, tendo em conta que os fármacos utilizados no tratamento das convulsões, por vezes, deprimem a circulação quando administrados por via intravenosa. Caso as convulsões persistam apesar do suporte respiratório adequado, e se o estado da circulação permitir, pequenos incrementos de um barbitúrico de acção ultra-curta (como o tiopental ou o tiamilal) ou uma benzodiazepina (como o diazepam) podem ser administrados por via intravenosa. O médico deve estar familiarizado, antes do uso de anestésicos locais, com estes medicamentos anticonvulsivos. O tratamento de suporte da depressão circulatória pode requerer a administração de líquidos intravenosos e, quando apropriado, um vasopressor, conforme orientado pela situação clínica (por exemplo, efedrina).
Se não forem tratados imediatamente, tanto as convulsões como a depressão cardiovascular podem resultar em hipoxia, acidose, bradicardia, arritmias e parada cardíaca. Se a parada cardíaca deve ocorrer, medidas padrão de ressuscitação cardiopulmonar devem ser instituídas.
A diálise é de valor insignificante no tratamento da superdosagem aguda com lidocaína.
O LD50 de lidocaína HCI oral em ratos fêmeas não jejuadas é de 459 (346 a 773) mg/kg (como o sal) e 214 (159 a 324) mg/kg (como o sal) em ratos fêmeas jejuadas.
DOSAGEM E ADMINISTRAÇÃO
Quando a Lidocaína HCI 2% Geléia é usada concomitantemente com outros produtos contendo lidocaína, a dose total contribuída por todas as formulações deve ser mantida em mente.
A dosagem varia e depende da área a ser anestesiada, da vascularização dos tecidos, da tolerância individual e da técnica anestésica. A dosagem mais baixa necessária para proporcionar anestesia eficaz deve ser administrada. As dosagens devem ser reduzidas para crianças e para pacientes idosos e debilitados. Embora a incidência de efeitos adversos com Lidocaína HCI 2% Geléia é bastante baixa, deve-se ter cautela, principalmente quando se emprega grandes quantidades, pois a incidência de efeitos adversos é diretamente proporcional à dose total do agente anestésico local administrado.
Para Anestesia Superficial da Uretra Masculina Adulta: Quando usar Lidocaína 2% Geléia 30 mL tubos, esterilizar o cone plástico por 5 minutos em água fervente, resfriar, e fixar ao tubo. O cone pode ser esterilizado a gás ou esterilizado a frio, como preferir. Instilar lentamente aproximadamente 15 mL (300 mg de lidocaína HCI) na uretra ou até que o paciente tenha uma sensação de tensão. Uma pinça peniana é então aplicada durante vários minutos na coroa. Uma dose adicional de não mais de 15 mL (300 mg) pode ser instilada para anestesia adequada.
Principal para sonorização ou cistoscopia, uma pinça peniana deve ser aplicada por 5 a 10 minutos para obter anestesia adequada. Uma dose total de 30 mL (600 mg) é geralmente necessária para preencher e dilatar a uretra masculina.
Prior para cateterização, volumes menores de 5 a 10 mL (100 a 200 mg) são geralmente adequados para lubrificação.
Para Anestesia Superficial da Uretra Adulta Feminina: Quando usar Lidocaína 2% Geléia 30 mL tubos, esterilizar o cone plástico por 5 minutos em água fervente, resfriar, e fixar ao tubo. O cone pode ser esterilizado a gás ou esterilizado a frio, como preferir. Instilar lentamente 3 a 5 mL (60 a 100 mg de lidocaína HCI) da geleia na uretra. Se desejar, alguma geleia pode ser depositada num cotonete e introduzida na uretra. Para obter anestesia adequada, devem ser permitidos vários minutos antes da realização de procedimentos urológicos.
Lubrificação para Intubação Endotraqueal: Aplique uma quantidade moderada de gelatina na superfície externa do tubo endotraqueal pouco antes da utilização. Deve-se tomar cuidado para evitar introduzir o produto no lúmen do tubo. Não utilizar a geleia para lubrificar as endotraqueal stylettes. Ver AVISOS e REACÇÕES ADVERTENTES sobre relatos raros de oclusão do lúmen interno. Também é recomendado que o uso de tubos endotraqueais com geléia seca na superfície externa seja evitado por falta de efeito lubrificante.
DOSAGEM MÁXIMA
Não mais que 600 mg de lidocaína HCI devem ser dados em qualquer período de 12 horas.
Crianças: É difícil recomendar uma dose máxima de qualquer droga para crianças, uma vez que isso varia em função da idade e do peso. Para crianças com menos de dez anos que têm uma massa corporal magra normal e um desenvolvimento corporal normal, a dose máxima pode ser determinada pela aplicação de uma das fórmulas de drogas pediátricas padrão (por exemplo, a regra de Clark). Por exemplo, numa criança de cinco anos com peso de 50 libras, a dose de cloridrato de lidocaína não deve exceder 75 a 100 mg quando calculada de acordo com a regra de Clark. Em qualquer caso, a quantidade máxima de Lidocaína HCI administrada não deve exceder 4,5 mg/kg (2 mg/lb) de peso corporal.
COMO FORNECIDO
Lidocaína HCI 2% Geleia é fornecida nas formas de dosagem listadas.
NDC 17478-840-30 Tubo de alumínio de 30 mL
NDC 17478-840-05 Tubo de alumínio de 5 mL
Cone aplicador destacável e uma chave para expressar o conteúdo estão incluídos na caixa de 30 mL.
Armazém: Armazenamento a 20° a 25°C (68° a 77°F) .
PREMIERProRx®
Fabricado por:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® é uma marca registrada da Premier Inc., utilizada sob licença.
PLD00N Rev. 10/15
PrémierProRx® é uma marca registrada da Premier Inc., usada sob licença.
PLD00N Rev. 10/15
PrémierProRx® é uma marca registrada da Premier Inc., usada sob licença.
PLD00N Rev. 10/15
PrémierProRx® é uma marca registrada da Premier Inc:
>
NDC 17478-840-05 Estéril 5 mL
Lidocaína Hidrocloreto de Cloridrato USP, 2%
>
Apenas Rx
Prémier Logotipo

| LIDOCAINE Geleia de hidrocloreto de lidocaína |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Etiquetadora – Akorn, Inc. (117696770)
Registrado – Akorn Operating Company LLC (117693100)
| Estabelecimento | |||
| Nome | Endereço | ID/FEI | Operações |
| Akorn, Inc | 117696840 | MANUFATURA(17478-840), ANÁLISE(17478-840), STERILIZE(17478-840), PACK(17478-840), LABEL(17478-840) | |
Mais sobre lidocaína tópica
- Efeitos colaterais
- Durante a gravidez ou amamentação
- Informações sobre a dosagem
- Interações de Drogas
- Comparar Alternativas
- Preço & Cupões
- En Español
- 208 Revisões
- Classe de Drogas: Anestésicos tópicos
- Alertas FDA (5)
>
>
Recursos do consumidor
- Informação do paciente
- Aplicação tópica da lidocaína (Leitura avançada)
>
>
Recursos profissionais
- Informação sobre a prescrição
- Lidocaína (Tópico) (Aconselhamento profissional ao paciente)
- Creme de lidocaína (FDA)
- Gel de lidocaína (FDA)
- Solução laringotraqueal de lidocaína (FDA)
- … +9 mais
Outras marcas Lidocaína Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 mais
Guias de tratamento relacionadas
- Pressão Anal
- Cirurgia Gastrointestinal
- Anestesia
- Queimaduras, Exteriores
- … +9 mais
Relatação Médica
