REVISÃO
Significado da anemia nas diferentes etapas da vida
Guzmán Llanos, María José*; Guzmán Zamudio, José L.** y LLanos de los Reyes-García, M.J.***
*Pediatric Nurse Hospital SAS de Jerez de la Frontera (Cádiz). E-mail: [email protected]
***Ph.D. Haematologist.
***Hospital de Dia da Enfermeira de Hematologia – Hospital de Oncologia del SAS de Jerez de la Frontera (Cádiz)
SUMÁRIO
Abstract: A anemia tem uma alta prevalência nos cuidados primários e consultas pediátricas, e a HDA é responsável por 50% de todos os casos de anemia.
Metodologia: Revisão bibliográfica e análise documental descritiva sobre a etiopatogenia da anemia ferropriva, os testes diagnósticos básicos para o estudo da TDAH e sua significância, utilizando um período de tempo específico na pesquisa documental e critérios de inclusão de acordo com as dimensões analisadas no estudo: Noções sobre o metabolismo do ferro. Noções sobre hematopoiese. Diagnóstico laboratorial e classificação das anemias. Clínica de anemia por deficiência de ferro. Causas da deficiência de ferro.
Resultados e conclusão: O estudo documental realizado mostra a existência de publicações com conteúdo sobre a etiopatogenia da anemia ferropriva, os testes diagnósticos básicos para o estudo da HDA e sua importância, demonstrando a importância deste conteúdo para o profissional de enfermagem na área de atenção primária e pediatria.
Palabras clave: anemia por deficiência de hierro; anemia na gestación, anemia no anciano.
ABSTRACT
Averiguação: A anemia é muito comum em consultas de atenção primária e pediatria, e o IDA é a causa de 50% de todos os casos de anemia.
Metodologia: Revisão bibliográfica e análise descritiva documental da patogênese da anemia por deficiência de ferro, os testes diagnósticos básicos para o estudo do IDA e o significado de tais testes utilizando um período de tempo específico na busca documental e critérios de inclusão que levam em conta fatores que são analisados no estudo: Idéias sobre o metabolismo do ferro. Idéias sobre a hematopoiese. Diagnóstico laboratorial e classificação da anemia. Características clínicas da anemia por deficiência de ferro. Causas da deficiência de ferro.
Resultados e conclusão: O estudo documental encenado abrange as publicações sobre a patogênese da anemia por deficiência de ferro, os testes diagnósticos básicos para o estudo do IDA e a significância destes, e mostra como estes dados são importantes para a enfermagem profissional na área da atenção primária e pediátrica, para identificá-la e agir em conformidade.
Palavras-chave: Anemia por deficiência de ferro; anemia na gravidez; anemia na terceira idade.
Introdução
La OMS define a anemia como o descenso do nível de hemoglobina dos desviaciones estándar por debajo de lo normal para la edad y el sexo(1). Em términos práticos podemos adotar as cifras de 13 gr/dl no homem, 12 gr/dl nas mulheres e 11 na mulher e na embaraçada. Nos niños de 6 meses a 6 años 11/gr/dl e de 6 años a 14 años, 12 gr/dl. Esses critérios são baseados em estudos populacionais que não incluem pessoas com mais de 65 anos e podem não ser aplicáveis a idosos.
Anaemia é altamente prevalente em consultas de atenção primária, pediatria e no monitoramento da gravidez. A deficiência de ferro (IDA) não é o mesmo que a anemia por deficiência de ferro (IDA). O IDA é a causa mais comum de anemia em todo o mundo e representa um grande problema de saúde, principalmente em países subdesenvolvidos. A TDAH é muito prevalente, de modo que até 5% das crianças e adolescentes, 10% das mulheres pré-menopausa e 1% dos homens têm anemia por deficiência de ferro; e pode atingir até 40% das pessoas idosas no atendimento domiciliar.
Os serviços de saúde têm orientações clínicas para o tratamento da anemia em geral e/ou da anemia gestacional (2,3)
A anemia gestacional é considerada um factor de risco para a gravidez e pode causar anemia no período recém-nascido, devido ao baixo teor de ferro armazenado. (4)
Anaemia na infância: a TDAH afeta o crescimento e desenvolvimento das crianças, diminui a resistência à infecção e prejudica o desenvolvimento cognitivo e psicomotor.(5,6)
De acordo com o relatório da OMS de 1993-2005, a prevalência de TDA em pré-escolares pode representar 47,4% e para a mesma agência a presença de mais de 40% representa um grave problema de saúde. (7).
Na ADH em mulheres na pós-menopausa, adultos e idosos, deve ser sempre excluída a possibilidade de fuga digestiva.
Metodologia
Revisão bibliográfica da literatura publicada sobre a etiopatogenia da anemia ferropriva e testes diagnósticos para o estudo da HDA e sua significância. Estudo descritivo documental a partir de diferentes fontes bibliográficas e bases de dados sobre o tema em estudo.
O horizonte temporal utilizado na pesquisa bibliográfica centrou-se nos anos 2000-2014, bem como alguma outra bibliografia de natureza referencial sobre o tema analisado, fora deste horizonte temporal.
Os critérios para inclusão na pesquisa bibliográfica são baseados nos artigos e documentação publicados sobre o assunto, dentro do prazo selecionado, sendo refinados de acordo com seu conteúdo e dimensões a serem analisadas (Noções sobre metabolismo do ferro. Noções sobre hematopoiese. Diagnóstico laboratorial e classificação das anemias. Clínica de anemia por deficiência de ferro. Causas da deficiência de ferro).
Foram utilizados como palavras-chave de pesquisa os seguintes descritores ou palavras-chave: anemia por deficiência de ferro na infância (4368 artigos), anemia por deficiência de ferro na gravidez (até 2173 artigos) e nos idosos (4605) e foi feita uma seleção a partir destes, de acordo com os critérios de inclusão da revisão realizada.
Resultados
1.-Informação sobre o metabolismo do ferro
Iron é importante porque faz parte da hemoglobina e dos citocromos. Após o crescimento estar completo, o ferro de engomar permanece fixo dentro de uma gama muito estreita. O ferro de engomar é ciclado e reciclado através de várias piscinas. (8,9)
– Absorção: O ferro que ingerimos com os alimentos tem que ser absorvido, depois transportado através do sangue e finalmente armazenado para formar o ferro de depósito (os depósitos de ferro). O ferro que ingerimos com os alimentos vem na forma de Fe +++, mas é absorvido no duodeno e jejuno superior na forma de Fe ++, portanto tem que passar por um processo de redução envolvendo ácido ascórbico. Apenas 10% do ferro da dieta é absorvido, o que representa 0,25% do ferro total do corpo. A absorção de ferro é ajustada às necessidades de ferro do corpo por vários factores.
A absorção de ferro é ajustada às necessidades de ferro do corpo. No caso da anemia por deficiência de ferro, a absorção de ferro é favorecida. O metabolismo do ferro é único, pois o equilíbrio do ferro é controlado principalmente pela absorção e não pela excreção.
Ferro dietético: o teor de ferro da dieta é de aproximadamente 10 a 30 mg/dia para um adulto. Com absorção de 5 a 10% de ferro dietético (0,5 a 1 mgr) a proporção aumenta para 20% em caso de deficiência de ferro e diminui em caso de sobrecarga de ferro.
– Transporte: O ferro no sangue está ligado à sua transferrina de proteínas de transporte). O complexo ferro-transferrina é absorvido pelas células por um receptor específico.
Transferrina é sintetizada no fígado e sua concentração no sangue excede a capacidade de ligação do ferro e aproximadamente dois terços da capacidade de ligação são insaturados.
Finalmente, o ferro deve ser armazenado na forma de ferritina e/ou hemossiderina; aproximadamente 1 micrograma/l de ferritina sérica corresponde a 10 mg de ferro armazenado.
Distribuição de ferro: a maior reserva de ferro está nas hemácias como ferro ligado à hemoglobina e é de aproximadamente 2500 mg. Mais 40 mg faz parte da mioglobina. Os órgãos do depósito armazenam de 800 a 1200 mg. Apenas 4 mg está na forma de ferro ligado à transferrina.
Requisitos de ferro e equilíbrio de ferro: Os requisitos de um adulto saudável e de uma mulher na pós-menopausa são aproximadamente 1 mg/dia.
Os requisitos sobem para 5 mg para mulheres em idade fértil, doadoras de sangue, etc.
No caso de mulheres grávidas a necessidade é de 7 mg/d.
A eliminação do ferro não é tão bem regulada; aproximadamente 1 mg de ferro por dia é eliminado através do intestino, urina e transpiração. Com a menstruação, perdem-se 15-30 mg de ferro, o que pode ser compensado por uma maior absorção, mas é mais difícil de compensar no caso da menorragia; outra causa pode ser a hemodontia frequente e, na infância, o excesso de testes analíticos.
2.-Nota sobre hematopoiese
A formação dos blocos de construção do sangue (leucócitos, glóbulos vermelhos e plaquetas) ocorre na medula óssea e o processo é chamado hematopoiese. Partindo de uma célula estaminal pluripotente e estimulada pela eritropoietina, esta célula estaminal após várias transformações levaria à formação do hemócito maduro, um processo conhecido como eritropoiese(10). A eritropoietina (EPO) é o principal factor de crescimento que regula a eritropoiese. É produzido no rim. Estimula a proliferação da série eritróide e a libertação do reticulócito da medula óssea. Aproximadamente 20-30% das células estaminais diferenciam-se em eritropoiese. O hemócito é uma célula anucleada, cuja função primária, graças à hemoglobina (Hb), é transportar oxigénio para os tecidos.
Síntese da hemoglobina ocorre na fase normoblástica, e quando a hemoglobina é totalmente hemoglobinada, o núcleo é libertado e dá origem ao reticulócito.
Para manter a hematopoiese normal, é necessário um suprimento adequado de ferro e uma concentração adequada de vitamina B-12 e ácido fólico.
Hb consiste de uma parte proteica (globina) e o grupo heme (que carrega o átomo de ferro ferroso).
Com a idade dos glóbulos vermelhos, eles são fagocitose por células do sistema fagocitário mononuclear. Isto ocorre em cerca de 120 dias e aproximadamente 0,8% do pool de eritrócitos é utilizado e é mantido um equilíbrio entre o que é formado e o que é destruído.
3.- Diagnóstico laboratorial e classificação das anemias
3,1. Primeiro temos que confirmar que o paciente tem anemia e depois que esta se deve a deficiência de ferro, e para isso pedimos:
– O hemograma é o teste mais básico, dá-nos muita informação já que nos fornece o número de glóbulos vermelhos, o valor da hemoglobina e os índices corpusculares VCM, HCM. Para além do número de leucócitos e plaquetas. E tudo isto é útil quando se classifica a anemia. A anemia por deficiência de ferro é freqüentemente acompanhada por trombocitose reativa.
– Parâmetros relacionados ao metabolismo do ferro: sideremia, transferrina, índice de saturação da transferrina e receptor de transferrina solúvel (RsTf)
– Avaliação dos depósitos: ferritina sérica.
– Revisão do esfregaço de sangue: revela o conteúdo de hemoglobina (hipocromia), alterações de forma (poiquilocitose) e tamanho (anisocitose) que nos guiam no diagnóstico correto.
Importância clínica das diferentes proteínas envolvidas no transporte e deposição de ferro.
Ferritina: Esta é a proteína de deposição de ferro mais importante. Concentrações elevadas são encontradas no fígado, baço e medula óssea. Contém 15-20% do ferro do corpo.
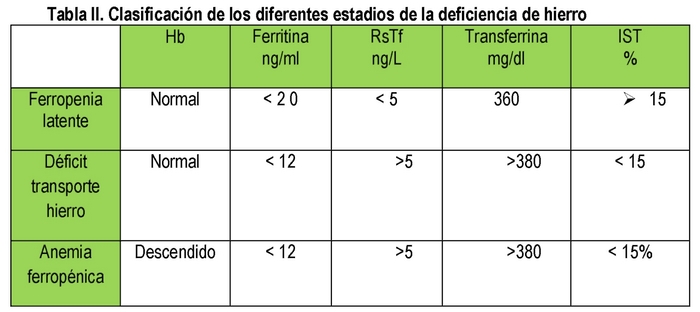
Uma pequena quantidade da ferritina produzida é secretada pelas células e passa para a corrente sanguínea. Existe uma correlação directa entre a quantidade desta proteína e o ferro armazenado de tal forma que: 1 mcg/L de ferritina sérica corresponde a 10 mgr de ferro armazenado. A ferritina de soro é um bom indicador de armazéns de ferro. (11) No entanto, também se deve ter em conta que a ferritina é um reagente de fase aguda, pelo que, por vezes, a proteína c-reactiva (PCR) também deve ser solicitada para excluir a presença de um processo infeccioso/inflamatório. A ferritina é, portanto, muito útil para a avaliação do metabolismo do ferro. Valores < de 12 ng/ml definem a deficiência de ferro latente. Uma ferritina elevada > de 400 ng/ml pode indicar a presença de sobrecarga de ferro.
Transferrina, saturação da transferrina: A transferrina é uma proteína sintetizada no fígado e 15 a 45% é saturada com ferro. Se o suprimento de ferro funcional for inadequado, a síntese desta proteína será aumentada; valores elevados são encontrados na deficiência de ferro e na gravidez.
Receptores de transferrina solúveis (RsTf): Aproximadamente 75% dos receptores de transferrina estão localizados nos precursores da eritropoiese. O número de receptores de transferrina aumenta quando o fornecimento de ferro funcional é deficiente. A forma solúvel é conhecida como (RsTf). Este é o único marcador biológico
que indica o fornecimento inadequado de ferro para a eritropoiese. É, portanto, de valor complementar à ferritina. O RsTf não é afetado por reagentes de fase aguda, de modo que indica deficiência de ferro na presença de infecção, inflamação e/ou tumores.(12)
3.2- Classificação das anemias
Uma maneira prática de classificar as anemias é pelo tamanho dos eritrócitos (VGM) e pelo conteúdo de hemoglobina (HBC). Estes dois parâmetros são fornecidos pela leitura de qualquer hemograma de contadores celulares modernos.
– De acordo com o tamanho falamos de anemias normocíticas, microcíticas e macrocíticas e de acordo com o conteúdo de Hb (HGM) falamos de anemias normocíticas, hipocítmicas e hipercítmicas13 (Tabela I)
– De acordo com o tamanho falamos de anemias normocíticas, microcíticas e macrocíticas. (Tabela I).

No caso das anemias por deficiência de ferro, geralmente são microcíticas e hipocrômicas.
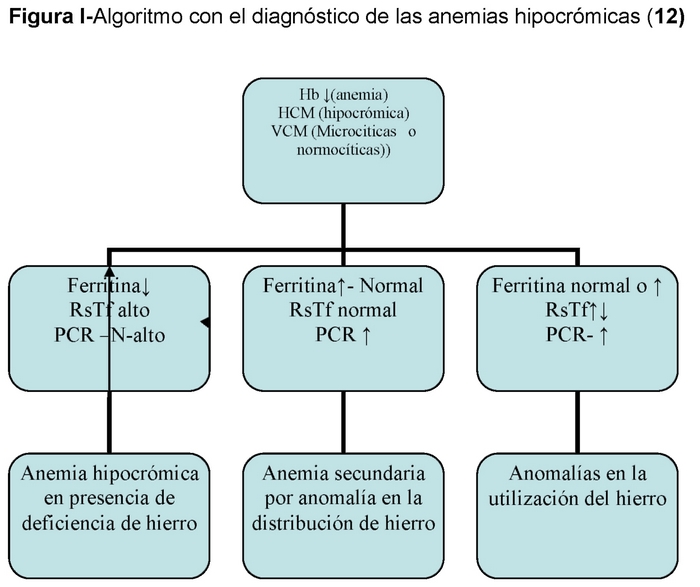
>
A abreviaturas:
– DH: deficiência de ferro
– ADH: anemia por deficiência de ferro
– Hb: hemoglobina
– MCV: volume corpuscular médio
– HVM: hemoglobina corpuscular média
– RsTf: receptor de transferrina solúvel
– CRP: proteína C reativa
– De acordo com a gravidade clínica:
– Anemia grave: Hb < 7.0 gr/dl
– Anemia moderada 7.1 -10.0 gr/dl
– Anemia leve 10.1 – 10.9 gr/dl
ADH é a etapa final de um processo que começa com deficiência de ferro latente no qual não há anemia mas sim deficiência de ferritina, seguido de deficiência de transporte de ferro no qual além de baixa ferritina há uma ETI abaixo de 15% e finalmente ADH com baixa ferritina, ETI < 15% e anemia. (Tabela II)
– Outras anemias com anormalidade na distribuição do ferro: 14,15
Anaemia da doença crônica (DCA): Nestes casos há uma redistribuição do ferro com aumento do ferro de depósito e uma relativa deficiência de ferro de células eritropoiéticas como conseqüência da diminuição da síntese de transferrina. Essa menor disponibilidade de ferro teria um efeito protetor contra infecções.
Anemia da doença renal: Neste caso, as reservas de ferro são normais, mas a mobilização de ferro está prejudicada (baixa saturação da transferrina), o que pode levar à eritropoiese e à má função do ferro. O ferro oral não pode ser usado porque a absorção é prejudicada.
A anemia renal é às vezes complicada por um componente hemolítico.
– Anormalidades não induzidas pelo ferro da eritropoiese:
Deficiência de vitamina B-12 e ácido fólico
Talassaemias: nesta doença há diminuição ou ausência da síntese da cadeia da globina. A estrutura da cadeia da globina é normal. Dependendo da quantidade de globina afetada, a talassemia é chamada alfa, beta, gama, delta talassemia. Normalmente manifestam-se com microcitose, hipocromia e anemia de intensidade variável. 13,14
Por causa de microcitose e hipocromia pode ser confundida com anemia por deficiência de ferro.
As mais frequentes são a talassemia alfa menor e a talassemia beta menor. Deve-se observar que crianças com talassemia também podem ter anemia por deficiência de ferro e podem precisar de tratamento com ferro oral. À medida que a síntese de uma cadeia de globos diminui, a síntese dos outros globos (Hb A2, Hb F) aumenta. A quantificação destas hemoglobinas nos ajuda a classificá-las.
Anemias microcíticas e hipocrômicas não são todas anemias por deficiência de ferro e neste grupo devemos destacar aquelas em que há má utilização de ferro, como a anemia de doenças crônicas, etc.
4.
Os sintomas da anemia por deficiência de ferro não são diferentes dos de outras anemias, ou seja, não são específicos; são principalmente fadiga, cansaço, falta de força; mas esses sintomas dependerão mais da velocidade de início da anemia do que dos níveis de hemoglobina.
Muito dos sintomas pode ser explicado pela deficiência de ferro.
Pagofagia: tendência compulsiva a comer gelo.
Geofagia: tendência a comer coisas sujas
Alterações nos epitélios: coiloníquia, estomatite angular, atrofia das papilas linguais, alterações nas mucosas do intestino.
Intolerância ao exercício Mudanças de comportamento: a criança torna-se apática e irritável.
5.-Causas de carência de ferro: (16)
Necessidades fisiológicas acrescidas: crescimento, menstruação, gravidez, lactação.
Perda de sangue: gastrointestinal, urogenital, iatrogênica
Malabsorção: ressecções gástricas, gastrite atrófica crônica, drogas Inadequada ingestão: idosos, vegetarianos
ADH faz parte de um diagnóstico mais complexo e não tem o mesmo significado em diferentes estágios da vida.
A. Na infância seria explicado pelo aumento das necessidades produzidas pelo crescimento. No caso da criança doente, o número e a quantidade de sangue retirado para estudos é muito importante(7,18,19)
O recém-nascido inicia a vida com cerca de 80 mg de ferro por kg de peso corporal e a maior parte deste ferro faz parte da hemoglobina com 50 gr/kg. A quantidade de ferro no recém-nascido é determinada pelo peso corporal e pela massa de hemoglobina em circulação. O corte do cordão umbilical imediatamente após o nascimento pode resultar na perda de 15-30% do ferro total. A concentração de Hb dos recém-nascidos é independente do Hb materno e dos níveis de ferro. Também não há correlação entre os níveis de ferritina materna e do cordão umbilical.
Novos nascidos de mães diabéticas, apesar do seu elevado peso à nascença, podem apresentar deficiência de ferro.
Nos primeiros 5 meses de vida o recém-nascido é capaz de duplicar o seu peso corporal sem esvaziar as reservas de ferro. Depois disso, a absorção do ferro é importante para manter o equilíbrio do ferro.
Durante o primeiro ano de vida as necessidades são maiores do que durante o resto da vida. A criança precisa de cerca de 0,5 mgr/d para satisfazer as necessidades impostas pelo crescimento. É improvável que o leite seja capaz de fornecer essa quantidade de ferro, porém, a anemia por deficiência de ferro é rara em crianças que são exclusivamente amamentadas, o que poderia ser explicado pelo fato de que o ferro do leite é absorvido até 80%. O estado nutricional dos lactentes amamentados é superior ao dos lactentes alimentados com leite de vaca. Entre 6 e 12 meses, lactentes alimentados com leite podem desenvolver deficiência de ferro.
A prevalência de DH está relacionada ao estado sócio-econômico da família).
B.- Em mulheres em idade fértil, a prevalência de DH está relacionada à função cognitiva e mesmo convulsões febris.
B.- Em mulheres em idade fértil, a prevalência de DH está relacionada ao estado sócio-econômico da família. Em mulheres em idade fértil seria explicado pela perda de ferro através da menstruação, gravidez e lactação.(20)
Perda de massa na maioria das mulheres é de 40 ml, o que equivale a 20 mgr de ferro. Na Europa, a dieta contém ferro suficiente para compensar as perdas de sangue de 80 ml ou 1,2 mg/d. O sangramento menstrual excessivo é a principal causa de anemia e afecta 9-14% das mulheres (21)
A gravidez resulta numa perda de aproximadamente 680 mg de ferro. Isto é muito mais do que pode ser absorvido, portanto a suplementação com ferro é necessária durante a gravidez.
Currentemente mais de 40 milhões de mulheres grávidas em países em desenvolvimento são deficientes em ferro. A anemia por deficiência de ferro é responsável por 75%-95% das anemias da gravidez. A anemia por deficiência de ferro durante a gravidez tem sido associada à prematuridade, baixo peso ao nascer e morbidade materna. As necessidades de ferro variam ao longo da gravidez. Entre 4 e 5 mgr de ferro são necessários durante o 2º e 3º trimestres. A profilaxia oral do ferro é a melhor forma de corrigir este défice. As necessidades fisiológicas de ferro durante a gravidez não podem ser satisfeitas pela co-administração com ácido fólico. As recomendações são 60 mg de ferro para mulheres sem anemia mais ácido fólico.(22)
C. – Em mulheres na pós-menopausa, adultos e idosos, o diagnóstico pode ser mais grave e o vazamento digestivo deve ser descartado(23).
Nos idosos, os níveis de Hb não são tão bem definidos para definir anemia.
Nos idosos, um nível normal de ferritina nem sempre exclui a deficiência de ferro, portanto o nível de corte para prever deficiência de ferro deve ser elevado para 50 microgramas/l.
Neste grupo de pacientes, o exame gastrointestinal está indicado devido à alta freqüência com que as lesões ocultas são detectadas.
Em pacientes acima de 75 anos de idade com anemia por deficiência de ferro, até 68% dos pacientes submetidos à endoscopia tiveram a causa do sangramento detectada e até 11% dos casos tiveram uma lesão síncrona.
A ausência de deficiência de ferro não exclui a presença de neoplasia gastrointestinal(24). Em até 20-30% dos idosos, a causa da anemia é desconhecida, sendo conhecida como “anemia idiopática do envelhecimento”
Conclusões
– O diagnóstico e classificação da HDA é baseado em técnicas básicas prontamente disponíveis em qualquer laboratório clínico,
– A HDA é o fim de um processo que começa com a deficiência de ferro.
– A clínica de HDA é semelhante a outras anemias, mas existem sintomas específicos que podem ser atribuídos à deficiência de ferro.
– A HDA é a anemia mais prevalente em todas as fases da vida
– Na infância entre 6 e 12 meses de idade, crianças alimentadas exclusivamente com leite de vaca podem desenvolver deficiência de ferro. Na criança hospitalizada, uma causa importante é o número de hemorragias.
– A HDA é responsável por 75%-95% das anemias na gravidez
– No caso de mulheres na pós-menopausa, adultos e idosos, a perda digestiva deve ser sempre descartada.
– Nos idosos, em até 20-30% dos casos a etiologia é desconhecida
Referências
1. Organização Mundial da Saúde. Avaliação, prevenção e controlo da anemia por deficiência de ferro. Um guia para gestores de programas. Genebra, Suíça. Organização Mundial da Saúde 2001.
2. Processo de tratamento de anemia. Proceso de anemia. Proceso asistencial integrado (Sevilha) Conserjería de Salud 2013. http://hdl.handle.net/10668/1683.
3. Ministério da Saúde Pública. Diretriz de prática clínica. Diagnóstico e tratamento da anemia na gravidez. 1ª Edição, Quito. Direcção Nacional de Normalização. 2014. http://saludgob.ec.
4. Matthew W, Domagalski, JE. Anemia por deficiência de ferro: avaliação e gestão. Médico de Família Americano 2013, vol 87, 2, 98-104.
5. Baker RD. Relatório clínico Diagnóstico e prevenção da deficiência de ferro e anemia por deficiência de ferro em lactentes e crianças pequenas (0-3 anos) Pediatria vol 126: %, 1040-1051, 2010. http://www.bcguidelines.ca/pdf/iron_deficiency.pdf.
6. Lukens J N. Metabolismo do ferro e deficiência de ferro. Capítulo 6. Doenças Sanguíneas da Infância e da Infância. 7-o edição.1995 Mosby.
7. OMS 1993-2005.prevalência mundial de anemia.- 1993-2005 OMS. Base de dados global sobre anemia. http://whqlibdoc.who.int/publications/2008/978924159657_eng.pdf.
8. Aisen P. Conceptos actuales sobre el metabolismo del hierro1-18; Clínica Hematológica; vol 10/2. Trastorno del metabolismo del hierro 1984. Salvat Editores.
9. Wick M, Pinggera W, Lehmann P. Aspectos clínicos e metabolismo do ferro de laboratório, anemias. Novos conceitos nas anemias de malignidades e doenças renais e reumatóides. Quinta, edição ampliada. 2013 Springer Wien New York.
10. Rapaport S.I. Eritropoyesis. Capítulo 1, 2-5 Introducción a la hematología 1974. Salvat Editores.
11. Goddard AF, James MW; Mcintyre AS, Scott BB; British Society of Gastroenterology. Guidelines for the management of iron deficiency anemia. Int. 2011; 60 (10): 1309-1316.
12. Mast AE, Blinder MA, Gronosky AM, Chumley C, Scott MG. Utilidade clínica do receptor de transferrina solúvel e comparação com a ferritina sérica em várias populações. Clin Chem. 1998; 44(1): 45-51.
13. Tefferi A, Hansen CA, Inwards DS. Como interpretar e perseguir a contagem anormal completa de células sanguíneas em adultos. Mayo Clin Proc 2005, 80: 923-936.
14. Wick M, Pinggera W, Lehmann P. Aspectos clínicos e metabolismo do ferro de laboratório, anemias. Diagnóstico das perturbações do metabolismo do ferro. Perturbações da eritropoiese. Quinta, edição ampliada.2003. Springer Wien New York.
15. Goddard AF, James MW, Mcintyre AS, Scott BB; British Society of Gastroenterology. Guidelines for the management of iron deficiency anemia. Int. 2011; 60 (10); 1309-1316.
16. Orkin HS, Nathan DG. As talassemias. Capítulo 21. Nathan and Oski’s Hematology of Infancy and childhood. 5a Edição.1998 W. B. Saunders Company.
17. Lee GR. Microcitose e as anemias associadas à síntese de hemoglobina deficiente. Capítulo 25. Hematologia Clínica de Wintrobe. Nona Edição.1993. LEA e FEBIGER.
18. Verga M E. Deficiência de ferro na infância: um imigrante está mais em risco? Swiss Med Wkly 2014; 144w14065.
19. Carter RC, Jacobson JL, Burden M et al. Anemia por deficiência de ferro e função cognitiva na infância. Pediatria 2010; 126 (2) 427-434.
21. Breyman C. Deficiência de ferro na gravidez. Seminários em hematol;2015; vol 52 (4) 339-347.
22. Fraser IS, Langhan S, Uhl- Hochgraeber K. Qualidade de vida relacionada com a saúde e carga económica da hemorragia uterina anormal. Especialista Rev Obstet Gynecol 2009; 4 (2):179-189.
23. Ioannou GN, Rockey DC, Bzyson C, Weis NS. Deficiência de ferro e malignidade gastrointestinal: um estudo de coorte de base populacional. Am J Med 2002. 113(4):276-280.
