Resultados de Aprendizagem
- Definir a regra do octeto e o seu papel nas ligações químicas
Nem todos os elementos têm electrões suficientes para encher as suas conchas mais exteriores, mas um átomo está no seu ponto mais estável quando todas as posições dos electrões na concha mais exterior estão preenchidas. Devido a estas vagas nas conchas mais exteriores, vemos a formação de ligações químicas, ou interacções entre dois ou mais elementos iguais ou diferentes que resultam na formação de moléculas. Para alcançar uma maior estabilidade, os átomos tenderão a preencher completamente as suas conchas exteriores e ligar-se-ão a outros elementos para alcançar este objectivo, partilhando electrões, aceitando electrões de outro átomo, ou doando electrões a outro átomo. Como as conchas exteriores dos elementos com baixo número atómico (até ao cálcio, com número atómico 20) podem conter oito electrões, isto é referido como a regra do octeto. Um elemento pode doar, aceitar, ou compartilhar elétrons com outros elementos para preencher sua casca externa e satisfazer a regra do octeto.
Um modelo inicial do átomo foi desenvolvido em 1913 pelo cientista dinamarquês Niels Bohr (1885-1962). O modelo Bohr mostra o átomo como um núcleo central contendo prótons e nêutrons, com os elétrons em conchas circulares de elétrons a distâncias específicas do núcleo, semelhante aos planetas orbitando ao redor do sol. Cada escudo de electrões tem um nível de energia diferente, sendo as conchas mais próximas do núcleo mais baixas em energia do que as mais afastadas do núcleo. Por convenção, a cada concha é atribuído um número e o símbolo n, por exemplo, a concha de electrões mais próxima do núcleo é chamada 1n. Para se mover entre conchas, um electrão deve absorver ou libertar uma quantidade de energia correspondente exactamente à diferença de energia entre as conchas. Por exemplo, se um electrão absorver energia de um fotão, pode ficar excitado e mover-se para uma casca de energia superior; inversamente, quando um electrão excitado cai para uma casca de energia inferior, irá libertar energia, muitas vezes sob a forma de calor.
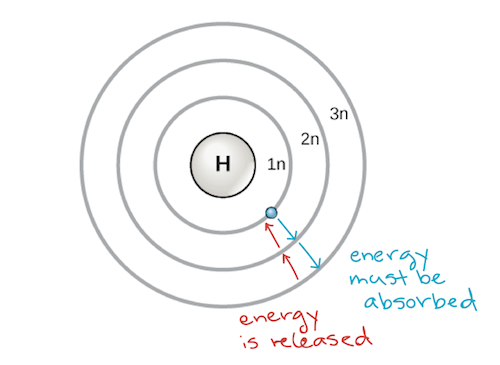
Modelo Bohr de um átomo, mostrando os níveis de energia como círculos concêntricos à volta do núcleo. A energia deve ser adicionada para mover um electrão para fora para um nível de energia mais elevado, e a energia é libertada quando um electrão desce de um nível de energia mais elevado para um mais próximo. Crédito da imagem: modificado de OpenStax Biology
Atoms, como outras coisas regidas pelas leis da física, tendem a assumir a configuração mais baixa de energia, a mais estável possível. Assim, as conchas de electrões de um átomo são povoadas de dentro para fora, com electrões a encher as conchas de baixa energia mais perto do núcleo antes de se moverem para as conchas de alta energia mais para fora. A casca mais próxima do núcleo, 1n, pode conter dois elétrons, enquanto a próxima casca, 2n, pode conter oito, e a terceira casca, 3n, pode conter até dezoito.
O número de elétrons na casca mais externa de um determinado átomo determina sua reatividade, ou tendência a formar ligações químicas com outros átomos. Esta casca mais externa é conhecida como a casca de valência, e os elétrons encontrados nela são chamados de elétrons de valência. Em geral, os átomos são mais estáveis, menos reactivos, quando o seu invólucro de electrões mais exterior está cheio. A maioria dos elementos importantes em biologia precisa de oito electrões na sua concha mais externa para ser estável, e esta regra é conhecida como a regra do octeto. Alguns átomos podem ser estáveis com um octeto mesmo que a sua concha de valência seja a concha 3n, que pode conter até 18 electrões. Vamos explorar a razão para isto quando discutirmos orbitais de electrões abaixo.
Exemplos de alguns átomos neutros e as suas configurações de electrões são mostradas abaixo. Nesta tabela, você pode ver que o hélio tem uma concha de valência completa, com dois elétrons em seu primeiro e único, 1n, concha. Da mesma forma, o néon tem uma concha externa completa de 2n, contendo oito elétrons. Estas configurações de electrões tornam o hélio e o néon muito estáveis. Embora o árgon não tenha tecnicamente uma concha externa completa, já que a concha 3n pode conter até dezoito elétrons, ele é estável como o neônio e o hélio porque tem oito elétrons na concha 3n e assim satisfaz a regra do octeto. Em contraste, o cloro tem apenas sete elétrons em sua casca mais externa, enquanto o sódio tem apenas um. Estes padrões não preenchem a casca mais externa ou satisfazem a regra do octeto, tornando o cloro e o sódio reativos, ansiosos para ganhar ou perder elétrons para alcançar uma configuração mais estável.
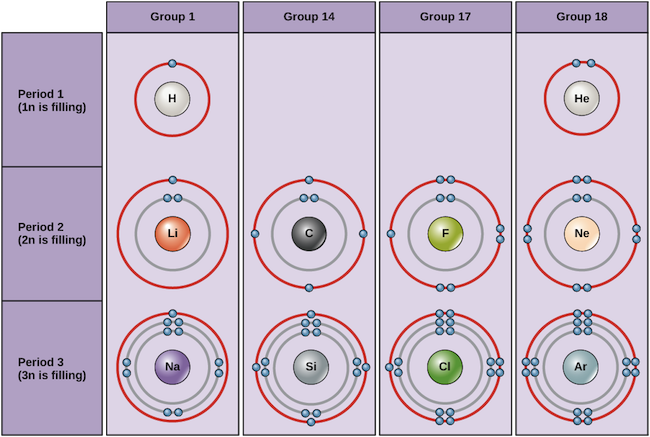
Diagramas Bohr de vários elementos Crédito da imagem: OpenStax Biology
Configurações elétricas e a tabela periódica
Elementos são colocados em ordem na tabela periódica com base no seu número atômico, quantos prótons eles têm. Em um átomo neutro, o número de elétrons será igual ao número de prótons, assim podemos facilmente determinar o número de elétrons a partir do número atômico. Além disso, a posição de um elemento na tabela periódica – sua coluna, ou grupo, e linha, ou período – fornece informações úteis sobre como esses elétrons estão dispostos.
Se considerarmos apenas as três primeiras linhas da tabela, que incluem os principais elementos importantes para a vida, cada linha corresponde ao preenchimento de uma casca de elétron diferente: hélio e hidrogênio colocam seus elétrons na casca 1n, enquanto elementos da segunda linha como Li começam a preencher a casca 2n, e elementos da terceira linha como Na continuam com a casca 3n. Da mesma forma, o número de coluna de um elemento dá informações sobre seu número de elétrons de valência e reatividade. Em geral, o número de elétrons de valência é o mesmo dentro de uma coluna e aumenta da esquerda para a direita dentro de uma linha. Os elementos do grupo 1 têm apenas um elétron de valência e os do grupo 18 têm oito, exceto o hélio, que tem apenas dois elétrons no total. Assim, o número do grupo é um bom preditor de quão reativo cada elemento será:
- Helium (He), neon (Ne), e argon (Ar), como elementos do grupo 18, têm conchas externas de elétrons que estão cheias ou satisfazem a regra do octeto. Isto torna-os altamente estáveis como átomos únicos. Devido à sua não reactividade, são chamados gases inertes ou gases nobres.
- Hidrogénio (H), lítio (Li), e sódio (Na), como elementos do grupo 1, têm apenas um electrão nas suas conchas mais exteriores. São instáveis como átomos únicos, mas podem tornar-se estáveis ao perder ou partilhar o seu único elétron de valência. Se estes elementos perderem completamente um electrão – como o Li e o Na normalmente fazem – tornam-se iões de carga positiva: Li+, Na+.
- Fluorina (F) e cloro (Cl), como elementos do grupo 17, têm sete elétrons em suas conchas mais externas. Eles tendem a alcançar um octeto estável ao retirar um elétron de outros átomos, tornando-se íons carregados negativamente: F- e Cl-.
- Carbono (C), como elemento do grupo 14, tem quatro elétrons em sua concha externa. O carbono tipicamente compartilha elétrons para obter uma casca de valência completa, formando ligações com múltiplos outros átomos.
Assim, as colunas da tabela periódica refletem o número de elétrons encontrados na casca de valência de cada elemento, que por sua vez determina como o elemento reagirá.
Try It
Contributo!
Implementar esta páginaAprenda Mais
