- Anual Cornea Report
- O que é CXL e como funciona?
- Qual é o papel da riboflavina durante a CXL?
- Qual o propósito da remoção epitelial no protocolo padrão CXL?
- Como é realizado o protocolo CXL padrão?
- Quais são as recomendações para a seleção do paciente?
- É necessária a progressão do KCN para recomendar CXL?
- Devo considerar CXL para pacientes com mais de 40?
- Quais são os achados e expectativas gerais do pós-operatório de CXL?
- Os pacientes com CXL podem esperar quaisquer alterações refrativas?
- O CXL é uma névoa preocupante?
- Can é possível realizar CXL sem remover o epitélio?
- 12. Quando devo reequipar as lentes de contacto após a CXL?
Anual Cornea Report
Sigam os links abaixo para ler outros artigos do nosso Relatório Anual da Córnea:
Um Guia de Opções de Transplante de Córnea
Fixar um Furo: Como curar defeitos epiteliais persistentes
Alerta de intruso: Diagnosticando doença infiltrativa da córnea
Para muitos provedores de cuidados com os olhos e pacientes, o manejo do queratocono (KCN) pode parecer a manutenção de um status quo indesejável. Devido aos avanços nas tecnologias de lentes de contato especiais, os enxertos de córnea agora são necessários apenas para 10% a 20% dos pacientes com KCN.1 Apesar disso, esses pacientes ainda pontuaram de forma semelhante àqueles com degeneração macular avançada no questionário de função visual do National Eye Institute no Estudo CLEK (Collaborative Longitudinal Evaluation of Keratoconus Study).2-5 Outro relatório do mesmo grupo constatou que os escores de qualidade de vida autopercebidos para pacientes com KCN continuam a diminuir ao longo do tempo.6 Com a prevalência de KCN postulado atingindo um em cada 375 indivíduos, a estabilização da doença e a melhoria ou manutenção da qualidade de vida são prioridades máximas.7
Desde o seu desenvolvimento em 2003, o crosslinking corneal (CXL) tornou-se rapidamente o tratamento de escolha para o controle da progressão do KCN.8 Embora a CXL só tenha recebido a aprovação da US Food and Drug Administration (FDA) em 2016 (Sistema KXL da Avedro e dois fotoenhadores, Photrexa e Photrexa viscosos), temos sido capazes de oferecer tratamentos CXL a pacientes durante muitos anos no Wills Eye Hospital sob os auspícios de ensaios clínicos. Como resultado, nós administramos muitos desses pacientes com clínicos comunitários.
Como com qualquer novo procedimento de tratamento, existe uma curva de aprendizado para os clínicos refinarem a educação e o processo de seleção dos pacientes, assim como outros protocolos relacionados à gestão perioperatória. Um canal aberto de comunicação permite que o nosso Serviço de Corneal ajude os clínicos a obter conforto clínico com CXL em suas práticas de KCN. Aqui estão 12 perguntas comuns que nossos médicos parceiros fazem; as respostas podem ajudá-lo a decidir sobre a melhor forma de educar seus pacientes de KCN sobre CXL.
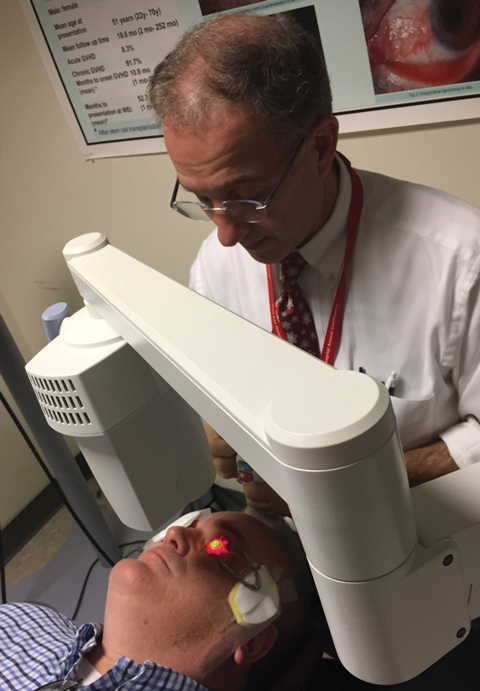
Fig. 1. Christopher Rapuano, MD, realiza um protocolo padrão de reticulação corneana com o Sistema KXL aprovado pelo FDA.
O que é CXL e como funciona?
Crosslinking é um processo de polimerização que rearranja os monómeros numa rede tridimensional de polímeros para aumentar a solidez de uma estrutura molecular. Este processo ocorre naturalmente no nosso corpo à medida que os tecidos conjuntivos se endurecem gradualmente ao longo do tempo. Facilitado pela enzima endógena lisil oxidase no lançamento das reações oxidativas necessárias, ligações covalentes adicionais (ou “crosslinks” teciduais) são formadas entre e dentro das fibras de colágeno – aumentando a resistência biomecânica tecidual.9
Tipicamente, os efeitos cumulativos das reações naturais de crosslinking são lentos a se manifestar. No final dos anos 90, pesquisadores da Universidade de Dresden na Alemanha determinaram que o processo de indução fotoquímica era o método mais clinicamente viável para impulsionar a indução de reticulações cruzadas na córnea, trazendo a CXL.8 Este estudo utilizou riboflavina a 0,1% (com 20% de dextrano em solução) como o fotossensibilizador para absorver uma dose de energia ultravioleta (UV) cuidadosamente calibrada, convertendo assim o oxigênio disponível no tecido em moléculas de oxigênio simples. As espécies de oxigênio reativas resultantes possuem energia suficiente para ativar a via enzimática lisil oxidase, levando à formação de novas ligações covalentes dentro do estroma córneo.
O estudo de Dresden relatou que todos os 23 olhos progressivos do KCN tratados foram estabilizados, com 70% mostrando a queratometria máxima achatada por 2,01D. Desde então, muitos estudos alcançaram eficácia semelhante com bons perfis de segurança em pacientes com KCN usando o mesmo protocolo CXL envolvendo remoção epitelial (Figura 1).10-13>
>
> >
>
>
> >
>
>
>
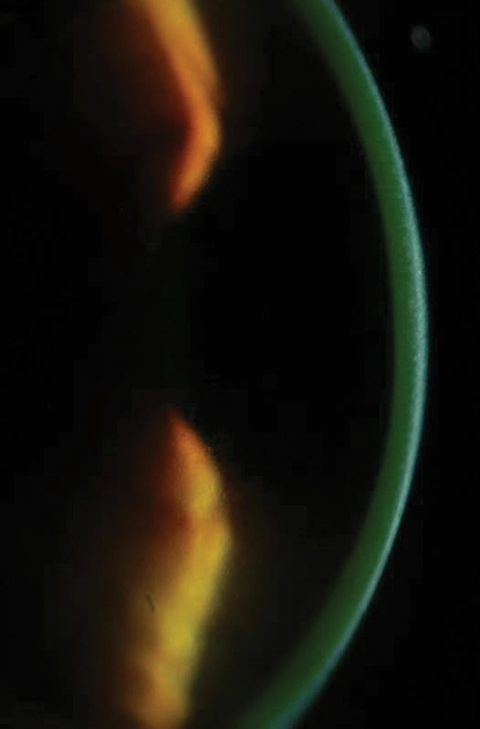
Figs. 2a e 2b. Acima, saturação da riboflavina vista no estroma corneal após a carga da riboflavina. Abaixo, após 30 minutos de carga de riboflavina em intervalos de dois minutos, os clínicos devem verificar a coloração aquosa da riboflavina. Clique na imagem inferior para aumentar.
Qual é o papel da riboflavina durante a CXL?
Desde que as moléculas de oxigénio biodisponíveis na córnea não possam ser activadas directamente pela luz UV, uma substância fotossensibilizante deve actuar como um agente intermediário. A riboflavina catalisa as reacções fotoquímicas da CXL transferindo energia UV (especificamente, UVA de 365nm para 370nm) para moléculas estromais de oxigénio, convertendo assim moléculas estáveis de oxigénio numa forma mais reactiva. Estas espécies reactivas de oxigénio iniciam então reacções oxidativas intrastromais.
Assumindo que a energia UV não é o recurso limitante, o reabastecimento contínuo de oxigénio e as moléculas activas de riboflavina são essenciais para manter a transferência de energia necessária para perpetuar o processo CXL.
Adicionalmente, saturar a córnea com riboflavina cria um “efeito de protecção” no qual os respectivos níveis de energia UV que atingem o endotélio, lentes e retina são titulados a uma intensidade muito menor do que os limiares reais de dano celular. De facto, se uma córnea saturada com riboflavina tiver pelo menos 400µm de espessura, a irradiação UV transmitida ao endotélio é de apenas 0,18mW/cm2, enquanto que o limiar real de dano endotelial é de aproximadamente 0,35mW/cm2. A partir daí, o nível de energia projetado para atingir a lente cristalina e retina é ainda menor quando comparado com os respectivos limiares de dano dessas camadas teciduais.14,15
Qual o propósito da remoção epitelial no protocolo padrão CXL?
A natureza lipofílica do epitélio córneo e o tamanho pequeno dos poros de suas junções apertadas tornam esta camada essencialmente impermeável às moléculas de riboflavina. Estas características de barreira epitelial impedem a saturação eficiente e homogénea da riboflavina no tecido do estroma visado.16
Epitélio também contém enzimas com elevadas propriedades antioxidantes como o ascorbato e os resíduos de triptofano, que podem impedir a penetração dos raios UV e a captura de espécies reactivas de oxigénio. Além disso, a presença de uma barreira epitelial retarda a taxa de reposição de oxigênio durante os procedimentos de CXL, reduzindo assim a quantidade total de novas ligações cruzadas celulares que podem ser criadas. Consequentemente, quando o mesmo protocolo CXL padrão é realizado com uma superfície corneana intacta, a eficácia global do procedimento será menor do que o previsto. Por outro lado, devido à saturação não homogénea da riboflavina e à redução dos efeitos de protecção da riboflavina, as transmissões UV entregues ao endotélio e aos tecidos oculares mais profundos podem ser superiores às anteriormente calculadas.16,17
Os clínicos não devem assumir que o CXL só é eficaz quando acompanhado de desbridamento epitelial. Embora as aplicações transepiteliais de CXL (TE-CXL) não tenham atualmente aprovação da FDA, técnicas de tratamento modificadas estão sob investigação para melhorar a eficácia do TE-CXL.
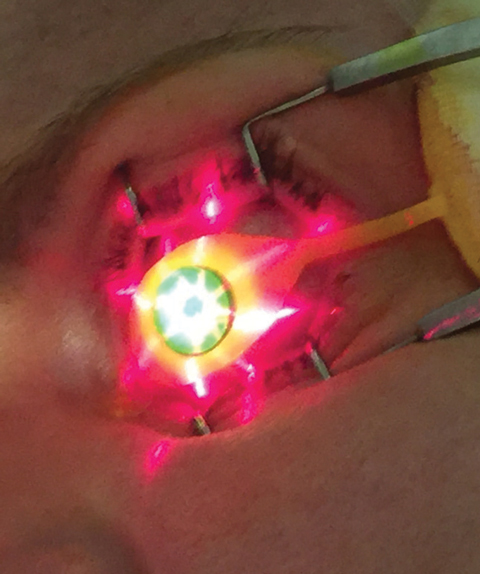
Fig. 3. A orientação cruzada é projectada do dispositivo KXL para o local de tratamento.
Como é realizado o protocolo CXL padrão?
Anestesia óptica é utilizada na remoção do epitélio central de 9mm de epitélio para garantir o conforto do paciente e permitir uma saturação estromal mais rápida e homogénea da Photrexa viscosa (riboflavina 5′-fosfato em solução oftálmica dextran 20%) durante o CXL. Esta fase dura 30 minutos com instilação da riboflavina em intervalos de dois minutos.10
Após 30 minutos, os pacientes são examinados sob a lâmpada-fenda para garantir que a riboflavina tenha saturado a área de tratamento pretendida e que esteja presente dentro da área aquosa (Figuras 2a e 2b). De acordo com as indicações aprovadas pelo FDA, os clínicos devem realizar a paquímetria após a aplicação da riboflavina para se certificarem que a espessura da córnea é de pelo menos 400µm. Se for inferior a 400µm, a Photrexa riboflavina hipotónica deve ser administrada a cada 5 a 10 segundos até a córnea ser reidratada a 400µm ou mais.10
É verificado o nível adequado de paquímetria, os médicos utilizam o dispositivo KXL UV (Avedro) para a segunda fase do tratamento CXL, onde 30 minutos de irradiação UV (3mW/cm2) produzem uma dose total de energia de 5,4J/cm2.8 Durante o período de emissão de UV, a Photrexa viscosa é instilada em intervalos de dois minutos, enquanto a centragem e distância entre os olhos do dispositivo são mantidas pelo operador. A posição adequada do dispositivo KXL pode ser guiada pelas projecções de imagem em mira (Figura 3), que ajudam a fornecer um perfil de feixe de luz óptimo à córnea tratada.
A riboflavina de excesso pode ser lavada com uma solução salina equilibrada no final de uma sessão de tratamento. Após a instilação de antibióticos tópicos e corticosteróides, é inserida uma lente de contacto com ligadura (BCL). A BCL deve ser mantida no olho tratado durante três a cinco dias ou até ao fecho epitelial (Figuras 4a e 4b).
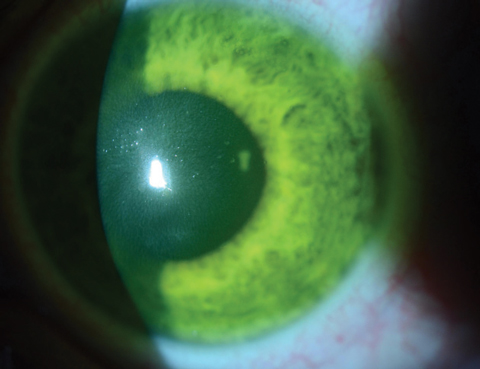
Fig. 4a. Aqui, uma ligadura de lentes de contacto macias está sobre o olho imediatamente após o tratamento com CXL num paciente onde a saturação da riboflavina corneana ainda é evidente.
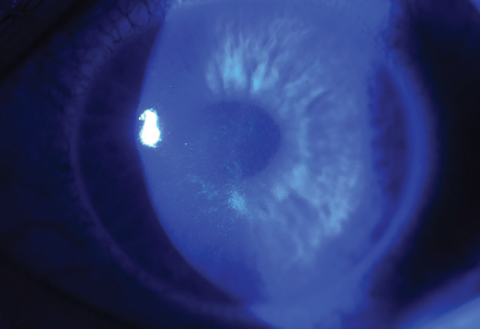
Fig. 4b. O fechamento da ferida epitelial está quase sempre completo no mesmo paciente apenas três dias após o tratamento com CXL.
Quais são as recomendações para a seleção do paciente?
Em 2016, o protocolo padrão CXL recebeu indicações rotuladas nos Estados Unidos para tratar pacientes com 14 anos de idade ou mais com KCN progressivo ou ectasia corneana após cirurgias refrativas. No entanto, quando não tratados, sabe-se que a gravidade da doença e a taxa de progressão são mais agressivas em pacientes mais jovens. Portanto, o sistema KXL e Photrexa/Photrexa viscous podem ser considerados para uso fora do rótulo em pacientes mais jovens com espessura corneana mínima de 400µm ou maior. Pacientes com KCN a partir de oito anos de idade foram relatados por ensaios clínicos, mas nestes casos devem ser obtidos consentimentos especiais informados dos pacientes e seus tutores.18
Embora a FDA não tenha especificado nenhuma contra-indicação, os clínicos devem exercer julgamento antes de oferecer CXL a mães lactantes e pacientes com mais de 65 anos de idade. Além disso, os pesquisadores recomendam fortemente evitar a CXL durante o curso de uma gravidez. Um estudo recente encontrou evidências topográficas, paquimétricas e biomecânicas da progressão do KCN em 100% da sua coorte de pacientes grávidas.19 Isso levou os pesquisadores a recomendar a discussão da CXL profilática com pacientes do sexo feminino antes do planejamento familiar. Alguns países europeus começaram a oferecer proativamente CXL a pacientes KCN femininas que estão planejando a gravidez apesar da falta de progressão da doença.20
É necessária a progressão do KCN para recomendar CXL?
Embora a progressão do KCN seja parte da indicação no rótulo para o tratamento CXL, certas circunstâncias não requerem progressão antes de uma consulta de CXL. Pacientes com KCN feminino que estão planejando engravidar e pacientes com alto risco de progressão são apenas dois exemplos clínicos potenciais.19,21
De acordo com o modelo convencional de tratamento KCN, algumas mudanças significativas nos parâmetros clínicos devem se manifestar antes de iniciar um novo curso de tratamento. No entanto, uma progressão significativa ocorre frequentemente antes de serem tomadas medidas devido à falta de consenso sobre o indicador clínico exato e a magnitude correspondente da mudança que constitui a progressão da doença. Muitos estudos CXL definem a progressão do KCN como alterações durante um período de 12 meses em qualquer uma das seguintes medidas: 1D ou mais em queratometria máxima; 0,5D ou mais em miopia; 1D ou mais em astigmatismo; ou 10µm ou mais em ponto paquímico mais fino.10-12,20,22 Contudo, com a precisão limitada dos topógrafos tradicionais ao imaginarem a superfície corneana irregular e a variabilidade refractiva dos pacientes com KCN, estas directrizes podem resultar numa maior taxa de falsos positivos.
Alternativamente, um painel de especialistas recomendou recentemente que a presença de pelo menos dois dos três critérios pode estabelecer progressão: acentuação da curvatura da córnea anterior; acentuação da curvatura da córnea posterior; ou desbaste ao comparar o perfil de distribuição paquimétrica da periferia com o ponto mais fino.21 Embora úteis, essas diretrizes requerem o acesso à tomografia de córnea capaz de acompanhar as alterações ao longo do tempo, apresentando um possível desafio para alguns clínicos comanistas.
Dados estes obstáculos clínicos, o painel de especialistas reunidos em quatro sociedades supranacionais de córnea concluiu que as recomendações de CXL podem ser feitas a pacientes com perfil de alto risco, mesmo que a progressão não tenha sido documentada.21
Devo considerar CXL para pacientes com mais de 40?
A resposta curta é sim. Os pacientes com KCN tendem a apresentar uma taxa de progressão mais lenta ou mesmo estabilização na sua quarta ou quinta década de vida, provavelmente um subproduto do crosslinking associado à idade. Entretanto, a expressão do KCN é altamente variável, e a idade por si só nem sempre é um ponto final bem definido para o KCN. Uma revisão retrospectiva do gráfico do Wills Eye Hospital encontrou que 24% dos 186 olhos recém-diagnosticados com KCN pertenciam a pacientes com 40 anos ou mais.23
Além disso, dado que a ectasia pós-cirúrgica pode ocorrer em um ponto mais tardio da vida do que um paciente típico com KCN, o consenso clínico não definiu uma faixa etária para quando a ectasia tipicamente ocorre e quando a progressão pode diminuir. Assim, os clínicos devem abster-se de usar a idade como contra-indicação absoluta para a candidatura à CXL.
Quais são os achados e expectativas gerais do pós-operatório de CXL?
A fase inicial de recuperação da CXL padrão é muito parecida com qualquer procedimento envolvendo a remoção do epitélio da córnea. Embora os LCCs ofereçam proteção terapêutica e maior conforto ao paciente, a maioria dos pacientes ainda sente algum desconforto ocular ou dor até o fechamento do defeito epitelial, que geralmente ocorre em três a cinco dias.24
Após o fechamento epitelial, a acuidade visual geralmente piora ou flutua muito ao longo do primeiro mês antes de retornar lentamente à linha de base até o terceiro mês. Os pacientes podem experimentar uma melhora leve na visão entre os três e seis meses ou entre os seis e 12 meses. Adicionalmente, uma tendência de estabilização tipicamente emerge como a nova linha de base entre os meses seis e 12,10-12
Após CXL padrão, as medidas de queratometria, paquímetria e neblina CXL transitória também seguem um padrão temporal semelhante, com maior acentuação, afinamento e redução da transparência corneana durante o primeiro mês. Estas tendências tipicamente se invertem ao longo dos dois meses seguintes, momento em que os pacientes retornam lentamente às características da linha de base. Algumas vezes esses pacientes até mesmo experimentam leves melhorias antes de alcançar um platô de estabilização (Figura 5).10-12
É importante não interpretar mal estas tendências pós-operatórias imediatas como agravamento na doença KCN ou falha de CXL. Em geral, apesar de um protocolo de epi-off CXL, existe apenas um curto período durante a recuperação pós-operatória imediata, onde os pacientes podem se sentir visualmente comprometidos. Isso ocorre porque os pacientes são reequipados com lentes de contato ou podem retomar o uso de lentes de contato antes de alcançarem a estabilização pós-CXL.
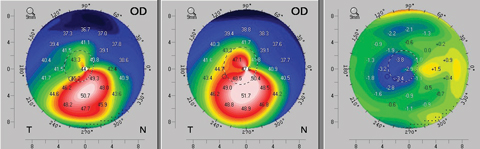
Fig. 5. Um exemplo de achatamento topográfico visto tão cedo quanto três meses após o protocolo padrão (epi-off) de reticulação da córnea. O mapa à esquerda mostra a topografia axial pré-operatória do paciente. O mapa central é a topografia pós-operatória no terceiro mês e o mapa direito fornece um cálculo da diferença revelando a melhora topográfica no terceiro mês. Clique na imagem para ampliá-la.
Os pacientes com CXL podem esperar quaisquer alterações refrativas?
Os estudos relataram resultados variáveis para esfera, cilindro e equivalente esférico aos 12 meses de tratamento pós-CXL. Alguns mostram mudanças refrativas estatisticamente significativas, enquanto outros não registraram diferenças notáveis.25-27 Pesquisadores relataram melhorias no total de aberrações de ordem mais alta, aberrações esféricas e coma, bem como achatamento topográfico médio de 1,6D.10,28 Ainda assim, a literatura não fornece correlações consistentes entre as mudanças nesses parâmetros clínicos e o tratamento com CXL.
Consequentemente, a estabilização do KCN deve permanecer o objetivo primário dos protocolos CXL atualmente disponíveis. Antes de recomendar o CXL, os pacientes devem ser informados de que lentes de contato ou óculos ainda serão necessários após o CXL, e essa abordagem de manejo pode melhorar a qualidade de vida dos pacientes, reduzindo a frustração freqüentemente associada às frequentes alterações ópticas quando o KCN não é tratado.
O CXL é uma névoa preocupante?
A nebulosidade CXL transitória pode parecer semelhante à nebulosidade da córnea pós-PRK. Com a experiência, porém, os médicos podem diferenciar as duas entidades sob a lâmpada-de-fenda. A neblina CXL cria uma alteração do tecido em pó nos níveis anterior e médio do estroma, enquanto a neblina PRK se manifesta num padrão de proliferação fibrótica reticulada que está localizada nas camadas subepitelial e anterior do estroma. Dadas as diferentes aparências anatómicas e a natureza auto-resolutiva da névoa CXL, é improvável que tenha as mesmas implicações visuais da névoa PRK.24
Imediatamente após o tratamento com CXL, a microscopia confocal irá revelar apoptose queratocitária e edema lacunar na área anterior a médio-estroma. Como as áreas de nevoeiro CXL e edema do estroma começam a mostrar melhoria no final do primeiro mês, os clínicos verão zonas de descontinuidade óptica – ou linhas de demarcação – com uma secção óptica durante o exame com lâmpada de fenda (Figura 6).24
Embora a incapacidade de brilho seja uma possibilidade durante as primeiras seis a oito semanas, o nevoeiro CXL transitório e a profundidade da linha de demarcação são frequentemente usados como indicadores para reflectir a penetração do tratamento e a consequente remodelação do estroma de colagénio. À medida que os queratócitos repovoam lentamente, a backscattering da luz começa a resolver-se e as áreas de CXL haze começam a desvanecer-se entre três e seis meses. A névoa torna-se frequentemente imperceptível após um ano de CXL. Os esteróides tópicos são frequentemente descontinuados após as primeiras semanas após o procedimento, mas a maioria dos casos de CXL haze se auto-resolve ao longo do tempo sem mais intervenções terapêuticas; assim, os investigadores sugerem que os esteróides tópicos não mitigam a CXL haze e o seu uso a longo prazo não é necessário após a CXL padrão. Contudo, um estudo propôs que os esteróides tópicos podem ser justificados se a neblina persistente ou cicatrização do estroma for observada após a marca de um ano.24,29
>
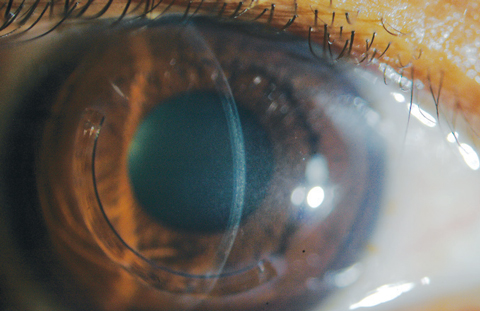
Fig. 6. As linhas de demarcação são visualizadas com secção óptica num paciente que recebeu tratamento off-label de implante corneal CXL e Intacs (AJL Ophthalmic).
Can é possível realizar CXL sem remover o epitélio?
>
A epitélio-padrão CXL é minimamente invasivo e altamente eficaz em parar a progressão do KCN. Além disso, os eventos adversos são incomuns após o CXL padrão.10-13 Entretanto, os pesquisadores continuam a investigar métodos de administração para aumentar o conforto durante e após o procedimento, encurtar o tempo de recuperação visual e reduzir os riscos de infecção potencial.
A manutenção do epitélio intacto reduz as taxas de difusão da riboflavina, luz UV e oxigênio, todos essenciais para as reações fotoquímicas durante a CXL. Os pesquisadores têm sido capazes de contornar a função da barreira epitelial interrompendo junções estreitas com intensificadores químicos como o cloreto de benzalkonium (BAK) e o ácido etilenodiaminotetracético (EDTA). Estes melhoradores corneanos são incorporados na solução de riboflavina para ajudar a penetrar no estroma corneano. No entanto, alguns estudos relataram linhas de demarcação mais rasas e reduziram os efeitos de endurecimento da córnea após TE-CXL.30,31
Embora vários estudos tenham relatado maiores taxas de regressão com TE-CXL, suas taxas de eventos adversos também são menores do que as de CXL padrão de epinefrina. Além disso, a profundidade mais rasa do tratamento com CXL pode ser vantajosa em olhos com córneas mais finas na linha de base. Os pacientes com baixo risco de progressão e aqueles que estão preocupados com o tempo de recuperação visual podem ser candidatos razoáveis à TE-CXL.24,30,31
Até que a eficácia da TE-CXL melhore, continuaremos a recomendar a CXL padrão de epi-off para pacientes com KCN com alta probabilidade de progressão ou progressão clínica agressiva.
12. Quando devo reequipar as lentes de contacto após a CXL?
Um estudo usando microscopia confocal mostrou que a espessura epitelial volta gradualmente ao normal entre três e seis meses após a CXL padrão.24 No entanto, muitos pacientes requerem reabilitação das lentes de contato para funcionar e não podem esperar seis meses antes de retomar o uso das lentes de contato.
Nossa abordagem pessoal é adotar uma estratégia de adaptação da lente que permita uma interação mínima ou nenhuma entre a superfície posterior da lente e o epitélio córneo, dada a possibilidade de névoa persistente com cicatrização epitelial retardada ou remodelação epitelial interrompida. Vários designs de lentes podem ajudar a atingir esse objetivo, incluindo aquelas com capacidades de abóbada corneana, tais como lentes híbridas, esclerais, piggyback e até mesmo lentes macias personalizadas. Por experiência clínica, descobrimos que o tempo ideal para considerar a remodelação de uma lente é aproximadamente quatro a seis semanas após o CXL padrão ou duas semanas após o TE-CXL. Também é prudente enfatizar aos pacientes, particularmente após a CXL padrão, que modificações refrativas freqüentes em suas lentes de contato podem ser esperadas durante os próximos seis a 12 meses.
A emergência da CXL deu início a uma nova era de gestão KCN, na qual os clínicos já não têm de assumir uma abordagem de gestão reactiva passiva e oferecer aos pacientes apenas uma escolha forçada entre lentes de contacto e enxertos corneais. Com a intervenção precoce da CXL para candidatos apropriados e a monitorização contínua pós-CXL, os clínicos podem ajudar os pacientes a manter a sua melhor função visual e adiar ao máximo as possíveis necessidades de queratoplastias. O foco clínico de hoje deve ir além de simplesmente reequipar as lentes de contato à medida que o KCN progride. Com a detecção precoce do KCN, o acesso ao CXL e os avanços nos designs de lentes especiais, os clínicos podem ajudar os seus pacientes com KCN a viver a vida ao máximo.
Dr. Chang é diretor de Lentes de Especialidade de Córnea no Wills Eye Hospital-Cornea Service e diretor de serviços clínicos da TLC Vision. É membro do conselho consultivo da International Keratoconus Academy, do Gas Permeable Lens Institute e da Optometric Cornea, Cataract and Refractive Society.
O Dr. Rapuano é chefe do Serviço de Córnea do Wills Eye Hospital. Ele publicou vários livros, numerosos capítulos de livros e mais de 175 artigos revisados por pares, incluindo ter sido co-autor do The Wills Eye Manual.
1. Godefrooij DA, Gans R, Imhof SM, Wisse RP. Redução a nível nacional do número de transplantes de córnea para queratocono após a implementação da reticulação. Acta Ophthalmol. 2016;94(7):675-8.
2. Davidson AE, Hayes S, Hardcastle AJ, et al. The pathogenesis of keratoconus. Eye (Lond). 2014;28(2):189-95.
3. Tuft SJ, Moodaley LC, Gregory WM, et al. Fatores prognósticos para a progressão do queratocônio. Oftalmologia. 1994;101(3):439-47.
4. Gordon MO, Steger-May K, Szczotka-Flynn L, et al. Baseline factors predictive of incident penetrating keratoplasty in keratoconus. Am J Ophthalmol. 2006;142(6):923-30.
5. Kymes SM, Walline JJ, Zadnik K, Gordon MO. Qualidade de vida em queratocono. Am J Ophthalmol. 2004;138(4):527-35.
6. Kymes SM, Walline JJ, Zadnik K, et al. Mudanças na qualidade de vida das pessoas com queratocone. Am J Ophthalmol. 2008;145(4):611-7.
7. Godefrooij DA, de Wit GA, Uiterwaal CS, et al. Age-specific incidence and prevalence of keratoconus: a national registration study. Am J Ophthalmol. 2017;175:169-72.
8. Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced colagen crosslinking for the treatment of keratoconus. Am J Ophthalmol 2003;135(5):620-7.
9. Schumacher S, Mrochen M, Wernli J, et al. Modelo de otimização para reticulação corneana UV-riboflavina. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
10. Chang CY, Hersh PS. Cross-linking de colágeno corneal: uma revisão de resultados de 1 ano. Lente de contato ocular. 2014;40(6):345-52.
11. Hersh PS, Stulting RD, Muller D, et al. United States multicenter clinical trial of corneal collagen crosslinking for keratoconus treatment. Oftalmologia. 2017;124(9):1259-70.
12. Hersh PS, Stulting RD, Muller D, et al. US clinical trial of corneal collagen crosslinking for treatment of corneal ectasia after refractive surgery. Oftalmologia. 2017;124(10):1475-84.
13. Raiskup F, Theuring A, Pillunat LE, Spoerl E. Crossslinking do colágeno corneal com riboflavina e ultravioleta – uma luz em queratocono progressivo: resultados de dez anos. J Catarata Refract Surg. 2015;41(1):41-6.
14. Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. Segurança da ligação cruzada UVA-riboflavina da córnea. Córnea. 2007 Maio;26(4):385-9.
15. Schumacher S, Mrochen M, Wernli J, et al. Modelo de optimização para a reticulação da córnea por UV-riboflavina. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
16. Bottós KM, Schor P, Dreyfuss JL, et al. Effect of cornea epithelium on ultraviolet-a and riboflavin absorption. Arq Bras Oftalmol. 2011;74(5):348-51.
17. Richoz O, Hammer A, Tabibian D, et al. O efeito biomecânico da ligação cruzada do colágeno corneano (CXL) com riboflavina e UV-A é dependente do oxigênio. Transl Vis Sci Technol. 2013;2(7):6.
18. Padmanabhan P, Rachapalle Reddi S, Rajagopal R, et al. Cross-linking de colágeno corneal para queratocônio em pacientes pediátricos – resultados a longo prazo. Córnea. 2017;36(2):138-43.
19. Naderan M, Jahanrad A. Alterações topográficas, tomográficas e biomecânicas da córnea durante a gravidez em pacientes com queratocônio: um estudo de coorte. Acta Ophthalmol. 2017;95(4):e291-e296.
20. Sandvik GF, Thorsrud A, Råen M, et al. O reticulado do colágeno corneal reduz a necessidade de queratoplastias em pacientes com queratocônio? A córnea. 2015;34(9):991-5.
21. Gomes JA, Tan D, Rapuano CJ, et al. Global consensus on keratoconus and ectatic diseases. Córnea. 2015;34(4):359-69.
22. Nordström M, Schiller M, Fredriksson A, Behndig A. Refractive improvements and safety with topography-guided corneal crosslinking for keratoconus: 1-year results. Br J Ophthalmol. 2017;101(7):920-5.
23. Yildiz EH, Diehl GF, Cohen EJ, et al. Demografia de pacientes com mais de 50 anos de idade com queratocônio. Lente de contato ocular. 2009;35(6):309-11.
24. Mazzotta C, Hafezi F, Kymionis G, et al. Microscopia confocal in vivo após reticulação do colágeno corneal. Ocul Surf. 2015;13(4):298-314.
25. Cınar Y, Kürs¸at Cingü A, Turkcu FM, et al. Cross-linking acelerado de colágeno corneal para queratocônio progressivo. Cutan Ocul Toxicol. 2014;33:168-71.
26. Kanellopoulos AJ. Resultados a longo prazo de um ensaio prospectivo de comparação visual bilateral aleatório de maior fluência, radiação ultravioleta a curta duração e ligação cruzada de colágeno riboflavina para queratocônio progressivo. Clin Ophthalmol. 2012;6:97-101.
27. Cummings AB, McQuaid R, Naughton S, et al. Optimização da ligação cruzada da córnea no tratamento do queratocono: uma comparação de resultados após protocolos standard- e de alta intensidade. Córnea. 2016;35(6):814-22.
28. Vinciguerra P, Albè E, Trazza S, et al. Análise refractiva, topográfica, tomográfica e aberrométrica de olhos queratocónicos submetidos a reticulação corneana. Oftalmologia. 2009;116(3):369-78.
29. Kim BZ, Jordan CA, McGhee CN, Patel DV. História natural da névoa corneana após a reticulação do colágeno corneal em queratocono usando análise Scheimpflug. J Cataract Refract Surg. 2016;42(7):1053-9.
30. Wollensak G, Iomdina E. Alterações biomecânicas e histológicas após reticulação da córnea com e sem desbridamento epitelial. J Catarata Refratária de Cirurgia. 2009;35(3):540-6.
31. Caporossi A, Mazzotta C, Paradiso AL, et al. Transepithelial corneal crosslinking for progressive keratoconus: resultados clínicos de 24 meses. J Cataract Refract Surg. 2013;39(8):1157-63.
