Objetivos de aprendizado
- Escrever a fórmula química para um composto iônico simples.
- Reconhecer íons poliatômicos em fórmulas químicas.
Já encontramos algumas fórmulas químicas para compostos iônicos simples. Uma fórmula química é uma lista concisa dos elementos de um composto e as proporções destes elementos. Para entender melhor o que significa uma fórmula química, devemos considerar como um composto iônico é construído a partir de seus íons.
Existem compostos iônicos como íons positivos e negativos alternados em conjuntos tridimensionais regulares chamados cristais (Figura \PageIndex{1}}). Como você pode ver, não há “partículas” individuais de NaCl no array; em vez disso, há uma malha contínua de íons de sódio e cloreto alternados. No entanto, podemos usar a proporção de íons sódio para íons cloreto, expressa nos menores números inteiros possíveis, como uma forma de descrever o composto. No caso do cloreto de sódio, a razão entre íons sódio e íons cloreto, expressa nos menores números inteiros possíveis, é de 1:1, portanto usamos NaCl (um símbolo de Na e um símbolo de Cl) para representar o composto. Assim, NaCl é a fórmula química do cloreto de sódio, que é uma forma concisa de descrever o número relativo de íons diferentes no composto. Uma amostra macroscópica é composta por miríades de pares de NaCl; cada par chamado de unidade de fórmula. Embora seja conveniente pensar que os cristais de NaCl são compostos de unidades individuais de NaCl, a Figura 1 mostra que nenhum íon único está exclusivamente associado a qualquer outro íon único. Cada íon está rodeado por íons de carga oposta.
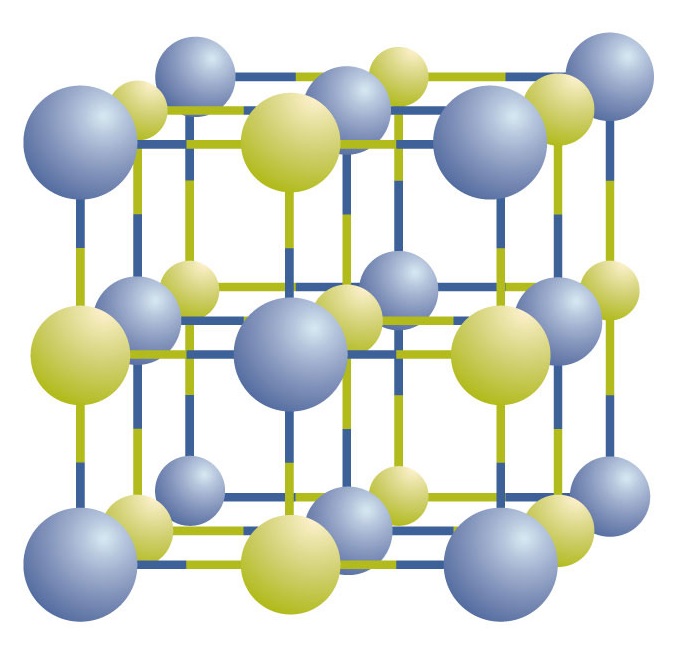
Figure \(\PageIndex{1}}}Um Cristal de Cloreto de Sódio. Um cristal contém uma matriz tridimensional de íons positivos e negativos alternados. O padrão preciso depende do composto. Um cristal de cloreto de sódio, mostrado aqui, é uma coleção de íons alternados de sódio e cloro.
A fórmula de um composto iônico segue várias convenções. Primeiro, o catião é escrito antes do ânion. Como a maioria dos metais formam cátions e a maioria dos não-metálicos formam ânions, as fórmulas tipicamente listam primeiro o metal e depois o não-metálico. Segundo, as cargas não são escritas em uma fórmula. Lembre-se que em um composto iônico, as espécies componentes são íons, não átomos neutros, mesmo que a fórmula não contenha cargas. Finalmente, a fórmula adequada para um composto iônico sempre obedece à seguinte regra: a carga total positiva deve ser igual à carga total negativa. Para determinar a fórmula adequada de qualquer combinação de íons, determine quantos de cada íon são necessários para equilibrar o total de cargas positivas e negativas no composto.
Esta regra é baseada no fato de que a matéria é, em geral, eletricamente neutra.
Por convenção, suponha que haja apenas um átomo se um subscrito não estiver presente. Não usamos 1 como subscrito.
Se olharmos para o composto iônico composto por íons lítio e íons brometo, vemos que o íon lítio tem uma carga 1+ e o íon brometo tem uma carga 1-. Apenas um íon de cada é necessário para equilibrar essas cargas. A fórmula para o brometo de lítio é LiBr.
Quando um composto iônico é formado de magnésio e oxigênio, o íon de magnésio tem uma carga 2+, e o átomo de oxigênio tem uma carga 2. Embora esses dois íons tenham cargas mais altas que os íons do brometo de lítio, eles ainda se equilibram numa proporção de um para um. Portanto, a fórmula adequada para este composto iônico é MgO.
Agora considere o composto iônico formado por magnésio e cloro. Um íon de magnésio tem uma carga 2+, enquanto um íon de cloro tem uma carga 1:
Mg2+ Cl-
Combinando um íon de cada um não se equilibra completamente as cargas positivas e negativas. A maneira mais fácil de equilibrar essas cargas é assumir a presença de dois íons cloreto para cada íon de magnésio:
Mg2+ Cl- Cl-
Agora as cargas positivas e negativas são equilibradas. Poderíamos escrever a fórmula química para este composto iônico como MgCl, mas a convenção é usar um subscrito numérico quando há mais de um íon de um determinado tipo-MgCl2. Esta fórmula química diz que há um íon de magnésio e dois íons de cloreto nesta fórmula. (Não leia a parte “Cl2” da fórmula como uma molécula do cloro elementar diatômico. O cloro não existe como elemento diatómico neste composto. Existe antes como dois iões de cloro individuais). Por convenção, a menor razão de número inteiro é usada nas fórmulas de compostos iônicos. A fórmula Mg2Cl4 tem cargas equilibradas com os íons na proporção 1:2, mas não é a menor razão de número inteiro.
Por convenção, a menor razão de número inteiro dos íons é usada nas fórmulas iônicas. Há exceções para certos íons, como Hg22+
Exemplo \(\PageIndex{1})
Escrever a fórmula química de um composto iônico composto de cada par de íons.
- o íon sódio e o íon enxofre
- o íon alumínio e o íon flúor
- o íon ferro 3+ e o íon oxigênio
Solução
- Para obter um octeto de concha de valência, o sódio forma um íon com uma carga 1+, enquanto o íon enxofre tem uma carga 2. Dois íons de sódio 1+ são necessários para equilibrar a carga 2 sobre o íon de enxofre. Em vez de escrever a fórmula como NaNaS, nós a encurtamos por convenção para Na2S.
- O íon de alumínio tem uma carga 3+, enquanto o íon de flúor formado por flúor tem uma carga 1-. Três íons de 1 flúor são necessários para equilibrar a carga de 3+ sobre o íon de alumínio. Esta combinação é escrita como AlF3.
- Iron pode formar dois íons possíveis, mas o íon com uma carga 3+ é especificado aqui. O átomo de oxigênio tem uma carga 2 como um íon. Para equilibrar as cargas positivas e negativas, olhamos para os múltiplos-6 menos comuns: dois iões de ferro 3+ darão 6+, enquanto três iões de oxigénio 2 darão 6-, equilibrando assim as cargas gerais positivas e negativas. Assim, a fórmula para este composto iônico é Fe2O3.
Exercício \(\PageIndex{1}})
Escrever a fórmula química para um composto iônico composto de cada par de íons.
- o íon cálcio e o íon oxigênio
- o íon cobre 2+ e o íon enxofre
- o íon cobre 1+ e o íon enxofre
Iões poliatómicos
Alguns íons consistem em grupos de átomos ligados entre si e têm uma carga eléctrica global. Como esses íons contêm mais de um átomo, eles são chamados de íons poliatômicos. Os iões poliatómicos têm fórmulas, nomes e cargas características que devem ser memorizadas. Por exemplo, NO3- é o íon nitrato; ele tem um átomo de nitrogênio e três átomos de oxigênio e uma carga global de 1-. A tabela {1}(PageIndex{1}) lista os íons poliatômicos mais comuns.
| Nome | Fórmula |
|---|---|
| Ião de amónio | NH4+ |
| Ião de acetato | C2H3O2- |
| ião carbonato | CO32- |
| ião carbonato de hidrogénio (ião bicarbonato) | HCO3- |
| ião cianureto | CN- |
| ião hidróxido | OH- |
| ião fosfato | PO43- |
| ião fosfato de hidrogénio | HPO42- |
| ião fosfato de dihidrogénio | H2PO4- |
| ião nitrato | NO3- |
| ião sulfito | SO32- |
A regra para a construção de fórmulas para compostos iónicos contendo iões poliatómicos é a mesma que para fórmulas contendo iões monatómicos (monoátomo) iões: os encargos positivos e negativos devem equilibrar-se. Se mais de um íon poliatômico em particular for necessário para equilibrar a carga, toda a fórmula para o íon poliatômico deve ser incluída entre parênteses, e o subscrito numérico é colocado fora dos parênteses. Isto é para mostrar que o subscrito se aplica a todo o íon poliatómico. Um exemplo é Ba(NO3)2.
Exemplo \(\PageIndex{2})
Escrever a fórmula química de um composto iônico composto de cada par de íons.
- o íon potássio e o íon sulfato
- o íon cálcio e o íon nitrato
Solução
- Iões potássio têm uma carga de 1+, enquanto os iões sulfato têm uma carga de 2-. Vamos precisar de dois íons potássio para equilibrar a carga sobre o íon sulfato, então a fórmula química apropriada é K2SO4.
- Ions cálcio têm uma carga de 2+, enquanto os íons nitrato têm uma carga de 1-. Vamos precisar de dois iões de nitrato para equilibrar a carga em cada ião de cálcio. A fórmula para o nitrato deve ser incluída entre parênteses. Assim, escrevemos Ca(NO3)2 como a fórmula para este composto iônico.
Exercício \(\PageIndex{2})
Escrever a fórmula química para um composto iônico composto de cada par de íons.
- o íon de magnésio e o íon carbonato
- o íon de alumínio e o íon acetato
Reconhecimento de Compostos Iônicos
Existem duas maneiras de reconhecer compostos iônicos. Primeiro, os compostos entre elementos metálicos e não metálicos são geralmente iônicos. Por exemplo, CaBr2 contém um elemento metálico (cálcio, um metal do grupo 2A) e um elemento não metálico (bromo, um não metálico do grupo 7A). Portanto, é muito provável que seja um composto iônico. (De fato, é iônico.) Em contraste, o composto NO2 contém dois elementos que são ambos não metálicos (nitrogênio, do grupo 5A, e oxigênio, do grupo 6A). Não é um composto iônico; ele pertence à categoria de compostos covalentes discutidos em outro lugar. Note também que esta combinação de nitrogênio e oxigênio não tem carga elétrica especificada, portanto não é o íon nitrito.
Segundo, se você reconhecer a fórmula de um íon poliatômico em um composto, o composto é iônico. Por exemplo, se você ver a fórmula Ba(NO3)2, você pode reconhecer a parte “NO3” como o íon nitrato, \(\rm{NO_3^-}}). (Lembre-se que a convenção para escrever fórmulas para compostos iônicos não é para incluir a carga iônica). Esta é uma pista de que a outra parte da fórmula, Ba, é na verdade o íon Ba2+, com a carga 2+ equilibrando a carga total 2 dos dois íons de nitrato. Assim, este composto também é iônico.
Exemplo \(\PageIndex{3}\)
Identificar cada composto como iônico ou não iônico.
- Na2O
- PCl3
- NH4Cl
- OF2
Solução
- O sódio é um metal, e o oxigénio é um não-metálico; portanto, espera-se que Na2O seja iónico.
- Só fósforo e cloro são não-metálicos. Portanto, PCl3 não é iônico.
- O NH4 na fórmula representa o íon amônio, NH4+, o que indica que este composto é iônico.
- O oxigênio e o flúor são não-metálicos. Portanto, OF2 não é iônico.
Exercício \(\PageIndex{3})
Identificar cada composto como iônico ou não iônico.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Visitar mais de perto: Sangue e água do mar
A ciência há muito que reconhece que o sangue e a água do mar têm composições semelhantes. Afinal, ambos os líquidos têm compostos iônicos dissolvidos neles. A semelhança pode ser mais do que mera coincidência; muitos cientistas pensam que as primeiras formas de vida na Terra surgiram nos oceanos. Um olhar mais atento, contudo, mostra que o sangue e a água do mar são bastante diferentes. Uma solução de 0,9% de cloreto de sódio aproxima-se da concentração de sal encontrada no sangue. Em contraste, a água do mar é principalmente uma solução de 3% de cloreto de sódio, mais de três vezes a concentração no sangue. Aqui está uma comparação das quantidades de íons no sangue e na água do mar:
| Ion | Percentagem na água do mar | Percentagem no sangue |
|---|---|---|
| Na+ | 2.36 | 0,322 |
| Cl- | 1,94 | 0,366 |
| Mg2+ | 0,13 | 0,002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0,0096 |
| HCO3- | 0,002 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
Os iões são mais abundantes em água do mar do que em sangue, com algumas excepções importantes. Há muito mais iões de carbonato de hidrogénio (HCO3-) no sangue do que na água do mar. Esta diferença é significativa porque o íon carbonato de hidrogênio e alguns íons relacionados têm um papel crucial no controle das propriedades ácido-base do sangue. A quantidade de íons fosfato de hidrogênio – HPO42- e H2PO4- na água do mar é muito baixa, mas eles estão presentes em maiores quantidades no sangue, onde também afetam as propriedades ácido-base. Outra diferença notável é que o sangue não possui quantidades significativas do íon sulfato (SO42-), mas este íon está presente na água do mar.
Key Takeaways
- Proper fórmulas químicas para compostos iônicos equilibram a carga total positiva com a carga total negativa.
- Grupos de átomos com carga total, chamados íons poliatômicos, também existem.
Contribuintes e Atribuições
-
Anônimo
