I medici sono stati a lungo frustrati dal ruolo sproporzionato che la pressione intraoculare (IOP) gioca nella cura del glaucoma. Essendo l’unico fattore suscettibile di intervento medico o chirurgico, il suo ruolo è vitale. Eppure la tonometria è intrinsecamente limitata: Una singola lettura presa ogni pochi mesi non riesce a rappresentare il flusso e riflusso diurno della IOP. Anche portare i pazienti per più letture tonometriche non fornisce un senso ideale delle caratteristiche della IOP del paziente.

|
|
| Questo sensore microfluidico impiantabile per il monitoraggio della IOP 24 ore è attualmente in sviluppo presso la Stanford University. Foto: Ishmail E. Araci |
Gli esperti credono che alla fine si potrà dotare i pazienti di un minuscolo sensore alloggiato su una lente a contatto o un paio di occhiali, o mandarli da un oftalmologo per farsene impiantare uno nell’occhio. Misurerebbe continuamente la IOP, aumentando esponenzialmente la quantità e, si spera, il valore dei dati che si ricevono. Se l’approccio attuale alla documentazione della IOP è come prendere un’istantanea, il monitoraggio continuo della IOP di 24 ore è più simile alla cattura di un video che registra il cambiamento nel tempo piuttosto che dare solo una lettura statica.
Questi gadget sono ancora in fase di sviluppo. Sono pronti per la prima serata? Diamo un’occhiata a come fluttua la IOP, alle sfide cliniche che crea e alle attuali tecnologie all’avanguardia che tentano di tracciare meglio la IOP per consentire una maggiore comprensione clinica.
Un obiettivo in movimento
Impostare un piano di trattamento basato sul raggiungimento di un obiettivo IOP è difficile quando l’obiettivo stesso è in movimento. La IOP fluttua nel corso della giornata, ora dopo ora, minuto dopo minuto, persino secondo dopo secondo, sulla base di una varietà di fattori endogeni ed esogeni.
Nel sistema oculare, la IOP può dipendere dall’equilibrio della produzione di umore acqueo, dalla facilità di deflusso (quanto facilmente l’umore acqueo lascia l’occhio), dalla pressione venosa episclerale (la pressione nelle vene sulla superficie dell’occhio) e dal deflusso uveosclerale (una via secondaria per l’umore acqueo per lasciare l’occhio).
Per esempio, un aumento della facilità di deflusso o una diminuzione della produzione di umore acqueo abbasserebbe la IOP, dice Arthur J. Sit, MD, un ricercatore di glaucoma alla Mayo Clinic di Rochester, Minn. I salti a breve termine della IOP possono anche verificarsi a causa della pressione sull’occhio dall’ammiccamento o dallo sfregamento dell’occhio o anche durante il movimento degli occhi o le pulsazioni della pressione sanguigna.
La pressione intraoculare fluttua anche a causa della posizione del corpo, dell’ora del giorno (picchi di notte, cali durante il giorno), della pressione sanguigna e del relativo concetto di pressione di perfusione oculare (OPP), dei livelli di stress o dolore, del consumo di acqua e caffeina.
Inoltre, l’attività vigorosa e lo stress possono far salire la pressione sanguigna, la IOP e la OPP, dice Kaweh Mansouri, MD, MPH, un oftalmologo dell’Università di Ginevra e dell’Università del Colorado Denver. La misurazione della pressione sanguigna insieme alla IOP ha valore per determinare come la pressione sanguigna influenza la IOP, dice il dottor Mansouri. I ricercatori stanno attualmente utilizzando dispositivi di monitoraggio della IOP di 24 ore per esplorare questi effetti sulla progressione del glaucoma.
|
Dos and Don’ts of IOP Measurement Non diagnosticate o trattate dopo una sola misurazione. Il Dr. Sowka consiglia agli optometristi di non iniziare immediatamente il trattamento a meno che la pressione non sia eccessivamente alta o i nervi ottici siano già gravemente danneggiati e vulnerabili; invece, misurate la pressione più volte. È anche una buona idea ottenere diverse letture della pressione dopo aver iniziato la terapia per determinare se il farmaco sta funzionando, dice il dottor Sowka. Una lettura della IOP dopo l’inizio di un farmaco non è davvero sufficiente per giudicare la vera efficacia. Dire ai pazienti di rilassarsi. Come detto prima, i pazienti possono sforzarsi o trattenere il respiro durante la tonometria. Dite loro regolarmente di rilassarsi e respirare normalmente durante il processo, esorta il dottor Mansouri. Non abbandonare il sospetto. Se le misurazioni della IOP del paziente non sembrano corrispondere alle vostre valutazioni del campo visivo e del nervo ottico, potrebbe esserci più di quanto abbiate capito, dice il dottor Hartwick. Fateli tornare e misurate la loro IOP in un momento diverso della giornata, aggiunge. Si consideri una curva diurna in pazienti selezionati. Registrare una curva diurna tonometrica è poco pratico e noioso per la maggior parte dei pazienti. Ma se il livello di IOP e l’entità del danno sembrano incongrui – per esempio, quando si sospetta un glaucoma a tensione normale – considerate la possibilità, dice il dottor Davey. Se il paziente è d’accordo, portatelo qui la mattina presto e registrate la IOP ogni ora per otto o dieci ore. “Questo vi dà la curva diurna dell’ufficio, che potrebbe non essere completamente rappresentativa dei valori giorno/notte, ma almeno vi dà più di una misurazione”, dice. |
Ecco come queste variabili influenzano la IOP:
– Posizione del corpo. A seconda della posizione del paziente sulla sedia, la pressione può aumentare o diminuire. Per esempio, la IOP è più bassa quando il paziente è seduto in posizione neutra. “Quasi qualsiasi altra cosa provoca un aumento della IOP, tra cui piegare il collo in avanti, piegare la testa all’indietro, girare la testa di lato, sdraiarsi, piegarsi, sbattere le palpebre o strofinarsi gli occhi”, dice il dottor Sit.
– Il consumo di acqua. Bere un grande volume d’acqua fa aumentare il volume del sangue del paziente per un breve periodo. Anche la pressione venosa sale quando il paziente consuma più acqua. “Tutto quello che devono fare è consumare da 16 a 32 once, che è una o due bottigliette d’acqua, ed entro cinque minuti la pressione sarà aumentata di 6 mm Hg”, dice Pinakin Gunvant Davey, PhD, OD, professore ed esperto di glaucoma presso il College of Optometry della Western University of Health Sciences di Pomona, California.
– Ora del giorno. La letteratura ha dimostrato che il picco di IOP si verifica di notte in due terzi dei pazienti. La ragione: l’acquoso è sotto-secretato di notte, dice Joseph Sowka, OD, professore di optometria alla Nova Southeastern University College of Optometry a Ft. Lauderdale, Fla.
Per esempio, il dottor Mansouri ha osservato i pazienti per 24 ore in laboratori del sonno e ha trovato le IOP più alte di notte. Anche se i vostri pazienti non saranno sottoposti a studi del sonno, potrebbero venire nel vostro ufficio di sera – in tal caso, aspettatevi di vedere IOP elevate rispetto ad altri momenti della giornata.
– Pressione sanguigna. La IOP di base si basa sul ciclo cardiaco e sulla pressione sanguigna sistolica e diastolica. La forza usata per portare il sangue nell’occhio è la pressione di perfusione oculare, spiega James L. Fanelli, OD, del Cape Fear Eye Institute di Wilmington, NC.
Se la pressione sanguigna è bassa, c’è meno forza per “spingere” il sangue nell’occhio, e quindi, meno pressione di perfusione all’occhio. I fattori che causano l’innalzamento della IOP avranno un effetto sull’abbassamento della pressione di perfusione, e i fattori che abbassano la pressione sanguigna avranno anche come risultato una pressione di perfusione più bassa – o una combinazione di uno di questi fattori può giocare un ruolo, dice il dottor Fanelli. La pressione sanguigna tende a ridursi durante le ore di sonno al mattino presto, che è anche il momento della giornata in cui la IOP tende ad essere più alta.1 Questi due fattori opposti possono avere un effetto duplice nel ridurre l’OPP durante le ore notturne, il che può consentire un maggiore danno alla testa del nervo oculare.
– Stress. Un aumento o una diminuzione dello stress provoca cambiamenti ormonali che spingono i livelli di IOP su o giù. Uno dei pazienti del Dr. Mansouri – studiato utilizzando un sensore di monitoraggio dell’IOP di 24 ore su una lente a contatto – aveva picchi di pressione ogni volta che il suo cane aveva attacchi epilettici di notte.
– “Nervi” generali. È possibile che, in alcuni pazienti, lo stress dell’esame oculistico stesso – per esempio, se sono preoccupati di essere diagnosticati con il glaucoma – può causare la loro IOP a salire, dice Andrew Hartwick, OD, PhD, professore associato presso Ohio State University College of Optometry in Columbus. Ad esempio, possono stringere gli occhi perché sono stressati per l’esame, e le letture IOP spike.
– Anche il dolore causa impennate della IOP perché provoca stress. Una paziente del dottor Mansouri ha battuto la gamba in un parcheggio. C’è stato un picco nel suo livello di IOP nel momento esatto in cui ha ricordato l’incidente, secondo i dati di monitoraggio delle 24 ore.
Conseguenze delle letture imprecise della IOP
Gli studi hanno indicato che i picchi della IOP potrebbero contribuire alla progressione del glaucoma.2,3 Ma se si esamina un paziente quando la IOP è al minimo o al massimo, è possibile sopravvalutare o sottovalutare la diagnosi di glaucoma o il trattamento necessario per il paziente.
“Se prendiamo un paziente in un trogolo, dove la IOP è più bassa, ci può portare lontano da una considerazione del glaucoma”, soprattutto se la lettura rientra in un intervallo statisticamente normale, dice il dottor Sowka. “
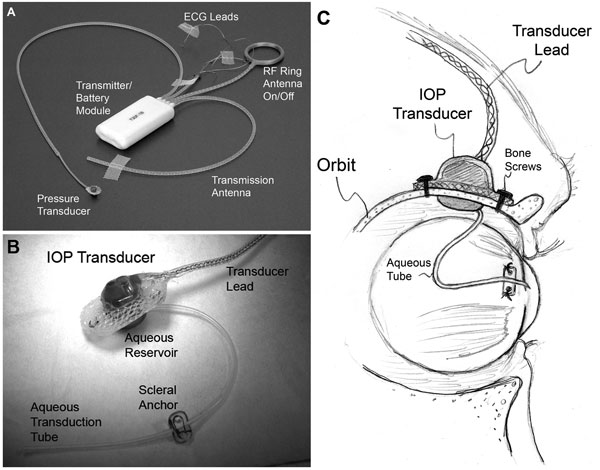
|
|
| (A) Un tipico impianto totale T30F (Konigsberg Instruments). (B) La superficie extraorbitale dell’alloggiamento del trasduttore IOP personalizzato. (C) Un tubo di silicone da 23 gauge trasporta l’acquoso dalla camera anteriore a un serbatoio di fluido sul lato intraorbitario del trasduttore (parzialmente nascosto alla vista in B); Il tubo (con un adeguato allentamento per consentire il movimento dell’occhio) è stato tagliato e inserito nella camera anteriore. |
Registrare un intervallo di IOP permetterebbe potenzialmente di migliorare la diagnosi e la gestione del glaucoma. “Se i ricercatori potessero dimostrare che specifici modelli di IOP di 24 ore sono legati alla progressione del glaucoma, allora c’è la speranza che il rilevamento di questi modelli potrebbe aiutare a identificare i pazienti a maggior rischio di progressione e permetterci di adattare il loro trattamento di conseguenza”, dice il dottor Mansouri.
Il glaucoma potrebbe essere identificato prima, consentendo la chirurgia o i farmaci per iniziare più rapidamente, aggiunge. Gli oculisti potrebbero anche determinare se i farmaci che abbassano la IOP sono efficaci di notte o durante attività specifiche che aumentano la IOP.
Stabilire un vero intervallo di IOP richiederebbe un monitoraggio continuo della IOP di 24 ore. Si tratta di una sfida, perché una singola misurazione della IOP raccolta durante il normale orario di lavoro non cattura l’intervallo della IOP di un paziente, i suoi picchi o i cambiamenti durante il giorno.4
Oggi, determinare l’intervallo della IOP è possibile utilizzando la tonometria ad applanazione Goldman (GAT) attraverso una curva di tensione diurna (DTC), dove le letture della IOP vengono acquisite in diversi momenti durante le ore di ambulatorio. Ma questo è problematico sia per il professionista che per il paziente. Le curve notturne non vengono registrate e meno dell’1% dei pazienti si sottopone alla DTC o al monitoraggio della PIO in un laboratorio del sonno.4
Infatti, i ricercatori hanno misurato la PIO per 24 ore e hanno documentato non solo che la PIO ha un picco notturno, ma che la fluttuazione della PIO è molto maggiore durante le ore non lavorative.5 In uno studio su 35 pazienti la cui PIO è stata registrata con uno pneumatonometro in un laboratorio del sonno per 24 ore, la maggior parte dei picchi di PIO è stata registrata di notte nei pazienti più anziani con glaucoma rispetto alle persone sane, sia seduti che sdraiati.6
Più recentemente, gli investigatori che utilizzano il monitoraggio di 24 ore hanno appreso che la IOP media non solo aumenta di notte, ma è effettivamente in costante aumento – e più durante il giorno che di notte.7 I ricercatori del Devers Eye Institute di Portland, Oreo, hanno utilizzato un sistema di telemetria impiantato negli occhi delle scimmie per registrare 500 misurazioni di IOP al secondo.
Hanno scoperto che la IOP fluttua molto più di quanto si credesse in precedenza. “Gli ammiccamenti e i movimenti oculari generano grandi picchi di IOP che si verificano circa 12.000 volte all’ora e costituiscono circa il 12% dell’energia totale IOP che l’occhio deve assorbire durante le ore di veglia”, hanno scoperto i ricercatori. Essi ritengono che questi dati nelle scimmie saranno circa gli stessi negli esseri umani. “La IOP deve ora essere vista come dinamica e in continua evoluzione, e le fluttuazioni della IOP possono rivelarsi un importante contributo al glaucoma. “8
Hanno anche scoperto che il ciclo diurno non si ripete di giorno in giorno. Da qui la necessità di un monitoraggio continuo dell’IOP. Gli attuali prototipi includono sensori impiantati e dispositivi basati su lenti a contatto.
Intelligent Implantables
Diverse aziende start-up hanno sviluppato sensori di pressione telemetrici che possono essere impiantati durante la chirurgia della cataratta o del glaucoma. “Telemetrico significa che le letture della pressione sono catturate a distanza (cioè, dall’interno dell’occhio) e trasmesse senza fili a un lettore esterno”, dice il dottor Sit.
I dispositivi impiantabili attualmente allo studio includono:

|
|
|
Il Pro-IOP Sensor è un dispositivo telemetrico che viene impiantato come una IOL. Foto: Implandata Ophthalmic Products GmbH |
– Pro-IOP. La tedesca Implandata Ophthalmic Products sta lavorando al Pro-IOP, un trasduttore di pressione intraoculare senza fili (WIT) che è alimentato telemetricamente da un dispositivo portatile. Assomigliando a un minuscolo anello di plastica, il WIT misura 11,3 mm di diametro.9 Incorpora sensori di pressione, un sensore di temperatura, un codificatore di identificazione, un codificatore analogico-digitale e un’unità di telemetria in un unico sistema microelettromeccanico.9
Un chip RFID con un’antenna integrata trasmette le letture della IOP di 24 ore a un lettore portatile esterno. Il paziente e il medico potrebbero anche avere la possibilità di ricevere i dati tramite un’applicazione per smartphone. Il paziente potrebbe anche comunicare con il medico sulle letture della IOP sull’app.
Il dispositivo non ha ancora ricevuto il marchio CE in Europa o l’approvazione della FDA negli Stati Uniti, ma i ricercatori in Germania hanno recentemente inserito il Pro-IOP nel primo soggetto umano, una donna di 60 anni; nessun dato è stato ancora pubblicato.9
– AcuMEMs. Un impiantabile in sviluppo da una società americana con lo stesso nome, AcuMEMs funziona in modo simile al Pro-IOP. Il sensore è un sensore di pressione capacitivo che cambia forma con le fluttuazioni della IOP. “Quando cambia forma, la capacità elettrica è alterata e questo può essere rilevato esternamente con il lettore”, dice il dottor Sit.
Il sensore può essere impiantato nella camera anteriore come procedura indipendente o come parte della chirurgia del glaucoma; può anche essere inserito nel sacco capsulare durante la chirurgia della cataratta.
– Impianto IOL microfluidico. I ricercatori della Stanford University e della Bar-Ilan University in Israele stanno sviluppando congiuntamente un sensore microfluidico impiantabile. La IOP verrebbe misurata “sulla base di un’interfaccia di pressione di equilibrio stabilita tra un liquido intraoculare e un gas” contenuta nelle camere del sensore, secondo il brevetto del dispositivo. Pazienti e medici potrebbero usare i loro smartphone o un lettore esterno per controllare la loro IOP.10 Gli inventori sono in attesa di approvazione del brevetto per il sensore.
Il segnale trasmesso dai dispositivi impiantati nell’occhio può essere più preciso di quelli attaccati alle lenti a contatto, in teoria, dice il dottor Davey. La forza del segnale dipende da quanta energia il dispositivo emette. “Abbiamo impiantato entrambi i dispositivi (Pro-IOP e AcuMEMs) e non funzionavano così bene”, dice il dottor Davey.
Entrambi i lettori Pro-IOP e AcuMEMs potrebbero potenzialmente essere attaccati a un paio di occhiali, e i dati sarebbero raccolti allo stesso modo, dice il dottor Sit.
Lenti a contatto intelligenti
I ricercatori hanno studiato per la prima volta i sensori per lenti a contatto negli anni ’70, ma le lenti a contatto dure disponibili erano troppo scomode e cambiavano l’integrità strutturale dell’occhio del paziente, secondo il dottor Davey.
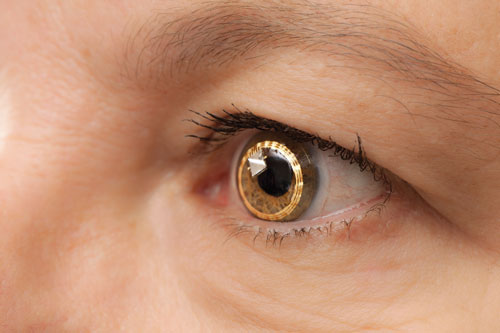
|
|
| Il Sensimed Triggerfish sull’occhio. È ancora in fase di sperimentazione clinica negli Stati Uniti. |
I sensori non erano abbastanza sensibili. “La persona con un occhio più ‘morbido’ aveva letture più accurate di una persona con un occhio più rigido”, dice il dottor Davey. “La tecnologia non era abbastanza buona per ottenere valori di IOP”. Una cornea più spessa risponde meno prontamente ai cambiamenti della IOP, rendendo la tonometria (e i sensori per lenti a contatto) meno accurati.
I sensori IOP basati su lenti a contatto includono:
– Il Triggerfish (Sensimed). All’Università di Ginevra in Svizzera, gli oftalmologi hanno condotto le prime indagini su una lente a contatto denominata Triggerfish, guidata dal Dr. Mansouri e altri.
La Triggerfish è una lente a contatto morbida idrofila dotata di un sensore per lenti a contatto (CLS). Il CLS ha due estensimetri situati intorno al limbus che rilevano i cambiamenti nella circonferenza oculare. “Questi cambiamenti nella circonferenza oculare sono ritenuti correlati ai cambiamenti della IOP e del volume intraoculare, e questo è stato dimostrato in occhi enucleati”, dice il dottor Mansouri. Il dispositivo misura una miscela di IOP, volume intraoculare e cambiamenti di proprietà biomeccaniche (una combinazione di isteresi e rigidità corneale e sclerale) che sono correlati alle fluttuazioni della IOP. Un lettore esterno cattura i dati su un periodo di 24 ore.
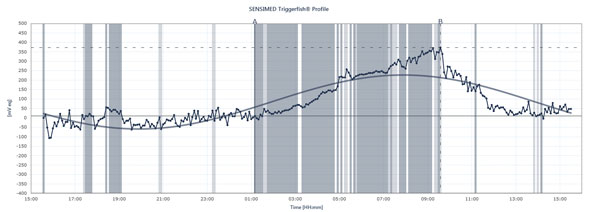
Il diagramma di flusso mostra i picchi e le depressioni della IOP in un paziente che indossa il Sensimed Triggerfish su un periodo di 24 ore.
Il Triggerfish è approvato dal marchio CE in Europa. L’approvazione della FDA non è stata raggiunta negli Stati Uniti e il dispositivo è ancora in fase di sperimentazione clinica.
|
Triggerfish traccia la IOP in modo diverso I dati visualizzati sul lettore esterno sono una combinazione di pressione intraoculare, volume intraoculare e proprietà biomeccaniche dell’occhio, spiega il dottor Mansouri. “È utile per dare un’idea dei cambiamenti qualitativi su 24 ore più che i cambiamenti quantitativi perché non possiamo tradurli in millimetri di mercurio”, dice. Il Triggerfish fornisce comunque informazioni preziose. Gli studi futuri che utilizzano il dispositivo potrebbero aiutare a spiegare quanto instabile o stabile sia stata la pressione nelle 24 ore, quando si verificano i picchi notturni della IOP, come l’introduzione del trattamento o i cambiamenti di trattamento influenzano i modelli di IOP nelle 24 ore e come attività specifiche influenzano i modelli di IOP nelle 24 ore, come le posizioni di yoga, l’assunzione di caffeina, situazioni di stress e altre cause di picchi di IOP descritte sopra. Il dottor Mansouri fa anche sottoporre i pazienti con glaucoma normale o a bassa tensione al monitoraggio simultaneo della pressione sanguigna e della IOP nelle 24 ore, poiché i picchi possono influenzare l’OPP. Ma il Triggerfish mostrerà una correlazione tra i modelli di IOP delle 24 ore e la progressione del glaucoma? Molti studi sono in corso per rispondere a questa domanda essenziale.
|
– Lente a contatto con sensore a circuito di risonanza. Un altro dispositivo CLS intelligente in sviluppo è un circuito di risonanza fatto di un condensatore a film sottile combinato con una bobina di rilevamento che rileva la deformazione della curvatura corneale. È nelle prime fasi di sviluppo sotto David C.C. Lam presso il Dipartimento di Ingegneria Meccanica e Aerospaziale dell’Università di Scienza e Tecnologia di Hong Kong.
In uno studio del settembre 2014, il CLS è stato testato su un modello di occhio in gomma siliconica. Il sensore è stato trovato per tracciare accuratamente la fluttuazione della IOP.11
Come la misurazione dei livelli di glucosio una volta al giorno per i pazienti con diabete o la pressione sanguigna una volta al giorno per i pazienti con malattie cardiache, la dipendenza da una misurazione della IOP potrebbe portare a dati errati della IOP. Ma forse in un futuro non troppo lontano, dispositivi usciti da un film di fantascienza – lenti a contatto e sensori impiantabili – potrebbero permettervi di monitorare la IOP con maggiore comprensione e meno problemi per voi e i vostri pazienti.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Valutazione di laboratorio della pressione diurna e notturna di perfusione oculare nell’uomo. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Associazione tra picchi di pressione intraoculare e progressione della perdita del campo visivo. Oftalmologia. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. È necessario il monitoraggio della pressione intraoculare 24 ore nel glaucoma? Semin Opthalmol. Maggio 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilità clinica del monitoraggio della pressione intraoculare al di fuori del normale orario di ufficio nei pazienti con glaucoma. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Correlazione tra picchi di pressione intraoculare notturna in soggetti sani e pazienti con glaucoma. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. telemetria IOP 24 ore nel primate non umano: prestazioni del sistema di impianto e caratterizzazione iniziale di IOP a più scale temporali. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Tendenze emergenti e argomenti caldi. Presentato lunedì 5 maggio 2014 alla riunione annuale dell’ARVO. Disponibile su: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Accessed Nov 19, 2014.
9. Melki S, Todani A, Cherfan G. Un trasduttore di pressione intraoculare impiantabile risultati iniziali di sicurezza. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Dispositivo microfluidico impiantabile per il monitoraggio della pressione intraoculare. Disponibile all’indirizzo: www.google.com/patents/WO2014137840A1?cl=en. Accesso 17 ottobre 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Sensore morbido indossabile con lenti a contatto per il monitoraggio continuo della pressione intraoculare. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. Ritmo della pressione intraoculare di 24 ore in giovani soggetti sani valutati con monitoraggio continuo utilizzando un sensore di lenti a contatto. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
