RIASSUNTO
Significato di anemia nelle diverse fasi della vita
Guzmán Llanos, María José*; Guzmán Zamudio, José L.** y LLanos de los Reyes-García, M.J.***
*Infermiere pediatrico Hospital SAS de Jerez de la Frontera (Cádiz). E-mail: [email protected]
**Phatologist.
***Infermiere Day Hospital di Ematologia-Oncologia Hospital del SAS de Jerez de la Frontera (Cádiz)
SUMMARIO
Astratto: L’anemia ha un’alta prevalenza nelle cure primarie e nelle consultazioni pediatriche, e l’ADH rappresenta il 50% di tutti i casi di anemia.
Metodologia: Revisione della letteratura e analisi documentaria descrittiva sull’eziopatogenesi dell’anemia da carenza di ferro, i test diagnostici di base per lo studio dell’ADH e il suo significato, utilizzando un arco temporale specifico nella ricerca documentaria e criteri di inclusione secondo le dimensioni analizzate nello studio: Nozioni sul metabolismo del ferro. Nozioni sull’ematopoiesi. Diagnosi di laboratorio e classificazione delle anemie. Clinica dell’anemia da carenza di ferro. Cause di carenza di ferro.
Risultati e conclusioni: Lo studio documentario realizzato mostra l’esistenza di pubblicazioni con contenuti sull’eziopatogenesi dell’anemia da carenza di ferro, i test diagnostici di base per lo studio dell’ADH e il loro significato, dimostrando l’importanza di questi contenuti per il professionista infermieristico nel settore delle cure primarie e della pediatria.
Palabras clave: anemia por deficiencia de hierro; anemia en la gestación, anemia en el anciano.
ABSTRACT
Overview: L’anemia è molto comune nelle consultazioni di assistenza primaria e pediatria, e IDA è la causa di 50% di tutti i casi di anemia.
Metodologia: Revisione della letteratura e analisi descrittiva documentaria della patogenesi dell’anemia da carenza di ferro, i test diagnostici di base per studiare l’IDA e il significato di tale utilizzando un periodo di tempo specifico nella ricerca documentaria e criteri di inclusione che tiene conto dei fattori che vengono analizzati nello studio: Idee sul metabolismo del ferro. Idee su ematopoiesi. Diagnosi di laboratorio e la classificazione di anemia. Caratteristiche cliniche di anemia da carenza di ferro. Cause di carenza di ferro.
Risultati e conclusioni: Lo studio documentario a tappe copre le pubblicazioni sulla patogenesi dell’anemia da carenza di ferro, i test diagnostici di base per studiare l’IDA e il significato di tali, e mostra quanto siano importanti questi dati per l’infermieristica professionale nell’area delle cure primarie e della pediatria, per identificarla e agire di conseguenza.
Parole chiave: Anemia da carenza di ferro; anemia in gravidanza; anemia negli anziani.
Introduzione
L’OMS definisce l’anemia come la discesa del livello di emoglobina di due desviazioni estándar por debajo de lo normal para la edad y el sexo(1). In termini pratici possiamo adottare le cifre di 13 gr/dl nell’uomo, 12 gr/dl nelle donne e 11 nell’embarazada. Nei bambini da 6 mesi a 6 anni 11/gr/dl e da 6 anni a 14 anni 12 gr/dl. Questi criteri sono basati su studi basati sulla popolazione che non includono persone oltre i 65 anni di età e possono non essere applicabili agli anziani.
L’anemia è altamente prevalente nelle consultazioni di assistenza primaria, in pediatria e nel monitoraggio della gravidanza. La carenza di ferro (IDA) non è la stessa cosa dell’anemia da carenza di ferro (IDA). L’IDA è la causa più comune di anemia in tutto il mondo e rappresenta un grave problema sanitario soprattutto nei paesi sottosviluppati. L’ADH è molto diffusa, tanto che fino al 5% dei bambini e degli adolescenti, il 10% delle donne in pre-menopausa e l’1% degli uomini hanno un’anemia da carenza di ferro; e può arrivare fino al 40% degli anziani in assistenza domiciliare.
La maggior parte dei servizi sanitari hanno linee guida cliniche per la gestione dell’anemia in generale e/o dell’anemia gestazionale (2,3)
L’anemia gestazionale è considerata un fattore di rischio per la gravidanza e può causare anemia nel periodo neonatale a causa delle basse riserve di ferro. (4)
Anaemia nell’infanzia: l’ADH colpisce la crescita e lo sviluppo dei bambini, diminuisce la resistenza alle infezioni e compromette lo sviluppo cognitivo e psicomotorio.(5,6)
Secondo il rapporto dell’OMS del 1993-2005 la prevalenza dell’IDA nei bambini in età prescolare può rappresentare il 47,4% e per la stessa agenzia la presenza di più del 40% rappresenta un grave problema di salute. (7).
Nell’ADH nelle donne in postmenopausa, negli adulti e negli anziani, la perdita digestiva deve sempre essere esclusa.
Obiettivo
Lo scopo di questo lavoro è quello di identificare l’eziopatogenesi dell’anemia da carenza di ferro, i test diagnostici di base per lo studio dell’ADH e il loro significato, attraverso una revisione della letteratura, e di riconoscere precocemente le diverse fasi della carenza di ferro nelle consultazioni delle cure primarie, pediatriche e di gravidanza, come azione preventiva e opportunità di miglioramento in tutte le attività infermieristiche in questi processi.
Metodologia
Rassegna bibliografica della letteratura pubblicata sull’eziopatogenesi dell’anemia da carenza di ferro e dei test diagnostici per lo studio dell’ADH e del suo significato. Studio documentario descrittivo a partire da diverse fonti bibliografiche e banche dati sull’argomento oggetto di studio.
L’arco temporale utilizzato nella ricerca bibliografica si è concentrato sugli anni 2000-2014, oltre a qualche altra bibliografia di carattere referenziale sull’argomento analizzato, al di fuori di questo arco temporale.
I criteri di inclusione nella ricerca bibliografica si basano sugli articoli e la documentazione pubblicata sull’argomento, entro il periodo di tempo selezionato, essendo raffinati secondo il loro contenuto e le dimensioni da analizzare (Nozioni sul metabolismo del ferro. Nozioni sull’ematopoiesi. Diagnosi di laboratorio e classificazione delle anemie. Clinica dell’anemia da carenza di ferro. Cause di carenza di ferro).
I seguenti descrittori o parole chiave sono stati utilizzati come parole chiave di ricerca: anemia da carenza di ferro nell’infanzia (4368 articoli), anemia da carenza di ferro in gravidanza (fino a 2173 articoli) e negli anziani (4605) e una selezione è stata fatta da questi, secondo i criteri di inclusione della revisione effettuata.
Risultati
1.-Informazioni sul metabolismo del ferro
Il ferro è importante perché fa parte dell’emoglobina e dei citocromi. Dopo la crescita, il ferro del corpo rimane fisso in un intervallo molto stretto. Il ferro del corpo è ciclato e riciclato attraverso varie piscine. (8,9)
– Assorbimento: Il ferro che assumiamo con il cibo deve essere assorbito, poi trasportato attraverso il sangue e infine immagazzinato per formare il ferro di deposito (le riserve di ferro). Il ferro che assumiamo con il cibo si presenta nella forma Fe +++ ma viene assorbito nel duodeno e nel digiuno superiore nella forma Fe ++, quindi deve subire un processo di riduzione che coinvolge l’acido ascorbico. Solo il 10% del ferro nella dieta viene assorbito, che rappresenta lo 0,25% del ferro totale del corpo. Un certo numero di fattori promuovono o ostacolano l’assorbimento del ferro.
L’assorbimento del ferro si adatta al bisogno di ferro del corpo. In caso di anemia da carenza di ferro, l’assorbimento del ferro è favorito. Il metabolismo del ferro è unico in quanto l’equilibrio del ferro è controllato principalmente dall’assorbimento piuttosto che dall’escrezione.
Ferro alimentare: il contenuto di ferro della dieta è di circa 10-30 mg/giorno per un adulto. Con l’assorbimento del 5 al 10% del ferro alimentare (0,5 a 1 mgr) la proporzione aumenta al 20% in caso di carenza di ferro e diminuisce in caso di sovraccarico di ferro.
– Trasporto: Il ferro nel sangue è legato alla sua proteina di trasporto transferrina). Il complesso ferro-transferrina è assorbito nelle cellule da un recettore specifico.
La transferrina è sintetizzata nel fegato e la sua concentrazione nel sangue supera la capacità di legame del ferro e circa due terzi della capacità di legame è insatura.
Infine, il ferro deve essere immagazzinato sotto forma di ferritina e/o emosiderina; circa 1 microgrammo/L di ferritina sierica corrisponde a 10 mg di ferro immagazzinato.
Distribuzione del ferro: il più grande pool di ferro è nei globuli rossi come ferro legato all’emoglobina ed è circa 2500 mg. Altri 40 mg fanno parte della mioglobina. Gli organi di deposito immagazzinano da 800 a 1200 mg. Solo 4 mg sono sotto forma di ferro legato alla transferrina.
Necessità di ferro e bilancio del ferro: Il fabbisogno di un adulto sano e di una donna in postmenopausa è di circa 1 mg al giorno.
Il fabbisogno sale a 5 mg per le donne in età fertile, i donatori di sangue, ecc.
Nel caso delle donne incinte il fabbisogno è di 7 mg/d.
L’eliminazione del ferro non è così ben regolata; circa 1 mg di ferro al giorno viene eliminato attraverso l’intestino, le urine e il sudore. Con le mestruazioni, si perdono 15-30 mg di ferro, che può essere compensato da un aumento dell’assorbimento, ma è più difficile da compensare in caso di menorragia; un’altra causa può essere la frequente emodonazione e, nell’infanzia, l’eccessivo esame analitico.
2.-Nota sull’ematopoiesi
La formazione degli elementi costitutivi del sangue (leucociti, globuli rossi e piastrine) avviene nel midollo osseo e il processo è chiamato ematopoiesi. Partendo da una cellula staminale pluripotente e stimolata dall’eritropoietina, questa cellula staminale dopo diverse trasformazioni porterebbe alla formazione dell’emocita maturo, un processo conosciuto come eritropoiesi (10). L’eritropoietina (EPO) è il principale fattore di crescita che regola l’eritropoiesi. Viene prodotto nel rene. Stimola la proliferazione della serie eritroide e il rilascio dei reticolociti dal midollo osseo. Circa il 20-30% delle cellule staminali si differenziano in eritropoiesi. L’emocita è una cellula anucleata la cui funzione principale, grazie all’emoglobina (Hb), è quella di trasportare l’ossigeno ai tessuti.
La sintesi dell’emoglobina avviene allo stadio di normoblasto, e quando l’emoglobina è completamente emulsionata, il nucleo viene rilasciato e dà origine al reticolocita.
Per mantenere un’ematopoiesi normale, sono necessari un adeguato apporto di ferro e un’adeguata concentrazione di vitamina B-12 e acido folico.
L’HB consiste di una parte proteica (globina) e del gruppo eme (che porta l’atomo di ferro ferroso).
Quando i globuli rossi invecchiano, vengono fagocitati dalle cellule del sistema fagocitico mononucleare. Questo avviene a circa 120 giorni e circa lo 0,8% del pool di globuli rossi viene utilizzato e si mantiene un equilibrio tra ciò che si forma e ciò che viene distrutto.
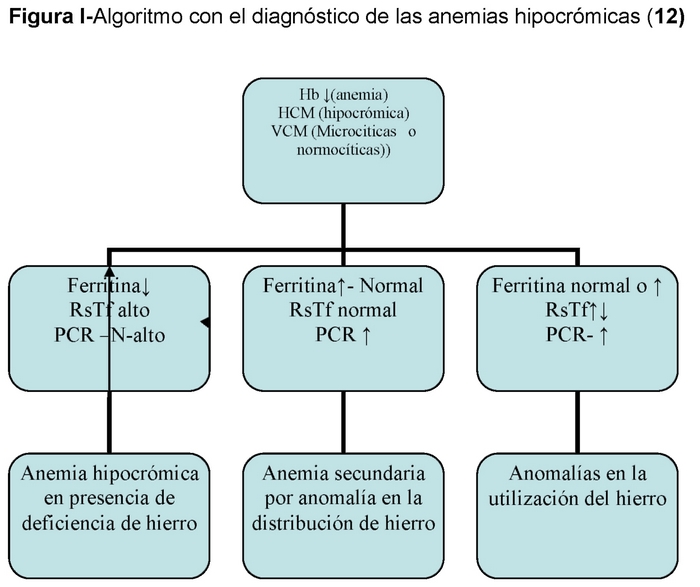
3.- Diagnosi di laboratorio e classificazione delle anemie
3.1. Prima di tutto dobbiamo confermare che il paziente ha un’anemia e poi che questa è dovuta alla carenza di ferro e per fare questo richiederemo:
– L’emogramma è il test più basilare, ci fornisce molte informazioni in quanto ci fornisce il numero di globuli rossi, il valore di emoglobina e gli indici corpuscolari VCM, HCM. Oltre al numero di leucociti e piastrine. E tutto questo è utile per classificare l’anemia. L’anemia da carenza di ferro è spesso accompagnata da trombocitosi reattiva.
– Parametri relativi al metabolismo del ferro: sideremia, transferrina, indice di saturazione della transferrina e recettore solubile della transferrina (RsTf)
– Valutazione dei depositi: ferritina serica.
– Esame dello striscio di sangue: rivela il contenuto di emoglobina (ipocromia), alterazioni di forma (poikilocitosi) e di dimensioni (anisocitosi) che ci guidano nella diagnosi corretta.
Significato clinico delle diverse proteine coinvolte nel trasporto e nella deposizione del ferro.
Ferritina: è la più importante proteina di deposito del ferro. Concentrazioni elevate si trovano nel fegato, nella milza e nel midollo osseo. Contiene il 15-20% del ferro del corpo.
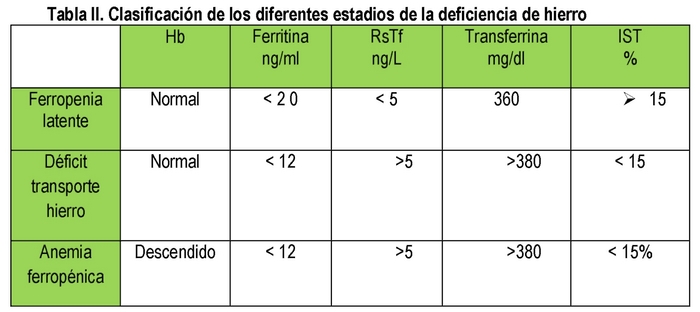
Una piccola quantità di ferritina prodotta viene secreta dalle cellule e passa nel sangue. Esiste una correlazione diretta tra la quantità di questa proteina e il ferro immagazzinato, per cui: 1 mcg/L di ferritina sierica corrisponde a 10 mgr di ferro immagazzinato. La ferritina sierica è un buon indicatore delle riserve di ferro. (11) Tuttavia, bisogna anche tener presente che la ferritina è un reattivo di fase acuta, quindi a volte la proteina c-reattiva (CRP) dovrebbe essere richiesta anche per escludere la presenza di un processo infettivo/infiammatorio. La ferritina è quindi molto utile per la valutazione del metabolismo del ferro. Valori < di 12 ng/ml definiscono una carenza di ferro latente. Una ferritina elevata >di 400 ng/ml può indicare la presenza di un sovraccarico di ferro.
Transferrina, saturazione della transferrina: La transferrina è una proteina sintetizzata nel fegato e dal 15 al 45% è satura di ferro. Se l’apporto funzionale di ferro è inadeguato, la sintesi di questa proteina sarà aumentata; valori elevati si trovano nella carenza di ferro e nella gravidanza.
Recettore solubile della transferrina (RsTf): circa il 75% dei recettori della transferrina si trova nei precursori dell’eritropoiesi. Il numero di recettori della transferrina aumenta quando l’apporto funzionale di ferro è scarso. La forma solubile è conosciuta come (RsTf). Questo è l’unico marcatore biologico
che indica un inadeguato apporto di ferro all’eritropoiesi. Ha quindi un valore complementare alla ferritina. La RsTf non è influenzata dai reagenti della fase acuta, per cui indica la carenza di ferro in presenza di infezioni, infiammazioni e/o tumori.(12)
3.2- Classificazione delle anemie
Un modo pratico per classificare le anemie è la dimensione dei globuli rossi (MCV) e il contenuto di emoglobina (HBC). Questi due parametri sono forniti dalla lettura di qualsiasi emogramma dei moderni contacellule.
– Secondo la taglia si parla di anemie normocitiche, microcitiche e macrocitiche e secondo il contenuto di Hb (MCH) si parla di anemie normocromiche, ipocromiche e ipercromiche13 (Tabella I)
– Secondo la taglia si parla di anemie normocitiche, microcitiche e macrocitiche. (Tabella I).

Nel caso delle anemie da carenza di ferro sono solitamente microcitiche e ipocromiche.
Abbreviazioni:
– DH: carenza di ferro
– ADH: anemia da carenza di ferro
– Hb: emoglobina
– MCV: volume corpuscolare medio
– HVM: emoglobina corpuscolare media
– RsTf: recettore solubile della transferrina
– CRP: proteina C-reattiva
– Secondo la gravità clinica:
– Anemia grave: Hb < 7.0 gr/dl
– Anemia moderata 7.1 -10.0 gr/dl
– Anemia lieve 10.1 – 10.9 gr/dl
ADH è lo stadio finale di un processo che inizia con una carenza di ferro latente in cui non c’è anemia ma carenza di ferritina, seguita da una carenza di trasporto del ferro in cui oltre alla ferritina bassa c’è un TSI inferiore al 15% e infine ADH con ferritina bassa, TSI < 15% e anemia. (Tabella II)
– Altre anemie con anormalità di distribuzione del ferro: 14,15
Anaemia da malattia cronica (ACD): In questi casi c’è una ridistribuzione del ferro con un aumento del ferro di deposito e una relativa carenza di ferro delle cellule eritropoietiche come conseguenza della ridotta sintesi di transferrina. Questa ridotta disponibilità di ferro avrebbe un effetto protettivo contro le infezioni.
Anemia da malattia renale: In questo caso le riserve di ferro sono normali ma la mobilizzazione del ferro è compromessa (bassa saturazione della transferrina) che può portare a un’eritropoiesi compromessa e a una scarsa funzione del ferro. Il ferro per via orale non può essere usato perché l’assorbimento è compromesso.
L’anemia renale è talvolta complicata da una componente emolitica.
– Anomalie dell’eritropoiesi non indotte dal ferro:
Carenza di vitamina B-12 e acido folico
Talassemie: in questa malattia c’è una ridotta o assente sintesi della catena globinica. La struttura della catena globinica è normale. A seconda della quantità di globina colpita, la talassemia è chiamata alfa, beta, gamma, delta talassemia. Di solito si manifestano con microcitosi, ipocromia e anemia di varia intensità. 13,14
A causa della microcitosi e dell’ipocromia può essere confusa con l’anemia da carenza di ferro.
Le più frequenti sono l’alfa talassemia minor e la beta talassemia minor. Va notato che i bambini con talassemia possono anche avere un’anemia da carenza di ferro e possono richiedere un trattamento con ferro orale. Quando la sintesi di una catena globinica diminuisce, la sintesi delle altre globine (Hb A2, Hb F) aumenta. La quantificazione di queste emoglobine ci aiuta a classificarle.
Tuttavia, non tutte le anemie microcitiche e ipocromiche sono anemie da carenza di ferro e in questo gruppo dobbiamo evidenziare quelle in cui c’è una scarsa utilizzazione del ferro, come l’anemia dei disturbi cronici, ecc.
4.
I sintomi dell’anemia da carenza di ferro non sono diversi da quelli di altre anemie, cioè sono aspecifici; sono principalmente fatica, stanchezza, mancanza di forza; ma questi sintomi dipenderanno più dalla velocità di insorgenza dell’anemia che dai livelli di emoglobina.
Molti dei sintomi possono essere spiegati dalla carenza di ferro.
Pagofagia: tendenza compulsiva a mangiare ghiaccio.
Geofagia: tendenza a mangiare cose sporche
Cambiamenti negli epiteli: koilonychia, stomatite angolare, atrofia delle papille linguali, cambiamenti nelle mucose dell’intestino.
Intolleranza all’esercizio Cambiamenti comportamentali: il bambino diventa apatico e irritabile.
5.- Cause di carenza di ferro: (16)
Aumento dei bisogni fisiologici: crescita, mestruazioni, gravidanza, allattamento.
Perdita di sangue: gastrointestinale, urogenitale, iatrogena
Malassorbimento: resezioni gastriche, gastrite cronica atrofica, farmaci Assunzione inadeguata: anziani, vegetariani
L’ADH fa parte di una diagnosi più complessa e non ha lo stesso significato nelle diverse fasi della vita.
A. Nell’infanzia si spiegherebbe con l’aumento dei bisogni prodotti dalla crescita. Nel caso del bambino malato, il numero e la quantità di sangue prelevato per gli studi è molto importante (7,18,19)
Il neonato inizia la vita con circa 80 mg di ferro per kg di peso corporeo e la maggior parte di questo ferro fa parte dell’Hb con 50 gr/kg. La quantità di ferro nel neonato è determinata dal peso corporeo e dalla massa di emoglobina circolante. Il taglio del cordone ombelicale subito dopo la nascita può provocare la perdita del 15-30% del ferro totale. La concentrazione di Hb dei neonati è indipendente dai livelli di Hb e di ferro materni. Non c’è anche una correlazione tra i livelli di ferritina del sangue materno e del cordone ombelicale.
I neonati nati da madri diabetiche, nonostante il loro alto peso alla nascita, possono essere carenti di ferro.
Nei primi 5 mesi di vita il neonato è in grado di raddoppiare il suo peso corporeo senza svuotare le riserve di ferro. Dopo di che, l’assorbimento del ferro è importante per mantenere l’equilibrio del ferro.
Durante il primo anno di vita le esigenze sono maggiori che durante il resto della vita. Il bambino ha bisogno di circa 0,5 mgr/d per soddisfare le esigenze imposte dalla crescita. È improbabile che il latte sia in grado di fornire questa quantità di ferro, tuttavia, l’anemia da carenza di ferro è rara nei bambini allattati esclusivamente al seno. Questo potrebbe essere spiegato dal fatto che il ferro dal latte viene assorbito fino all’80%. Lo stato nutrizionale dei neonati allattati al seno è superiore a quello dei neonati nutriti con latte vaccino. Tra i 6 e i 12 mesi i neonati nutriti con latte possono sviluppare una carenza di ferro.
La prevalenza di DH è legata allo stato socio-economico della famiglia).
B.- Nelle donne in età fertile, la prevalenza di DH è legata alla funzione cognitiva e anche alle crisi febbrili.
B.- Nelle donne in età fertile, la prevalenza di DH è legata allo stato socio-economico della famiglia. Nelle donne in età fertile sarebbe spiegato da ferro perso attraverso le mestruazioni, la gravidanza e l’allattamento.(20)
La perdita mestruale nella maggior parte delle donne è 40 ml che è equivalente a 20 mgr di ferro. In Europa, la dieta contiene abbastanza ferro per compensare le perdite di sangue di 80 ml o 1,2 mg/d. L’eccessivo sanguinamento mestruale è la principale causa di anemia e colpisce il 9-14% delle donne (21)
La gravidanza comporta una perdita di circa 680 mg di ferro. Questo è molto più di quello che può essere assorbito, quindi l’integrazione di ferro è necessaria durante la gravidanza.
Oggi più di 40 milioni di donne incinte nei paesi in via di sviluppo sono carenti di ferro. L’anemia da carenza di ferro rappresenta il 75%-95% delle anemie della gravidanza. L’anemia da carenza di ferro durante la gravidanza è stata associata a prematurità, basso peso alla nascita e morbilità materna. Il fabbisogno di ferro varia durante la gravidanza. Tra 4 e 5 mgr di ferro sono necessari durante il 2° e 3° trimestre. La profilassi orale del ferro è il modo migliore per correggere questo deficit. I bisogni fisiologici di ferro durante la gravidanza non possono essere soddisfatti dalla co-somministrazione di acido folico. Le raccomandazioni sono 60 mg di ferro per le donne senza anemia più acido folico.(22)
C. – Nelle donne in postmenopausa, negli adulti e negli anziani, la diagnosi può essere più grave e si deve escludere la perdita digestiva(23).
Negli anziani, i livelli di Hb non sono così ben definiti per definire l’anemia.
Negli anziani, un livello di ferritina normale non esclude sempre la carenza di ferro, quindi il livello di cut-off per prevedere la carenza di ferro deve essere aumentato a 50 microgrammi/L.
In questo gruppo di pazienti, l’esame gastrointestinale è indicato a causa dell’alta frequenza con cui vengono rilevate lesioni occulte.
Nei pazienti di oltre 75 anni con anemia da carenza di ferro, fino al 68% dei pazienti sottoposti a endoscopia è stata rilevata la causa del sanguinamento e fino all’11% dei casi si è verificata una lesione sincrona.
L’assenza di carenza di ferro non esclude la presenza di neoplasia gastrointestinale(24). Fino al 20-30% degli anziani, la causa dell’anemia è sconosciuta, il che è noto come “anemia idiopatica dell’invecchiamento”
Conclusioni
– La diagnosi e la classificazione dell’ADH si basa su tecniche di base facilmente disponibili in qualsiasi laboratorio clinico,
– L’ADH è la fine di un processo che inizia con la carenza di ferro.
– La clinica dell’ADH è simile a quella di altre anemie, ma ci sono sintomi specifici che possono essere attribuiti alla carenza di ferro.
– L’ADH è l’anemia più diffusa in tutte le fasi della vita
– Nell’infanzia tra i 6 e i 12 mesi di età i bambini nutriti esclusivamente con latte vaccino possono sviluppare carenza di ferro. Nel bambino ospedalizzato una causa importante è il numero di prelievi di sangue.
– ADH rappresenta il 75%-95% delle anemie in gravidanza
– Nel caso di donne in postmenopausa, adulti e anziani, la perdita digestiva deve sempre essere esclusa.
– Negli anziani, fino al 20-30% dei casi l’eziologia è sconosciuta
Referenze
1. Organizzazione Mondiale della Sanità. Valutazione, prevenzione e controllo dell’anemia da carenza di ferro. Una guida per i gestori di programmi. Ginevra, Svizzera. Organizzazione Mondiale della Sanità 2001.
2. Processo di cura dell’anemia. Processo di anemia. Proceso asistencial integrado (Siviglia) Conserjería de Salud 2013. http://hdl.handle.net/10668/1683.
3. Ministero della sanità pubblica. Linee guida di pratica clinica. Diagnosi e trattamento dell’anemia in gravidanza. 1a edizione, Quito. Direzione nazionale di standardizzazione. 2014. http://saludgob.ec.
4. Matteo W, Domagalski, JE. Anemia da carenza di ferro: valutazione e gestione. American Family Physician 2013, vol 87, 2, 98-104.
5. Baker RD. Rapporto clinico Diagnosi e prevenzione della carenza di ferro e anemia da carenza di ferro in neonati e bambini piccoli (0-3 anni di età) Pediatria vol 126: %, 1040-1051, 2010. http://www.bcguidelines.ca/pdf/iron_deficiency.pdf.
6. Lukens J N. Metabolismo del ferro e carenza di ferro. Capitolo 6. Malattie del sangue dell’infanzia e dell’adolescenza. 7-o edizione.1995 Mosby.
7. OMS 1993-2005.Worldwide prevalenza di anemia.- 1993-2005 OMS. Database globale sull’anemia. http://whqlibdoc.who.int/publications/2008/978924159657_eng.pdf.
8. Aisen P. Conceptos actuales sobre el metabolismo del hierro1-18; Clínica Hematológica; vol 10/2. Trastorno del metabolismo del hierro 1984. Salvat Editores.
9. Wick M, Pinggera W, Lehmann P. Aspetti clinici e laboratorio metabolismo del ferro, anemie. Nuovi concetti nelle anemie di tumori maligni e malattie renali e reumatoidi. Quinto, edizione ampliata. 2013 Springer Wien New York.
10. Rapaport S.I. Eritropoyesis. Capítulo 1, 2-5 Introducción a la hematología 1974. Salvat Editores.
11. Goddard AF, James MW; Mcintyre AS, Scott BB; Società britannica di gastroenterologia. Linee guida per la gestione di anemia da carenza di ferro. Gut. 2011; 60 (10): 1309-1316.
12. Mast AE, Blinder MA, Gronosky AM, Chumley C, Scott MG. Utilità clinica del recettore della transferrina solubile e confronto con la ferritina sierica in diverse popolazioni. Clin Chem. 1998; 44(1): 45-51.
13. Tefferi A, Hansen CA, Inwards DS. Come interpretare e perseguire la conta anormale delle cellule del sangue completo negli adulti. Mayo Clin Proc 2005, 80: 923-936.
14. Wick M, Pinggera W, Lehmann P. Aspetti clinici e laboratorio metabolismo del ferro, anemie. Diagnosi di disturbi del metabolismo del ferro. Disturbi di eritropoiesi. Quinto, edizione ampliata.2003. Springer Wien New York.
15. Goddard AF, James MW, Mcintyre AS, Scott BB; Società britannica di gastroenterologia. Linee guida per la gestione di anemia da carenza di ferro. Gut. 2011; 60 (10); 1309-1316.
16. Orkin HS, Nathan DG. Le talassemie. Capitolo 21. Nathan e ematologia Oski di infanzia e infanzia. 5a edizione.1998 W. B. Saunders Company.
17. Lee GR. La microcitosi e le anemie associate a un’alterata sintesi dell’emoglobina. Capitolo 25. Wintrobe’s Cllinical Hematology. Nona edizione.1993. LEA e FEBIGER.
18. Verga M E. Carenza di ferro nell’infanzia: un immigrato è più a rischio? Swiss Med Wkly 2014; 144w14065.
19. Carter RC, Jacobson JL, Burden M et al. Anemia da carenza di ferro e funzione cognitiva nell’infanzia. Pediatria 2010; 126 (2) 427-434.
20. Mohammad Reza Sharif, Davood Kheirkhah, et al. Il rapporto tra carenza di ferro e convulsione febbrile: uno studio caso-controllo. Global Journal of Health Science. Global Journal of Health Science. 2016. Vol 8 (2)185-189.
21. Breyman C. Carenza di ferro in gravidanza. Seminars in hematol;2015; vol 52 (4) 339-347.
22. Fraser IS, Langhan S, Uhl- Hochgraeber K. Qualità della vita legata alla salute e onere economico del sanguinamento uterino anormale. Expert Rev Obstet Gynecol 2009; 4 (2):179-189.
23. Ioannou GN, Rockey DC, Bzyson C, Weis NS. Carenza di ferro e malignità gastrointestinale: uno studio di coorte basato sulla popolazione. Am J Med 2002. 113(4):276-280.
24. Joosten E, Ghesquiere B, Lindhoudt, et al. Valutazione gastrointestinale superiore e inferiore di impazienti anziani che sono carenti di ferro. Am J Med 1999: 107: 24.
.
