 |
|
Le reazioni acido-base sono onnipresenti. Nelle soluzioni acquose gli acidi aumentano la concentrazione di ioni idrogeno (H+). D’altra parte le basi aumentano la concentrazione dello ione idrossido (OH-). Quando un acido e una base reagiscono in una soluzione acquosa, gli ioni H+ e OH- si combinano per formare acqua. Questi ioni si “neutralizzano” a vicenda:
La maggior parte degli acidi ha la formula generale HA, dove A- è un anione e la maggior parte delle basi ha la forma BOH, dove B+ è un catione appropriato. Acidi e basi possono essere raggruppati in due tipi generali: acidi e basi forti e deboli. La differenza tra i due è semplice: un acido forte in una soluzione d’acqua si decompone al 100% in un protone (H+) e un anione (A-)
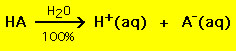
D’altra parte la maggior parte degli acidi deboli si decompone significativamente meno del 100% in una soluzione d’acqua:
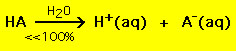 .
.In altre parole la maggior parte delle molecole di acido debole rimangono intatte in acqua. Equazioni chimiche simili valgono per le basi forti e deboli.
Ci sono solo alcuni acidi e basi deboli, che sono:
| |
|
|
HCl (acido cloridrico) HNO3 (acido nitrico) HClO4 (acido perclorico) H2SO4 (acido solforico) |
NaOH (idrossido di sodio) KOH (idrossido di potassio) Ca(OH)2 (idrossido di calcio) |
Tutti gli altri acidi e basi sono deboli. Un acido debole risulta da qualsiasi anione. Esempi sono dati sotto
| |
|
|
F- (fluoruro) Br- (bromuro) I- (ioduro) HCO3- (bicarbonato) C2H3O2- (acetato) MnO4- (permanganato) PO4-3 (fosfato) CrO4-2 (cromato) CN- (cianuro) NO2- (nitrito) SO3-2 (solfito) |
HF (acido fluoridrico) HBr (acido bromidrico) HI (acido idroiodico) H2CO3 (acido carbonico) HC2H3O2 (acido acetico) HMnO4 (acido permanganico) H3PO4 (acido fosforico H2CrO4 (acido cromico) HCN (acido cianidrico) HNO2 (acido nitroso) H2SO3 (acido solforoso) |
In una tipica reazione acido/base l’acido e la base reagiscono per formare un sale e acqua, ad es.g., acido cianidrico e idrossido di sodio:
