15.4 Proprietà fisiche degli acidi carbossilici
Obiettivi di apprendimento
- Confrontare i punti di ebollizione degli acidi carbossilici con alcoli di massa molare simile.
- Confrontare le solubilità degli acidi carbossilici in acqua con le solubilità di alcani e alcoli comparabili in acqua.
Molti acidi carbossilici sono liquidi incolore con odori sgradevoli. Gli acidi carbossilici con 5-10 atomi di carbonio hanno tutti un odore “caprino” (che spiega l’odore del formaggio Limburger). Questi acidi sono anche prodotti dall’azione dei batteri della pelle sul sebo umano (olii della pelle), il che spiega l’odore degli spogliatoi mal ventilati. Gli acidi con più di 10 atomi di carbonio sono solidi simili a cera, e il loro odore diminuisce con l’aumento della massa molare e la conseguente diminuzione della volatilità.
Gli acidi carbossilici presentano un forte legame idrogeno tra le molecole. Hanno quindi alti punti di ebollizione rispetto ad altre sostanze di massa molare comparabile.
Il gruppo carbossilico si impegna prontamente nel legame a idrogeno con le molecole di acqua (Figura 15.3 “Legame a idrogeno tra una molecola di acido acetico e molecole di acqua”). Gli acidi con uno a quattro atomi di carbonio sono completamente miscibili con l’acqua. La solubilità diminuisce all’aumentare della lunghezza della catena di carbonio perché le forze di dipolo diventano meno importanti e le forze di dispersione diventano più predominanti. L’acido esanoico è appena solubile in acqua (circa 1,0 g/100 g di acqua). L’acido palmitico, con la sua grande componente idrocarburica non polare, è essenzialmente insolubile in acqua. Gli acidi carbossilici sono generalmente solubili in solventi organici come etanolo, toluene ed etere dietilico.
Figura 15.3 Legame idrogeno tra una molecola di acido acetico e molecole di acqua
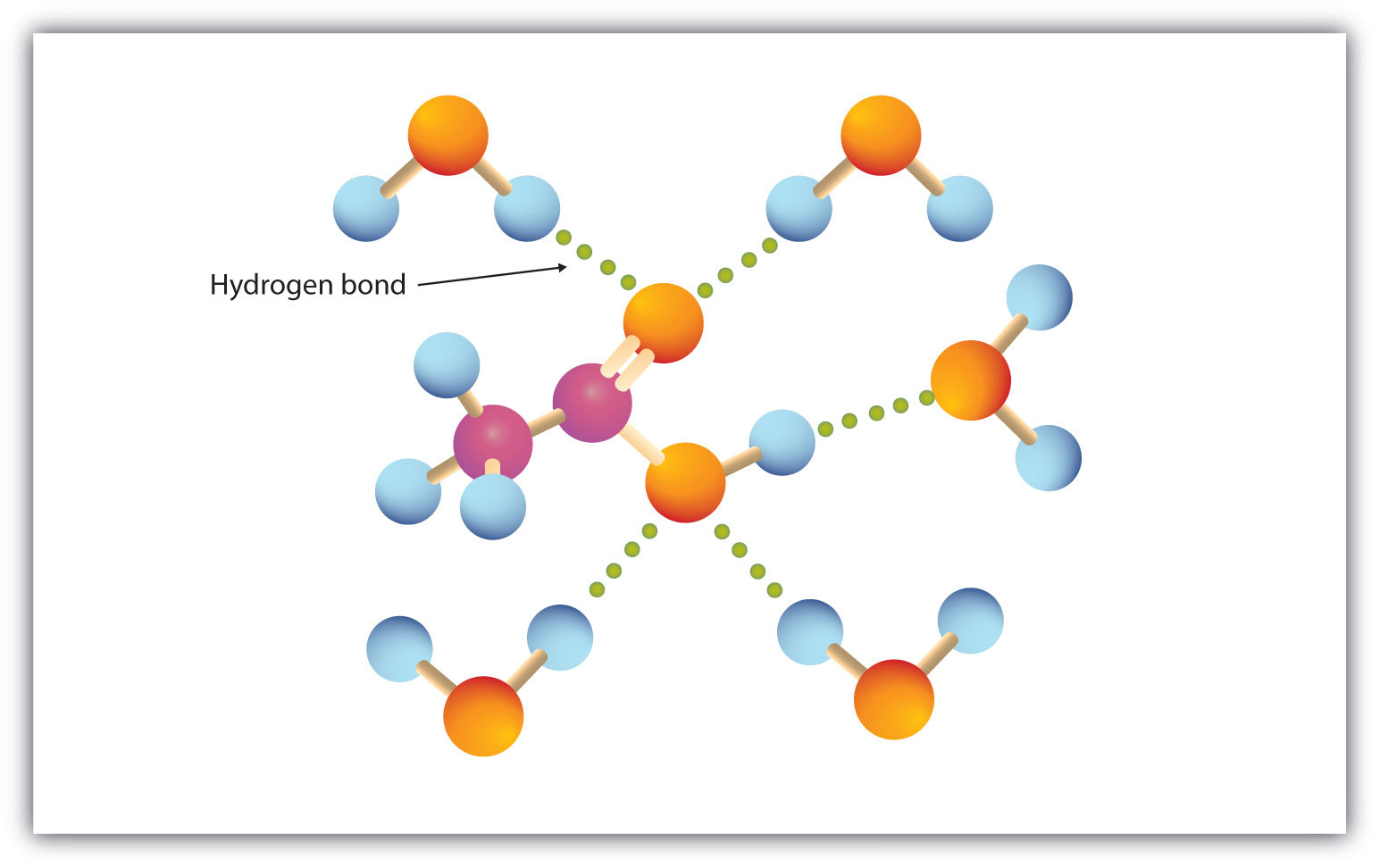
Gli acidi carbossilici di bassa massa molare sono abbastanza solubili in acqua.
La tabella 15.2 “Costanti fisiche degli acidi carbossilici” elenca alcune proprietà fisiche per acidi carbossilici selezionati. I primi sei sono omologhi. Si noti che i punti di ebollizione aumentano con l’aumentare della massa molare, ma i punti di fusione non mostrano uno schema regolare.
Tabella 15.2 Costanti fisiche degli acidi carbossilici
| Formula strutturale condensata | Nome dell’acido | Punto di fusione (°C) | Punto di ebollizione (°C) | Solubilità (g/100 g di acqua) |
|---|---|---|---|---|
| HCOOH | acido formico | 8 | 100 | miscibile |
| CH3COOH | acido acetico | 17 | 118 | miscibile |
| CH3CH2COOH | acido propionico | -22 | 141 | miscibile |
| CH3(CH2)2COOH | acido butirrico | -5 | 163 | miscibile |
| CH3(CH2)3COOH | acido valerico | -35 | 187 | 5 |
| CH3(CH2)4COOH | acido caproico | -3 | 205 | 1.1 |
| C6H5COOH | acido benzoico | 122 | 249 | 0.29 |
Esercizi di ripasso dei concetti
-
Quale composto ha il punto di ebollizione più alto: l’acido butanoico (massa molare 88) o il 2-pentanone (massa molare 86)? Spiega.
-
Ti aspetteresti che l’acido butirrico (acido butanoico) sia più o meno solubile del 1-butanolo in acqua? Spiegare.
Risposte
-
l’acido butirrico a causa del legame idrogeno (Non c’è legame idrogeno intermolecolare nel 2-pentanone.)
-
più solubile perché c’è un legame a idrogeno più esteso
Punti chiave
- Gli acidi carbossilici hanno alti punti di ebollizione rispetto ad altre sostanze di massa molare comparabile. I punti di ebollizione aumentano con la massa molare.
- Gli acidi carbossilici che hanno da uno a quattro atomi di carbonio sono completamente miscibili con l’acqua. La solubilità diminuisce con la massa molare.
Esercizi
-
Quale composto ha il punto di ebollizione più alto-CH3CH2CH2OCH2CH3 o CH3CH2CH2COOH? Spiegare.
-
Quale composto ha il punto di ebollizione più alto-CH3CH2CH2CH2CH2OH o CH3CH2CH2COOH? Spiegare.
-
Quale composto è più solubile in acqua-CH3COOH o CH3CH2CH2CH3? Spiegare.
-
Quale composto è più solubile in acqua-CH3CH2COOH o CH3CH2CH2CH2COOH? Spiegare.
Risposte
-
CH3CH2CH2COOH a causa del legame idrogeno (Non c’è legame idrogeno intermolecolare con CH3CH2CH2OCH2CH3.)
-
CH3COOH perché si lega a idrogeno con l’acqua (Non c’è legame a idrogeno intermolecolare con CH3CH2CH2CH3.)
