- o-Xylene Proprietà chimiche, usi, produzione
- Xylene
- Distillazione di precisione per la separazione di O-xilene e p-xilene
- Proprietà chimiche
- Usi
- Metodo di produzione
- Categoria
- Grado di tossicità
- Tossicità acuta
- ESPLOSIVI e CARATTERISTICHE PERICOLOSE
- Infiammabilità e caratteristiche pericolose
- Caratteristiche di stoccaggio e trasporto
- Agente estinguente
- Standard occupazionale
- Proprietà chimiche
- Proprietà fisiche
- Usi
- Definizione
- Riferimento della sintesi
- Descrizione generale
- Aria &Reazioni con l’acqua
- Profilo di reattività
- Rischio per la salute
- Pericolo di incendio
- Reattività chimica
- Profilo di sicurezza
- Fonte
- Destino ambientale
- Metodi di purificazione
o-Xylene Proprietà chimiche, usi, produzione
Xylene
Xylene si riferisce all’idrocarburo aromatico con i due atomi di idrogeno sull’anello benzenico sostituiti da due gruppi metilici. Ha tre isomeri o-xylene (1, 2-Dimetilbenzene), m-xylene e p-xylene. I prodotti industriali sono le miscele dei tre isomeri con 10% o-10%, 70% m-, e 20% p-. Nell’industria della cokizzazione, è uno dei prodotti raffinati del benzene grezzo.
Il xilene è una specie di liquido infiammabile incolore; il punto di fusione di o-, m-e p-xilene è-25.2 ℃, -47.9 ℃ e 13.3 ℃; i punti di ebollizione sono rispettivamente 144.4 ℃, 139.1 ℃ e 138.3 ℃ mentre la densità relativa è 0.8802, 0.8642 e 0.8611, rispettivamente; Non è solubile in acqua ma miscibile con molti generi di immiscibilità dei solventi organici. Su ossidazione catalitica, generano rispettivamente l’anidride ftalica, l’acido isoftalico e l’acido tereftalico.
Xylene è un tipo di materie prime importanti dei prodotti chimici organici, naturalmente esistenti nel catrame di carbone e in alcuni tipi di petrolio. Può essere ottenuto attraverso il frazionamento della parte di olio leggero del catrame di carbone o della benzina leggera di reforming catalitico. L’industria esegue principalmente l’estrazione utilizzando la frazione C8 nei reformati di nafta. In alternativa, può essere prodotta attraverso la reazione di sproporzione del toluene in presenza di catalizzatore e ad alta temperatura e alta pressione. Attualmente, l’industria applica principalmente il metodo della cristallizzazione criogenica, l’adsorbimento e la formazione di complessi o setacci molecolari per separarli. L’O-xilene ha un punto di ebollizione relativamente alto, potendo essere separato con la distillazione. Il p-xilene ha anche un alto punto di fusione e può essere purificato attraverso la cristallizzazione frazionata. Lo xilene misto senza separazione può essere utilizzato direttamente come solvente con l’aggiunta alla benzina in grado di migliorare le proprietà antideflagranti. Sono componenti della benzina per l’aviazione. L’o-xilene è usato principalmente per la preparazione dell’anidride ftalica, che è una materia prima importante per la fabbricazione di una varietà di coloranti e indicatori (come la fenolftaleina). Inoltre, l’o-xilene può essere utilizzato anche per la preparazione di resina di poliestere, insetticida, plastificanti e coloranti. L’M-xilene, attraverso la nitrazione e la riduzione, può generare la 4, 6-dimetil-1, 3-fenilendiammina che è l’intermedio per i coloranti sintetici. L’M-xilene può anche essere usato come materia prima per i profumi sintetici (come lo xilene muschiato). Il p-xilene è usato principalmente nella produzione di acido tereftalico, che è un’importante materia prima per la fibra sintetica di poliestere (poliestere).
Figura 1 la struttura chimica dei tre isomeri di xilene, orto-xilene, m-xilene, p-xilene struttura chimica.
Le informazioni di cui sopra sono a cura di Chemicalbook.
Distillazione di precisione per la separazione di O-xilene e p-xilene
Lo xilene si presenta in benzene grezzo cokizzato e olio di petrolio crackizzato. Il benzene grezzo, dopo la distillazione iniziale, il lavaggio con acido solforico e la distillazione per la separazione di benzene e toluene, seguita dalla distillazione, possiamo ottenere xilene, noto anche come xilene cokizzato. La qualità dello xilene cokizzato dipende dalla capacità di separazione della colonna di distillazione, dalla temperatura in cima alla colonna e dal rapporto di riflusso. La Cina ha classificato i prodotti di coking xylene in tre livelli. Lo xilene da coke contiene generalmente il 16% di o-xilene, il 50% di m-xilene, il 21% di p-xilene e il 7% di etilbenzene. Lo xilene prodotto nell’industria petrolifera ha un basso contenuto di m-xilene e un alto contenuto di etilbenzene. Lo xilene industriale non è solo il solvente e l’additivo dell’industria della gomma e dei rivestimenti, ma anche gli additivi dell’aviazione e del carburante. O-xylene, m-xylene e p-xylene separati dallo xilene industriale sono le materie prime dell’acido ftalico, dell’acido isoftalico e dell’acido tereftalico, rispettivamente. L’acido ftalico e l’acido tereftalico sono usati nella produzione di plastificanti, resine di poliestere e fibre di poliestere. L’m-xilene può essere usato da solo come solvente e additivo per carburanti. L’o-xilene contenuto nello xilene industriale ha una differenza di oltre 5,2 ℃ con gli altri isomeri. Con la distillazione di precisione, possiamo ottenere l’o-xilene con una purezza superiore al 95%, seguita dalla solfonazione e dalla distillazione per la purificazione in modo da ottenere un ulteriore o-xilene più puro.
Il xilene appartiene alla base di Lewis, che può formare un complesso polare con HF-BF3 (acido di Lewis). L’alcalinità di M-xilene è circa 100 volte più forte di quella di altri aromatici C8. Quando la miscela di isomeri dello xilene entra in contatto con il solvente HF-BF3, l’m-xilene può formare un complesso con il fluoruro e viene estratto preferibilmente nella fase fluorurata. La fase fluorurata contenente m-xilene viene riscaldata a una pressione inferiore per decomporre il complesso, separando così m-xilene dalla miscela. Il solvente HF-BF3 può essere recuperato per distillazione per essere riciclato. Se la materia prima è una miscela di orto-xilene, m-xilene e p-xilene, dopo che l’m-xilene è stato estratto, possiamo usare ulteriormente la distillazione di precisione per separare l’o-xilene e il p-xilene.
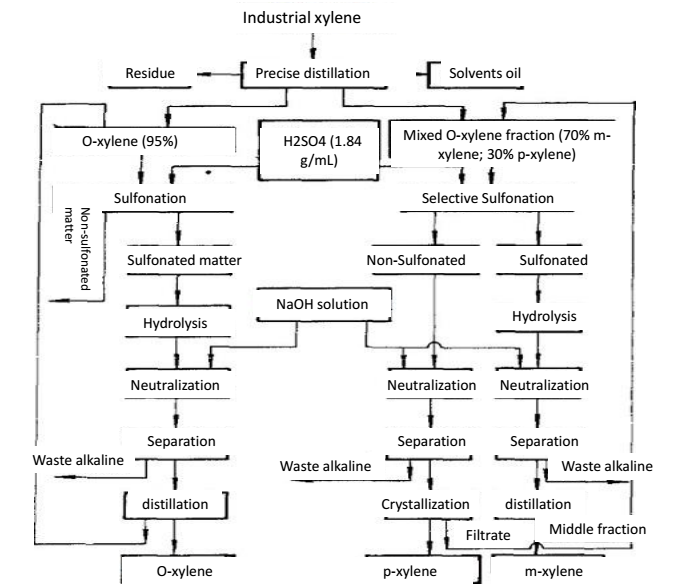
Figura 2 il metodo di distillazione di precisione per la separazione di o-xylene e p-xylene.
Proprietà chimiche
Appare come liquido trasparente incolore con odore aromatico. È miscibile con etanolo, etere etilico, acetone e benzene ma insolubile in acqua.
Usi
(1) È usato principalmente nella produzione di anidride ftalica
(2) L’O-xilene è la materia prima per la produzione di fenramina germicida, tetracorofenil peptide e l’erbicida bensulfuron-metile. È usato come intermedio per la fabbricazione dell’acido o-metilbenzoico.
(3) È principalmente usato come materie prime chimiche e solventi. Può essere usato per produrre anidride ftalica, coloranti, pesticidi e farmaci, come le vitamine. Può anche essere usato come additivi della benzina per l’aviazione.
(4) Usato come standard cromatografici e solventi
(5) Come materie prime della sintesi dell’anidride e di altre sintesi organiche;
Metodo di produzione
L’industria ha applicato il metodo di superdistillazione per separare l’o-xilene dallo xilene misto. L’o-xilene ha una differenza di oltre 5 ℃ nel punto di ebollizione rispetto agli altri componenti dello xilene misto. Per la distillazione, il numero di vassoi richiesto è di circa 150; il rapporto di riflusso è di 5-8 e consuma molta energia relativa.
L’o-xilene era originariamente prodotto principalmente dal catrame di carbone. Attualmente la maggior parte della produzione nazionale ed estera di o-xilene avviene principalmente attraverso l’estrazione dal reforming catalitico del petrolio e il cracking termico dell’idrocarburo aromatico. Dato che le strutture di o-xilene, p-xilene e m-xilene nello xilene sono molto simili, anche i loro parametri fisici sono abbastanza simili. La separazione industriale dell’o-xilene adotta principalmente il metodo di super-distillazione; prima separa l’o-xilene e l’etilbenzene dallo xilene misto che richiede l’uso di una torre di distillazione a 100~150 vassoi; seguita dalla separazione dell’o-xilene e dell’etilbenzene per ottenere o-xilene puro.
Categoria
Liquidi infiammabili
Grado di tossicità
avvelenamento
Tossicità acuta
LDL0 del ratto per via orale: 5000 mg/kg; LD50 del topo per iniezione addominale: 1364 mg/kg
ESPLOSIVI e CARATTERISTICHE PERICOLOSE
essendo esplosivo quando mescolato con aria
Infiammabilità e caratteristiche pericolose
essendo infiammabile su fiamma, calore, ossidante Infiammabile con combustione che rilascia fumo irritante
Caratteristiche di stoccaggio e trasporto
magazzino: ventilato, a bassa temperatura e asciutto; caricare e scaricare delicatamente; conservarlo separatamente da ossidanti e acidi.
Agente estinguente
acqua nebulizzata, schiuma, sabbia, anidride carbonica, agente estinguente 1211
Standard occupazionale
TLV-TWA 100 PPM (440 mg/m 3); STEL 150; PPM (655 mg/m 3)
Proprietà chimiche
liquido incolore
Proprietà fisiche
Liquido chiaro, incolore con un odore aromatico. Una concentrazione di soglia di odore di 380 ppbv è stata riportata da Nagata e Takeuchi (1990).
Usi
Preparazione di acido ftalico, anidride ftalica, acido tereftalico, acido isoftalico; solvente per resine alchidiche, lacche, smalti, cementi di gomma; produzione di coloranti, farmaci e insetticidi; carburanti per motori.
Definizione
ChEBI: Uno xilene sostituito da gruppi metilici nelle posizioni 1 e 3.
Riferimento della sintesi
Journal of the American Chemical Society, 97, p. 7262, 1975 DOI: 10.1021/ja00858a011
The Journal of Organic Chemistry, 44, p. 2185, 1979 DOI: 10.1021/jo01327a032
Descrizione generale
Un liquido acquoso incolore con un odore dolce. Meno denso dell’acqua. Insolubile in acqua. Vapore irritante.
Aria &Reazioni con l’acqua
Altamente infiammabile. Insolubile in acqua.
Profilo di reattività
L’1,2-Dimetilbenzene può reagire con materiali ossidanti. .
Rischio per la salute
I vapori causano mal di testa e vertigini. Il liquido irrita gli occhi e la pelle. Se assunto nei polmoni, causa tosse grave, angoscia ed edema polmonare a rapido sviluppo. Se ingerito, causa nausea, vomito, crampi, mal di testa e coma. Può essere fatale. Possono verificarsi danni ai reni e al fegato.
Pericolo di incendio
Comportamento in caso di incendio: Il vapore è più pesante dell’aria e può percorrere una distanza considerevole fino a una fonte di accensione e ritorno di fiamma.
Reattività chimica
Reattività con acqua Nessuna reazione; Reattività con materiali comuni: Nessuna reazione; Stabilità durante il trasporto: Stabile; Agenti neutralizzanti per acidi e caustici: Non pertinente; Polimerizzazione: Non pertinente; Inibitore della polimerizzazione: Non pertinente.
Profilo di sicurezza
Moderatamente tossico per via bj7intraperitoneale. Moltissimo tossico per ingestione e inalazione. Un teratogeno sperimentale. Un comune contaminante dell’aria. Pericolo di incendio molto pericoloso se esposto a calore o fiamme. Esplosivo sotto forma di vapore se esposto a calore o fiamme. Per combattere il fuoco, usare schiuma, CO2, dry chemical.Incompatibile con materiali ossidanti.Quando riscaldato alla decomposizione emette fumo acre e fumi irritanti. Emesso da materiali da costruzione moderni (CENEAR69,22,91). Vedi anche altre voci xilene.
Fonte
Rilevato in frazioni solubili in acqua distillata di benzina 87 ottani (3,83 mg/L), benzina 94 ottani (11,4 mg/L), Gasohol (8,49 mg/L), No. 2 olio combustibile (1,73 mg/L), jet fuel A (0.87 mg/L), gasolio (1,75 mg/L), jet fuel militare JP-4 (1,99 mg/L) (Potter, 1996), olio motore nuovo (16,2 a 17,5 μg/L), e olio motore usato (294 a 308 μg/L) (Chen et al., 1994). La percentuale media di volume e la frazione molare stimata nella benzina PS-6 dell’American Petroleum Institute sono rispettivamente 2,088 e 0,01959 (Poulsen et al., 1992). Schauer et al. (1999) hanno riportato la presenza di o-xilene nei gas di scarico di un autocarro medio a motore diesel con un tasso di emissione di 830 μg/km. Il carburante diesel ottenuto da una stazione di servizio a Schlieren, Svizzera, conteneva o-xylene ad una concentrazione di 223 mg/L (Schluep etal., 2001).
La benzina riformulata Phase II della California conteneva o-xylene ad una concentrazione di 19,7 g/kg.I tassi di emissione in fase gassosa dallo scarico di automobili a benzina con e senza convertitori catalitici erano rispettivamente 5,41 e 562 mg/km (Schauer et al., 2002).
Thomas e Delfino (1991) hanno equilibrato l’acqua di falda priva di contaminanti raccolta da Gainesville, FL con frazioni individuali di tre prodotti petroliferi individuali a 24-25 °C per 24 ore. La fase acquosa è stata analizzata per i composti organici tramite il metodo di prova 602 approvato dall’EPA degli Stati Uniti. Le concentrazioni medie di m+p-xilene riportate nelle frazioni solubili in acqua di benzina senza piombo, cherosene e carburante diesel erano rispettivamente 8,611, 0,658 e 0,228 mg/L. Quando gli autori hanno analizzato la fase acquosa tramite il metodo di prova 610 approvato dall’EPA degli Stati Uniti, le concentrazioni medie di m+p-xilene nelle frazioni solubili in acqua di benzina senza piombo, cherosene e carburante diesel erano più basse, cioè 6,068, 0,360 e 0,222 mg/L, rispettivamente. In base all’analisi di laboratorio di 7 campioni di catrame di carbone, le concentrazioni di o-xilene variavano da 2 a 2.000 ppm (EPRI, 1990). Un catrame di carbone ad alta temperatura conteneva o-xilene ad una concentrazione media dello 0,04% in peso (McNeil, 1983).
Schauer et al. (2001) hanno misurato i tassi di emissione di composti organici per composti organici volatili, composti organici semi-volatili in fase gassosa e composti organici in fase particellare dalla combustione residenziale (camino) di pino, quercia ed eucalipto. Il tasso di emissione in fase gassosa di o-xilene era di 18,1 mg/kg di pino bruciato. I tassi di emissione di o-xilene non sono stati misurati durante la combustione di quercia ed eucalipto.
Standard per l’acqua potabile (finale): Per tutti gli xileni, la MCLG e la MCL sono entrambe 10 mg/L. Inoltre, è stato raccomandato un DWEL di 70 mg/L (U.S. EPA, 2000).
Destino ambientale
Biologico. I prodotti di biodegradazione riportati del prodotto commerciale contenente xilene includono acido α-idrossi-p-toluico, alcool p-metilbenzilico, alcool benzilico, 4-metilcatecolo, acidi mandp-toluici (Fishbein, 1985). o-Xylene è stato anche cometabolizzato con conseguente formazione di acido o-toluico (Pitter e Chudoba, 1990). In acque sotterranee anossiche vicino a Bemidji, MI, l’o-xyleneanaerobicamente biodegradato all’acido o-toluico intermedio (Cozzarelli et al., 1990). In acque sotterranee contaminate da benzina, l’acido metilbenzilsuccinico è stato identificato come il primo intermedio durante la degradazione anaerobica degli xileni (Reusser e Field, 2002).
Fotolitico. Cox et al. (1980) hanno riportato una costante di tasso di 1,33 x 10-11 cm3/molecola?sec per l’azione dell’o-xilene gassoso con i radicali OH basata su un valore di 8 x 10-12 cm3/molecola?sec per la reazione dell’etilene con i radicali OH.
Acqua superficiale. L’emivita di evaporazione dell’o-xilene in acqua superficiale (1 m di profondità) a 25 °C è stimata a 5,18 ore (Mackay e Leinonen, 1975). Nielsen et al. (1996) hanno studiato la degradazione dell’o-xilene in un acquifero sabbioso poco profondo, glaciofluviale e non confinato nello Jutland, Danimarca. Come parte dello studio del microcosmo in situ, un cilindro aperto sul fondo e schermato in cima è stato installato attraverso un foro incassato a circa 5 m di profondità. Cinque litri di acqua sono stati aerati con aria atmosferica per garantire il mantenimento di condizioni aerobiche. Le acque sotterranee sono state analizzate settimanalmente per circa 3 mesi per determinare le concentrazioni di o-xilene nel tempo. La costante di velocità di biodegradazione del primo ordine determinata sperimentalmente e il corrispondente tempo di dimezzamento dopo una fase di ritardo di 7 giorni erano rispettivamente 0,1/d e 6,93 d.
Fotolitico. Quando l’aria sintetica contenente acido nitroso gassoso e o-xilene è stata esposta alla luce solare artificiale (λ = 300-450 nm) il biacetile, il nitrato perossiacetale e il nitrato di metile hanno formato asprodotti (Cox et al., 1980). Una soluzione di n-esano contenente o-xilene e stesa come film sottile (4 mm) su acqua fredda (10 °C) è stata irradiata da una lampada a media pressione al mercurio. In 3 ore, il 13,6% dell’o-xilene si è fotoossidato in o-metilbenzaldeide, o-benzil alcool, acido o-benzoico e ometilacetofenone (Moza e Feicht, 1989). L’irradiazione di o-xilene a ≈ 2537 ? a 35 °C e 6 mmHg isomerizza in m-xilene (Calvert e Pitts, 1966). Glyoxal, methylglyoxal e biacetyl sono stati prodotti dalla fotoossidazione di o-xilene da radicali OH in aria a 25 °C (Tuazon et al.,1986a).
Chimico/Fisico. In condizioni atmosferiche, la reazione in fase gassosa di o-xilene con radicali OH e ossidi di azoto ha portato alla formazione di o-tolualdeide, o-metilbenzil nitrato, nitro-o-xileni, 2,3-e 3,4-dimetilfenolo (Atkinson, 1990). Kanno et al. (1982) hanno studiato la reazione acquosa di o-xilene e altri idrocarburi aromatici (benzene, toluene, m- e p-xilene, e naftalene) con acido ipocloroso in presenza di ione ammonio. Hanno riferito che l’anello aromatico non è stato clorurato come previsto, ma è stato scisso dalla cloramina formando cloruro di cianogeno. La quantità di cloruro di cianogeno formato aumentava a pH più bassi (Kanno et al., 1982). Nella fase gassosa, l’o-xilene ha reagito con radicali nitrati in aria purificata formando i seguenti prodotti: 5-nitro-2-metiltoluene e 6-nitro-2-metiltoluene, o-metilbenzaldeide e un nitrato arilico (Chiodini et al., 1993).
Metodi di purificazione
L’o-Xilene (4.4Kg) viene solfonato mescolando per 4 ore con 2.5L di H2SO4 conc a 95o. Dopo il raffreddamento e la separazione del materiale non solfonato, il prodotto viene diluito con 3L di acqua e neutralizzato con 40% NaOH. Al raffreddamento, il sodio o-xilene solfonato si separa e viene ricristallizzato da metà del suo peso di acqua. Il sale viene sciolto nella quantità minima di acqua fredda, poi mescolato con la stessa quantità di acqua fredda e con lo stesso volume di H2SO4 conc e riscaldato a 110o. Il distillato viene saturato con NaCl, lo strato organico viene separato, essiccato e ridistillato.
