Risultati dell’apprendimento
- Definire la regola dell’ottetto e il suo ruolo nei legami chimici
Non tutti gli elementi hanno abbastanza elettroni per riempire i loro gusci più esterni, ma un atomo è più stabile quando tutte le posizioni degli elettroni nel guscio più esterno sono riempite. A causa di questi vuoti nei gusci più esterni, assistiamo alla formazione di legami chimici, o interazioni tra due o più elementi uguali o diversi che portano alla formazione di molecole. Per ottenere una maggiore stabilità, gli atomi tenderanno a riempire completamente i loro gusci esterni e si legheranno con altri elementi per raggiungere questo obiettivo condividendo elettroni, accettando elettroni da un altro atomo o donando elettroni ad un altro atomo. Poiché i gusci più esterni degli elementi con basso numero atomico (fino al calcio, con numero atomico 20) possono contenere otto elettroni, si parla di regola dell’ottetto. Un elemento può donare, accettare o condividere elettroni con altri elementi per riempire il suo guscio esterno e soddisfare la regola dell’ottetto.
Un primo modello dell’atomo fu sviluppato nel 1913 dallo scienziato danese Niels Bohr (1885-1962). Il modello di Bohr mostra l’atomo come un nucleo centrale contenente protoni e neutroni, con gli elettroni in gusci elettronici circolari a distanze specifiche dal nucleo, simili ai pianeti che orbitano intorno al sole. Ogni guscio di elettroni ha un diverso livello di energia, con i gusci più vicini al nucleo che hanno un’energia inferiore a quelli più lontani dal nucleo. Per convenzione, ad ogni guscio viene assegnato un numero e il simbolo n – per esempio, il guscio di elettroni più vicino al nucleo è chiamato 1n. Per muoversi tra i gusci, un elettrone deve assorbire o rilasciare una quantità di energia corrispondente esattamente alla differenza di energia tra i gusci. Per esempio, se un elettrone assorbe energia da un fotone, può diventare eccitato e spostarsi in un guscio di energia superiore; viceversa, quando un elettrone eccitato scende di nuovo in un guscio di energia inferiore, rilascerà energia, spesso sotto forma di calore.
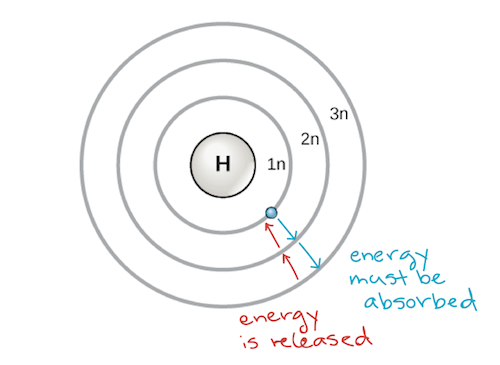
Modello Bohr di un atomo, che mostra i livelli di energia come cerchi concentrici che circondano il nucleo. L’energia deve essere aggiunta per spostare un elettrone verso l’esterno ad un livello di energia superiore, e l’energia viene rilasciata quando un elettrone scende da un livello di energia superiore ad uno più vicino. Image credit: modified from OpenStax Biology
Gli atomi, come altre cose governate dalle leggi della fisica, tendono ad assumere la configurazione a più bassa energia e più stabile che possono. Così, i gusci degli elettroni di un atomo si popolano dall’interno verso l’esterno, con gli elettroni che riempiono i gusci a bassa energia più vicini al nucleo prima di spostarsi nei gusci a più alta energia più lontani. Il guscio più vicino al nucleo, 1n, può contenere due elettroni, mentre il guscio successivo, 2n, può contenerne otto, e il terzo guscio, 3n, può contenerne fino a diciotto.
Il numero di elettroni nel guscio più esterno di un particolare atomo determina la sua reattività, o tendenza a formare legami chimici con altri atomi. Questo guscio più esterno è noto come guscio di valenza, e gli elettroni che si trovano in esso sono chiamati elettroni di valenza. In generale, gli atomi sono più stabili, meno reattivi, quando il loro guscio elettronico più esterno è pieno. La maggior parte degli elementi importanti in biologia hanno bisogno di otto elettroni nel loro guscio più esterno per essere stabili, e questa regola empirica è nota come regola dell’ottetto. Alcuni atomi possono essere stabili con un ottetto anche se il loro guscio di valenza è il guscio 3n, che può contenere fino a 18 elettroni. Esploreremo la ragione di questo quando discuteremo degli orbitali elettronici più avanti.
Esempi di alcuni atomi neutri e delle loro configurazioni elettroniche sono mostrati qui sotto. In questa tabella, puoi vedere che l’elio ha un guscio di valenza completo, con due elettroni nel suo primo e unico guscio, 1n. Allo stesso modo, il neon ha un guscio esterno completo 2n che contiene otto elettroni. Queste configurazioni elettroniche rendono l’elio e il neon molto stabili. Anche se l’argon non ha tecnicamente un guscio esterno completo, poiché il guscio 3n può contenere fino a diciotto elettroni, è stabile come il neon e l’elio perché ha otto elettroni nel guscio 3n e quindi soddisfa la regola dell’ottetto. Al contrario, il cloro ha solo sette elettroni nel suo guscio più esterno, mentre il sodio ne ha solo uno. Questi modelli non riempiono il guscio più esterno o soddisfano la regola dell’ottetto, rendendo il cloro e il sodio reattivi, desiderosi di guadagnare o perdere elettroni per raggiungere una configurazione più stabile.
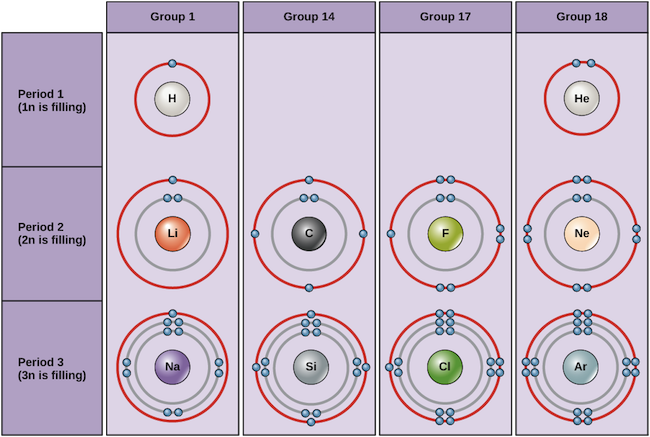
Diagrammi di Bohr di vari elementi Image credit: OpenStax Biology
Configurazioni degli elettroni e la tavola periodica
Gli elementi sono messi in ordine sulla tavola periodica in base al loro numero atomico, quanti protoni hanno. In un atomo neutro, il numero di elettroni sarà uguale al numero di protoni, quindi possiamo facilmente determinare il numero di elettroni dal numero atomico. Inoltre, la posizione di un elemento nella tavola periodica – la sua colonna, o gruppo, e la riga, o periodo – fornisce informazioni utili su come sono disposti quegli elettroni.
Se consideriamo solo le prime tre righe della tavola, che comprendono i principali elementi importanti per la vita, ogni riga corrisponde al riempimento di un diverso guscio elettronico: elio e idrogeno mettono i loro elettroni nel guscio 1n, mentre gli elementi della seconda fila come il Li iniziano a riempire il guscio 2n, e gli elementi della terza fila come il Na continuano con il guscio 3n. Allo stesso modo, il numero di colonna di un elemento fornisce informazioni sul suo numero di elettroni di valenza e sulla sua reattività. In generale, il numero di elettroni di valenza è lo stesso all’interno di una colonna e aumenta da sinistra a destra all’interno di una riga. Gli elementi del gruppo 1 hanno un solo elettrone di valenza e gli elementi del gruppo 18 ne hanno otto, tranne l’elio, che ha solo due elettroni in totale. Così, il numero del gruppo è un buon predittore di quanto reattivo sarà ogni elemento:
- Elio (He), neon (Ne), e argon (Ar), come elementi del gruppo 18, hanno gusci di elettroni esterni che sono pieni o soddisfano la regola dell’ottetto. Questo li rende altamente stabili come atomi singoli. A causa della loro non-reattività, sono chiamati gas inerti o gas nobili.
- Idrogeno (H), litio (Li) e sodio (Na), come elementi del gruppo 1, hanno un solo elettrone nei loro gusci più esterni. Sono instabili come atomi singoli, ma possono diventare stabili perdendo o condividendo il loro unico elettrone di valenza. Se questi elementi perdono completamente un elettrone – come fanno tipicamente Li e Na – diventano ioni con carica positiva: Li+, Na+.
- Fluoro (F) e cloro (Cl), come elementi del gruppo 17, hanno sette elettroni nei loro gusci più esterni. Tendono a raggiungere un ottetto stabile prendendo un elettrone da altri atomi, diventando ioni con carica negativa: F- e Cl-.
- Il carbonio (C), come elemento del gruppo 14, ha quattro elettroni nel suo guscio esterno. Il carbonio tipicamente condivide gli elettroni per ottenere un guscio di valenza completo, formando legami con molti altri atomi.
Quindi, le colonne della tavola periodica riflettono il numero di elettroni trovati nel guscio di valenza di ogni elemento, che a sua volta determina come l’elemento reagirà.
Prova
Contribuisci!
Migliorare questa paginaPer saperne di più
