Introduzione della ciclina
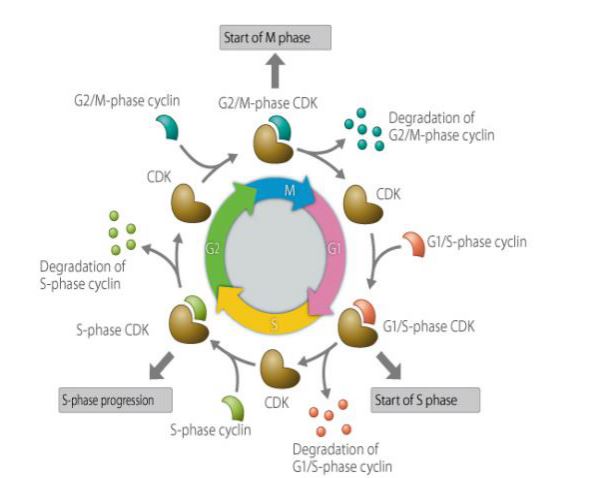
La ciclina è un tipo di proteina che si esprime, si accumula e si decompone in un ciclo cellulare, e interagisce con le chinasi ciclina-dipendenti per influenzare la funzione del ciclo cellulare. La ciclina è coinvolta nelle proteine regolate dal ciclo cellulare, e la sua concentrazione è ciclica e ciclica nel ciclo cellulare. A seconda della fase del ciclo cellulare, a volte la concentrazione è alta come diverse migliaia di volte, e a volte scende a zero. Come subunità di regolazione, la ciclina si lega alle protein chinasi ciclina-dipendenti e le attiva. Diverse cicline sono espresse in diversi periodi del ciclo cellulare. Nelle cellule di mammifero, la ciclina A inizia a esprimersi e ad accumularsi gradualmente nella prima fase G1, raggiungendo la giunzione G1/S, e il contenuto raggiunge il massimo e rimane nella fase G2/M. La ciclina B si esprime dalla tarda fase G1 e si accumula gradualmente. Raggiunge il massimo nella tarda fase G2 e si mantiene fino alla metà della fase M, per poi degradarsi rapidamente. La ciclina D, che è una ciclina della fase G1, è continuamente espressa nel ciclo cellulare, mentre la ciclina E inizia a esprimersi e si accumula gradualmente nella tarda fase M e nella prima fase G1, raggiungendo il massimo nella tarda fase G1, per poi raggiungere gradualmente il suo contenuto massimo, declinando fino alla tarda fase G2. La ciclina gioca un ruolo importante nella regolazione del ciclo cellulare. Lo studio del meccanismo delle cicline ha un grande significato per il trattamento del cancro.
I membri della famiglia delle cicline e le loro funzioni rispettivamente
Fino ad oggi, le cicline umane sono state isolate e nominate in un totale di 8 categorie, cioè da A a H, e comprendono alcune sottoclassi (come la ciclina D1, D2, D3), di cui F, G, H sono le ultime scoperte. Tutte le cicline hanno certe somiglianze di sequenza aminoacidica e servono quindi come marcatori strutturali molecolari delle cicline. Questa regione aminoacidica omologa nella ciclina è la cosiddetta cassetta della ciclina, che è una regione di sequenza di 100-150 aminoacidi altamente conservata tra le cicline di vari organismi. La ciclina umana contiene anche una cassetta difettosa o una regione di sequenza aminoacidica ricca di residui di prolina, acido glutammico, acido aspartico, serina e treonina (di seguito denominata regione di sequenza aminoacidica PEST). Il legame della ciclina B alla chinasi ciclina-dipendente p34CDC2 controlla l’entrata e l’uscita della mitosi, che viene sintetizzata dalla fase S alla fase G2 /M, e gradualmente si accumula e si lega a p34CDC2. Nella fase M, si degrada gradualmente; al contrario, l’uscita dalla fase M dipende dalla rapida degradazione della ciclina nella fase finale della divisione, con conseguente rilascio della subunità inattiva p34CDC2. Nelle cellule umane, la ciclina B si accumula nel citoplasma ed entra nel nucleo prima della scomparsa della membrana nucleare. Una volta attivata, la ciclina B/CDC fosforila un gruppo di proteine, tra cui lamin, vimentina e calcio, che svolge un ruolo importante nella concentrazione dei cromosomi, nella disintegrazione della membrana nucleare, nella depolimerizzazione dei filamenti intermedi e nella riorganizzazione dei microfilamenti. La ciclina B gioca anche un ruolo importante nella transizione di fase della mitosi, che è una classica proteina del ciclo di scissione. La ciclina A gioca un ruolo in entrambe le transizioni di fase G2/M e G1/S. Appare prima dell’inizio della sintesi del DNA, e aumenta gradualmente fino alla fase di pre-splittamento e si degrada nella fase intermedia. Quando induce la mitosi, differisce dalla vera ciclina B mitotica per molti aspetti. Il contenuto di ciclina C cambia poco durante il ciclo cellulare, con solo un leggero aumento all’inizio di G1. L’mRNA della ciclina C raggiunge il suo picco a metà del G1 in cellule HeLa sincronizzate, prima della ciclina A, che potrebbe avere un ruolo nel G1. La ciclina E ha una distinta espressione periodica nel ciclo cellulare, e il suo picco è nella transizione di fase G1 /S. Ha la funzione di controllare la cellula per entrare nella fase S, che può essere il fattore limitante nella transizione di fase G1 /S. Nelle cellule di mammifero, come la ciclina A, si lega a p33CDK2, un complesso che ha attività istone H1 chinasi nelle prime fasi G1 e S, ma la ciclina A ed E può interagire con la proteina retinoblastoma per separare i complessi, suggerendo che i complessi CDK2/ciclina A o E possono regolare indirettamente l’espressione genica nelle fasi G1 e S. La ciclina E può avere un ruolo nella ciclina D, che svolge un ruolo importante nell’inizio della replicazione del DNA, nella conversione G1 /S, e la sua sovraespressione accelera l’entrata delle cellule nella fase S. La ciclina D può controllare la fase G1 iniziale del processo, prima o contemporaneamente alla ciclina E. La ciclina D ha tre sottotipi (D1, D2, D3), e la sua espressione varia da cellula a cellula, ed è controllata da diverse regioni cromosomiche (D1: 11q13; D2: 12p13; D3: 6p21). I sottotipi possono avere effetti diversi. Le caratteristiche notevoli della ciclina D sono: è indotta ad esprimersi come risposta a stimoli esterni, mostrando un’elevata inducibilità ai fattori di crescita, agendo come un sensore di fattori di crescita, che gioca un ruolo importante nel collegare i segnali esterni con il ciclo cellulare interno. Il ruolo, a sua volta, deduce che la sua espressione incontrollata rende il ciclo cellulare non più o meno dipendente dai fattori di crescita e può indurre il cancro. Il complesso ciclina D-CDK è il miglior candidato per la proteina chinasi del retinoblastoma (Rb) allo stadio G1. La ciclina D si lega alla regione N-terminale della proteina Rb, fosforila Rb nella tarda fase G1, e la sintesi e attivazione della ciclina D1 porta all’inattivazione della fosforilazione di Rb e alla down-regolazione della ciclina D1, e il complesso D1-CDK4 forma un feedback negativo nella fase G1, che a sua volta spegne l’espressione della ciclina D1. La ciclina D e Rb svolgono un ruolo importante nella proliferazione e differenziazione cellulare, quando la ciclina D1 è diversa nella fase G1. Nell’espressione di origine, la fosforilazione di Rb è più precoce del normale; la fase G1 è accelerata, e l’anticorpo anti-ciclina D1 è microiniettato nelle cellule in fase G1 precoce fino alla metafase; la maggior parte delle cellule sono arrestate prima della fase S, e la mancanza di Rb funzionale non può causare questo blocco; si conclude che il ruolo importante della ciclina D1 è di inattivare la fosforilazione di Rb, inducendo così l’ingresso nella fase S e la replicazione del DNA. La ciclina F è la proteina di ciclina più abbondante (peso molecolare 87 kDa), e il suo mRNA è universalmente espresso in varie cellule del tessuto umano, e ci sono cambiamenti significativi nel ciclo cellulare. Il picco è nella fase G2, come la ciclina A, e diminuisce prima che il livello di mRNA della ciclina B diminuisca. La proteina della ciclina F si accumula nella fase intercellulare e viene distrutta durante la fase di mitosi. Si trova nel nucleo nella maggior parte delle cellule. La sovraespressione o la mutazione nelle cellule umane provoca una mancanza di regioni di sequenza aminoacidica PEST che porta ad un aumento delle cellule in fase G2. La ciclina G è molto simile alla ciclina B del lievito di fissione, che svolge un ruolo nella conversione G1/S, ma l’mRNA della ciclina G non ha un’ovvia dipendenza cellulare ma può essere stimolato dalla crescita cellulare. Il fattore induce e mantiene un livello elevato. Il gene della ciclina G contiene due diversi siti di legame di p53, uno dei quali è a monte del sito di inizio della trascrizione, suggerendo che p53 ha il potenziale per attivare efficacemente il gene della ciclina G. La ciclina H, che è un mediatore a valle di p53 almeno nell’effetto biologico, è una proteina con un peso molecolare di 37 kD trovata isolando e purificando la chinasi attivante CDK (CAK).
Funzione della ciclina
Lo studio della relazione tra ciclo cellulare e cancro ha un significato guida per la ricerca clinica oncologica. Può fornire alcuni obiettivi per il trattamento clinico, come il blocco della ciclina D, o imitare l’azione degli inibitori del ciclo cellulare per inibire la divisione cellulare del cancro, e fornire alcuni indicatori per la diagnosi clinica, la diagnosi differenziale e la prognosi. Michaelet al ha analizzato il riarrangiamento del gene bcl-1 e l’espressione della proteina della ciclina D1 in 32 casi di linfoma a cellule del mantello, 17 casi di riarrangiamento del gene bcl-1, e 24 casi di espressione citoplasmatica della ciclina D1, e 40 casi del gruppo di controllo solo 9 casi di linfoma a cellule B non-MCL erano positivi. Essi ritengono che la ciclina D1 possa essere usata come diagnosi differenziale del MCL e come diagnosi differenziale del linfoma a cellule B. La ciclina è espressa periodicamente nel ciclo cellulare, e certi specifici complessi ciclina-CDK sono richiesti per il passaggio attraverso un certo ciclo cellulare, suggerendo che la ciclina può essere usata come indicatore dello stato proliferativo delle cellule. Il rapporto di espressione di una certa ciclina può predire la proporzione di cellule in un certo tessuto in un certo ciclo cellulare. Più alta è la malignità delle cellule tumorali, più grave è il disordine del ciclo cellulare, quindi è possibile riflettere la prognosi dei pazienti attraverso le informazioni mostrate nel ciclo cellulare, e agire come un possibile indicatore prognostico. Keyomarsi et al. hanno utilizzato 9 casi di campioni chirurgici di cancro al seno e tessuti adiacenti non cancerosi come studi di controllo: In 8 casi di tessuto canceroso la ciclina E era espressa in modo anomalo in qualità e quantità, ed esistevano almeno 3 diversi pesi molecolari. La ciclina E era sovraespressa, mentre c-erbB2 è sovraespressa solo in 3 casi. Con l’aumento della stadiazione del tumore, il contenuto della proteina della ciclina E è aumentato significativamente, mentre il livello dell’antigene nucleare delle cellule proliferanti (PCNA) è aumentato solo leggermente. La struttura della ciclina E è stata osservata in 4 dei più alti gradi di stadiazione. Dutta et al. hanno usato anticorpi anticiclina A, B, E per rilevare 48 sezioni in paraffina di cancro al seno e hanno scoperto che l’indice medio positivo della ciclina A e B aumentava significativamente con l’aumento della fase S (P < 0,05). La ciclina A era correlata positivamente con Ki-67 e con la frazione della fase S (P < 0,05). Bellacosaet al hanno studiato 51 casi di carcinoma squamoso primario della laringe e li hanno seguiti per 29 mesi. Si ritiene che l’amplificazione del gene della ciclina possa essere usata come un indicatore prognostico indipendente per il cancro della laringe. Tuttavia, Bettiche et al. hanno studiato 53 casi di carcinoma polmonare non a piccole cellule con resezione chirurgica, e 25 casi avevano una sovraespressione della ciclina D1, che era associata a una scarsa differenziazione dei tessuti, una minore infiltrazione linfocitaria nel tumore e un minore tasso di recidiva locale (P < 0. 05). Essi ritengono che siano necessari studi clinici più ampi per verificare ulteriormente il significato prognostico dell’espressione della ciclina D1.
Riferimento
- He G, Kuang J, Koomen J, et al. Reclutamento dell’antigene nucleare delle cellule proliferanti trimerico da parte delle chinasi ciclina-dipendenti in fase G1 in seguito a danni al DNA con agenti antitumorali a base di platino. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Espressione temporale e spaziale della ciclina H nella lesione del midollo spinale del ratto. Medicina neuromolecolare. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. The Clinical Features and Expression of bcl-2, Cyclin D1, p53, and Proliferating Cell Nuclear Antigen in Syndromic and Nonsyndromic Keratocystic Odontogenic Tumor. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Overexpression of HOXB5, cyclin D1 and PCNA in congenital cystic adenomatoid malformation. Diagnosi fetale &Terapia. 2011, 29(4):315-320.
