Obiettivi di apprendimento
- Scrivere la formula chimica di un composto ionico semplice.
- Riconoscere gli ioni poliatomici nelle formule chimiche.
Abbiamo già incontrato alcune formule chimiche di composti ionici semplici. Una formula chimica è una lista concisa degli elementi in un composto e i rapporti di questi elementi. Per capire meglio cosa significa una formula chimica, dobbiamo considerare come un composto ionico è costruito dai suoi ioni.
I composti ionici esistono come ioni positivi e negativi alternati in matrici regolari e tridimensionali chiamate cristalli (Figura \(\PageIndex{1}}). Come potete vedere, non ci sono singole “particelle” di NaCl nella matrice; invece, c’è un reticolo continuo di ioni di sodio e cloruro alternati. Tuttavia, possiamo usare il rapporto tra ioni sodio e ioni cloruro, espresso nei numeri interi più bassi possibili, come un modo per descrivere il composto. Nel caso del cloruro di sodio, il rapporto tra ioni sodio e ioni cloruro, espresso in numeri interi più bassi, è 1:1, quindi usiamo NaCl (un simbolo Na e un simbolo Cl) per rappresentare il composto. Così, NaCl è la formula chimica per il cloruro di sodio, che è un modo conciso di descrivere il numero relativo di ioni diversi nel composto. Un campione macroscopico è composto da miriadi di coppie NaCl; ogni coppia è chiamata unità di formula. Anche se è conveniente pensare che i cristalli di NaCl siano composti da singole unità di NaCl, la figura \PageIndex{1} mostra che nessun singolo ione è associato esclusivamente a qualsiasi altro singolo ione. Ogni ione è circondato da ioni di carica opposta.
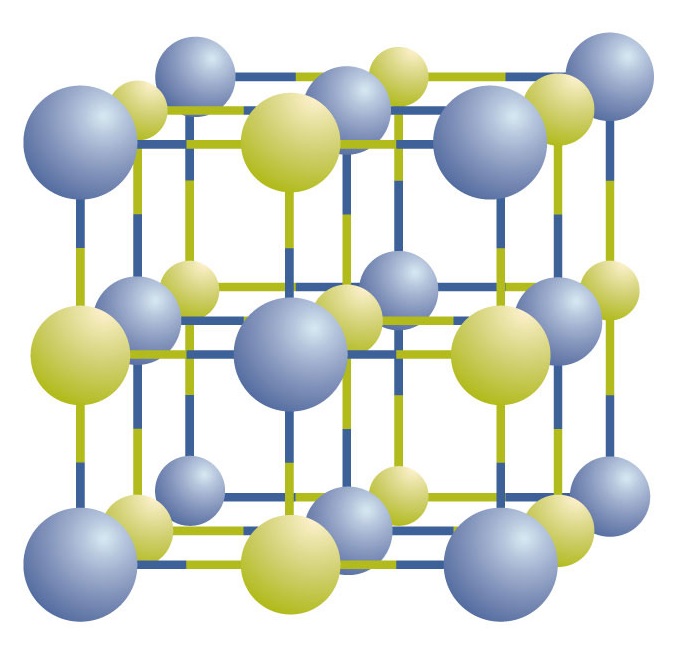
Figura \(\PageIndex{1}}) Un cristallo di cloruro di sodio. Un cristallo contiene una serie tridimensionale di ioni positivi e negativi alternati. Il modello preciso dipende dal composto. Un cristallo di cloruro di sodio, mostrato qui, è un insieme di ioni di sodio e cloro alternati.
La formula di un composto ionico segue diverse convenzioni. Primo, il catione è scritto prima dell’anione. Poiché la maggior parte dei metalli forma cationi e la maggior parte dei non metalli forma anioni, le formule tipicamente elencano prima il metallo e poi il non metallo. In secondo luogo, le cariche non sono scritte in una formula. Ricordate che in un composto ionico, le specie componenti sono ioni, non atomi neutri, anche se la formula non contiene cariche. Infine, la formula corretta per un composto ionico obbedisce sempre alla seguente regola: la carica positiva totale deve essere uguale alla carica negativa totale. Per determinare la formula corretta di qualsiasi combinazione di ioni, determinare quanti di ogni ione sono necessari per bilanciare il totale delle cariche positive e negative nel composto.
Questa regola si basa in definitiva sul fatto che la materia è, nel complesso, elettricamente neutra.
Per convenzione, assumiamo che ci sia un solo atomo se non è presente un pedice. Non usiamo 1 come pedice.
Se guardiamo il composto ionico formato da ioni litio e ioni bromuro, vediamo che lo ione litio ha una carica 1+ e lo ione bromuro ha una carica 1-. Solo uno ione di ciascuno è necessario per bilanciare queste cariche. La formula del bromuro di litio è LiBr.
Quando un composto ionico è formato da magnesio e ossigeno, lo ione di magnesio ha una carica 2+ e l’atomo di ossigeno ha una carica 2-. Anche se entrambi questi ioni hanno cariche più alte degli ioni nel bromuro di litio, si bilanciano comunque in un rapporto uno a uno. Pertanto, la formula corretta per questo composto ionico è MgO.
Pensiamo ora al composto ionico formato da magnesio e cloro. Uno ione di magnesio ha una carica 2+, mentre uno ione di cloro ha una carica 1:
Mg2+ Cl-
La combinazione di uno ione di ciascuno non bilancia completamente le cariche positive e negative. Il modo più semplice per bilanciare queste cariche è assumere la presenza di due ioni cloruro per ogni ione di magnesio:
Mg2+ Cl- Cl-
Ora le cariche positive e negative sono bilanciate. Potremmo scrivere la formula chimica per questo composto ionico come MgClCl, ma la convenzione è di usare un pedice numerico quando c’è più di uno ione di un dato tipo-MgCl2. Questa formula chimica dice che ci sono uno ione magnesio e due ioni cloruro in questa formula. (Non leggere la parte “Cl2” della formula come una molecola del cloro elementare biatomico. Il cloro non esiste come elemento biatomico in questo composto. Piuttosto, esiste come due ioni cloruro individuali). Per convenzione, nelle formule dei composti ionici si usa il più basso rapporto di numeri interi. La formula Mg2Cl4 ha cariche bilanciate con gli ioni in un rapporto 1:2, ma non è il più basso rapporto di numeri interi.
Per convenzione, il più basso rapporto di numeri interi degli ioni è usato nelle formule ioniche. Ci sono eccezioni per alcuni ioni, come Hg22+
Esempio \(\PageIndex{1})
Scrivi la formula chimica per un composto ionico composto da ogni coppia di ioni.
- lo ione sodio e lo ione zolfo
- lo ione alluminio e lo ione fluoruro
- lo ione ferro 3+ e lo ione ossigeno
Soluzione
- Per ottenere un ottetto di valenza, il sodio forma uno ione con carica 1+, mentre lo ione zolfo ha carica 2. Sono necessari due ioni 1+ di sodio per bilanciare la carica 2 dello ione zolfo. Piuttosto che scrivere la formula come NaNaS, la abbreviamo per convenzione in Na2S.
- Lo ione alluminio ha una carica 3+, mentre lo ione fluoro formato dal fluoro ha una carica 1-. Tre ioni fluoro 1- sono necessari per bilanciare la carica 3+ dello ione alluminio. Questa combinazione si scrive come AlF3.
- Il ferro può formare due possibili ioni, ma qui è specificato lo ione con carica 3+. L’atomo di ossigeno ha una carica 2 come ione. Per bilanciare le cariche positive e negative, guardiamo al minimo comune multiplo-6: due ioni ferro 3+ daranno 6+, mentre tre ioni ossigeno 2- daranno 6-, bilanciando così le cariche positive e negative complessive. Quindi, la formula di questo composto ionico è Fe2O3.
Esercizio \(\PageIndex{1})
Scrivi la formula chimica di un composto ionico composto da ogni coppia di ioni.
- lo ione calcio e lo ione ossigeno
- lo ione rame 2+ e lo ione zolfo
- lo ione rame 1+ e lo ione zolfo
Ioni poliatomici
Alcuni ioni sono formati da gruppi di atomi legati insieme e hanno una carica elettrica complessiva. Poiché questi ioni contengono più di un atomo, sono chiamati ioni poliatomici. Gli ioni poliatomici hanno formule, nomi e cariche caratteristiche che dovrebbero essere memorizzate. Per esempio, NO3- è lo ione nitrato; ha un atomo di azoto e tre atomi di ossigeno e una carica complessiva di 1. La tabella \(\PageIndex{1}}) elenca gli ioni poliatomici più comuni.
| Nome | Formula |
|---|---|
| ione ammonio | NH4+ |
| ione acetato | C2H3O2- |
| Ione carbonato | CO32- |
| Ione idrogeno carbonato (ione bicarbonato) | HCO3- |
| Ione cianuro | CN- |
| Ione idrossido | OH- |
| Ione fosfato | PO43- |
| Ione idrogeno fosfato | HPO42- |
| Ione diidrogeno fosfato | H2PO4- |
| Ione nitrato | NO3- |
| Ione solfito | SO32- |
La regola per costruire le formule dei composti ionici che contengono ioni poliatomici è la stessa delle formule che contengono ioni monoatomici (singoloatomo): le cariche positive e negative devono bilanciarsi. Se più di uno di un particolare ione poliatomico è necessario per bilanciare la carica, l’intera formula per lo ione poliatomico deve essere racchiusa tra parentesi, e il pedice numerico è posto fuori dalle parentesi. Questo per mostrare che il pedice si applica all’intero ione poliatomico. Un esempio è Ba(NO3)2.
Esempio \(\PageIndex{2})
Scrivi la formula chimica per un composto ionico composto da ogni coppia di ioni.
- lo ione potassio e lo ione solfato
- lo ione calcio e lo ione nitrato
Soluzione
- Gli ioni potassio hanno una carica di 1+, mentre gli ioni solfato hanno una carica di 2-. Avremo bisogno di due ioni di potassio per bilanciare la carica dello ione solfato, quindi la formula chimica corretta è K2SO4.
- Gli ioni di calcio hanno una carica di 2+, mentre gli ioni di nitrato hanno una carica di 1-. Avremo bisogno di due ioni nitrato per bilanciare la carica di ogni ione calcio. La formula del nitrato deve essere racchiusa tra parentesi. Così, scriviamo Ca(NO3)2 come formula per questo composto ionico.
Esercizio \(\PageIndex{2})
Scrivi la formula chimica per un composto ionico composto da ogni coppia di ioni.
- lo ione magnesio e lo ione carbonato
- lo ione alluminio e lo ione acetato
Riconoscere i composti ionici
Ci sono due modi per riconoscere i composti ionici. In primo luogo, i composti tra elementi metallici e non metallici sono solitamente ionici. Per esempio, CaBr2 contiene un elemento metallico (calcio, un metallo del gruppo 2A) e un elemento non metallico (bromo, un non metallo del gruppo 7A). Pertanto, è molto probabilmente un composto ionico. (Al contrario, il composto NO2 contiene due elementi che sono entrambi non metallici (azoto, dal gruppo 5A, e ossigeno, dal gruppo 6A). Non è un composto ionico; appartiene alla categoria dei composti covalenti discussi altrove. Notate anche che questa combinazione di azoto e ossigeno non ha carica elettrica specificata, quindi non è lo ione nitrito.
In secondo luogo, se riconoscete la formula di uno ione poliatomico in un composto, il composto è ionico. Per esempio, se vedi la formula Ba(NO3)2, puoi riconoscere la parte “NO3” come lo ione nitrato, \rm{NO_3^-}\). (Ricorda che la convenzione per scrivere le formule per i composti ionici è di non includere la carica ionica). Questo è un indizio che l’altra parte della formula, Ba, è in realtà lo ione Ba2+, con la carica 2+ che bilancia la carica 2 complessiva dei due ioni nitrato. Quindi, anche questo composto è ionico.
Esempio \(\PageIndex{3})
Identifica ogni composto come ionico o non ionico.
- Na2O
- PCl3
- NH4Cl
- OF2
Soluzione
- Il sodio è un metallo, e l’ossigeno è un non-metallo; quindi, Na2O dovrebbe essere ionico. Pertanto, PCl3 non è ionico.
- L’NH4 nella formula rappresenta lo ione ammonio, NH4+, il che indica che questo composto è ionico.
- Entrambi l’ossigeno e il fluoro sono non-metalli. Pertanto, OF2 non è ionico.
Esercizio \(\PageIndex{3})
Identifica ogni composto come ionico o non ionico.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Guardando più da vicino: Sangue e acqua di mare
La scienza ha riconosciuto da tempo che il sangue e l’acqua di mare hanno composizioni simili. Dopo tutto, entrambi i liquidi hanno composti ionici disciolti in essi. La somiglianza può essere più di una semplice coincidenza; molti scienziati pensano che le prime forme di vita sulla Terra siano nate negli oceani. Uno sguardo più attento, tuttavia, mostra che il sangue e l’acqua di mare sono molto diversi. Una soluzione allo 0,9% di cloruro di sodio si avvicina alla concentrazione di sale che si trova nel sangue. Al contrario, l’acqua di mare è principalmente una soluzione di cloruro di sodio al 3%, più di tre volte la concentrazione nel sangue. Ecco un confronto delle quantità di ioni nel sangue e nell’acqua di mare:
| Ione | Percento in acqua di mare | Percento in sangue |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl- | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
La maggior parte degli ioni sono più abbondanti in acqua di mare che nel sangue, con alcune importanti eccezioni. Ci sono molti più ioni idrogeno carbonato (HCO3-) nel sangue che nell’acqua di mare. Questa differenza è significativa perché lo ione idrogeno carbonato e alcuni ioni correlati hanno un ruolo cruciale nel controllo delle proprietà acido-base del sangue. La quantità di ioni idrogeno fosfato-HPO42- e H2PO4- nell’acqua di mare è molto bassa, ma sono presenti in quantità maggiori nel sangue, dove influenzano anche le proprietà acido-base. Un’altra differenza notevole è che il sangue non ha quantità significative dello ione solfato (SO42-), ma questo ione è presente nell’acqua di mare.
Punti chiave
- Le formule chimiche corrette per i composti ionici equilibrano la carica positiva totale con la carica negativa totale.
- Esistono anche gruppi di atomi con una carica complessiva, chiamati ioni poliatomici.
Contribuenti e attribuzioni
-
Anonimo
