Results
Figura 1
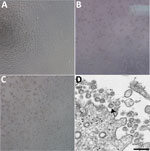
Figura 1. Súlyos akut légzőszervi szindrómás coronavírus 2 által okozott citopátiás hatás coronavírusos betegből, Egyesült Államok, 2020. A-C) Vero sejtmonolayerek fáziskontraszt mikroszkópiája 3 nappal a beoltás után: A) Mock,…
2020. január 22-én Washington államban egy beteget azonosítottak megerősített COVID-19 vírusfertőzéssel. A CPE nem volt megfigyelhető a mock-fertőzött sejtekben (1. ábra, A panel). A ciklikus küszöbérték (Ct) az NP minták esetében 18-20, az OP minták esetében 21-22 volt (1). A pozitív klinikai mintákat aliquotálták, és 2020. január 22-én újrafagyasztva beoltották sejtkultúrába. A CPE-t 2 nappal a beoltás után figyeltük meg, és a víruslizátumot a beoltás utáni 3. napon gyűjtöttük be (1. ábra, B, C panelek). Az 1. passzázsból 50 μl víruslizátumot használtunk fel nukleinsavkivonáshoz, hogy a CDC molekuláris diagnosztikai próbájával (1) megerősítsük a SARS-CoV-2 jelenlétét. A 3 nukleinsavkivonat Ct-értékei 16,0-17,1 voltak az 1. nukleokapszidrészre, 15,9-17,1 a 2. nukleokapszidrészre és 16,2-17,3 a 3. nukleokapszidrészre, ami megerősítette a SARS-CoV-2 izolálását (Ct <40 pozitív eredménynek minősül). A Fast Track 33 Assay segítségével további 33 különböző légúti kórokozóra is teszteltük a kivonatokat. Más kórokozót nem mutattunk ki. Az azonosságot ezenfelül vékonymetszeti elektronmikroszkópia is alátámasztotta (1. ábra, D panel). A koronavírusokra jellemző morfológiát és morfogenezist figyeltünk meg.
Egy OP és egy NP minta első passzázsából származó izolátumokat használtunk teljes genomszekvenáláshoz. Az NP-mintából (GenBank-csatlakozási szám: MT020880) és az OP-mintából (GenBank-csatlakozási szám: MT020881) származó genomok 100%-os azonosságot mutattak egymással. Az izolátumok 100%-os azonosságot mutattak a megfelelő klinikai mintával (GenBank accession no. MN985325) is.
A második passzázs után nem tenyésztettük külön az OP és NP mintákat. A vírusizolátumot még 2-szer passziváltuk Vero CCL-81 sejtekben, és az 50%-os szövettenyésztési fertőző dózis (TCID50) meghatározásával titráltuk. A titerek 8,65 × 106 TCID50/ml voltak a harmadik passzázsnál és 7,65 × 106 TCID50/ml a negyedik passzázsnál.
Ezt a vírust tripszin hiányában passzíroztuk. A SARS-CoV-2 spike fehérje szekvenciája egy RRAR inszerciót tartalmaz az S1-S2 határfelületen, amelyet a furin hasíthat (16). A magas patogenitású madárinfluenza-vírusok a HA1-HA2 hemagglutinin fehérje HA1-HA2 interfészénél erősen bázikus furin hasítóhelyekkel rendelkeznek, amelyek lehetővé teszik a virionok intracelluláris érését és a hatékonyabb vírusreplikációt (17). A SARS-CoV-2-ben található RRAR inszerció hasonló funkciót tölthet be.
2. ábra
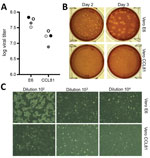
2. ábra. A súlyos akut légzőszervi szindrómás coronavírus 2 vírusterjedése és mennyiségi meghatározása coronavírusos betegből, Egyesült Államok, 2020. A) Két vírus 4. passzázsának állományát (fekete és szürke körök) számszerűsítettük…
Ezt követően a SARS-CoV-2 negyedik passzázsának állományát VeroE6 sejteken, egy másik magzati rhesusmajom vesesejtvonalon hoztuk létre. Szekvenáltuk a SARS-CoV-2 4. passzázs állományból származó vírus-RNS-t, és megerősítettük, hogy az nem tartalmaz nukleotidmutációkat az eredeti referenciaszekvenciához képest (GenBank hozzáférési szám: MN985325). A SARS-CoV jól szaporodik VeroE6 sejteken, a MERS-CoV pedig Vero CCL81 sejteken (18,19). A plakk-teszt létrehozásához és a mennyiségi meghatározáshoz előnyben részesített Vero sejttípus meghatározásához a 4. passzázsból származó állományunkat VeroE6 és VeroCCL81 sejteken titerizáltuk. A hígítási sorozattal történő fertőzést követően a SARS-CoV-2 mindkét Vero sejttípusban szaporodott; a vírustiterek azonban a VeroE6 sejtekben valamivel magasabbak voltak, mint a Vero CCL81 sejtekben (2. ábra, A panel). Ezenkívül a plakkok jobban elkülönültek és láthatóbbak voltak a Vero E6 sejteken (2. ábra, B panel). A VeroE6 sejtek már 2 nappal a beoltás után különálló plakkokat hoztak létre, amelyek semleges vörössel történő festéssel láthatóak voltak. Ezzel szemben a Vero CCL81 sejtek kevésbé egyértelmű plakkokat termeltek, és a legkönnyebben semleges vörössel történő festéssel volt számszerűsíthető 3 nappal a beoltás után. Az egyes plakk-monolayereken a Vero E6 sejtek SARS-CoV-2 fertőzése CPE-t hozott létre, a sejtek letisztult területeivel (2. ábra, C panel). Ezzel szemben a Vero CCL81 sejteken elhalt sejtek területei voltak, amelyek plakkokba olvadtak, de a sejtek nem tisztultak ki. Ezek az eredmények együttesen azt sugallják, hogy a VeroE6 sejtek lehetnek a legjobb választás az amplifikációra és a mennyiségi meghatározásra, de mindkét Vero sejttípus támogatja a SARS-CoV-2 amplifikációját és replikációját.
3. ábra
3. ábra. SARS-koronavírus 2 (SARS-CoV-2) iránt fogékony, koronavírusos betegből származó sejtvonalak, Egyesült Államok, 2020. A sejtvonalakat magas fertőzési multiplicitással (>5) fertőztük, adszorpció után mostuk, és…
Mivel a SARS-CoV-2 tanulmányozására és az arra való reagálásra irányuló kutatásokat kezdeményeztek, szükség van a fertőzésre fogékony sejtvonalakra és típusokra vonatkozó információkra. Ezért megvizsgáltuk a SARS-CoV-2 fertőzési és szaporodási képességét több elterjedt főemlős és humán sejtvonalban, köztük humán adenokarcinóma sejtekben (A549), humán májsejtekben (HUH7.0) és humán embrionális vesesejtekben (HEK-293T), valamint Vero E6 és Vero CCL81 sejtekben. Egy rendelkezésre álló nagy barna denevérvese sejtvonalat (EFK3B) is megvizsgáltunk SARS-CoV-2 replikációs képesség szempontjából. Mindegyik sejtvonalat nagy fertőzési multiplicitással oltottuk be, és 24 órával a fertőzés után vizsgáltuk (3. ábra, A panel). Egyik sejtvonalban sem észleltünk CPE-t, kivéve a Vero sejteket, amelyek a fertőzést követő 24 órában >107 PFU-ra növekedtek. Ezzel szemben a HUH7.0 és a 293T sejtek csak szerény vírusreplikációt mutattak, az A549 sejtek pedig inkompatibilisek voltak a SARS-CoV-2 fertőzéssel. Ezek az eredmények összhangban vannak a SARS-CoV-ra vonatkozó korábbi érzékenységi eredményekkel, és arra utalnak, hogy más gyakori tenyésztési rendszerek, beleértve az MDCK, HeLa, HEP-2, MRC-5 sejteket és az embriózott tojásokat, valószínűleg nem támogatják a SARS-CoV-2 replikációt (20-22). Ezenkívül a SARS-CoV-2 nem szaporodott denevér EFK3B sejtekben, amelyek fogékonyak a MERS-CoV-ra. Az eredmények együttesen azt jelzik, hogy a SARS-CoV-2 a SARS-CoV-hoz hasonló profilt tart fenn a fogékony sejtvonalak tekintetében.
Miután több sejttípusban robusztus fertőzést hoztunk létre a SARS-CoV-2-vel, ezután a SARS-CoV-2 ellenes antitestek keresztreaktivitását vizsgáltuk. A fertőzött sejtvonalakból származó sejtlizátumokat fehérjeanalízisre szondáztuk; azt találtuk, hogy a SARS-CoV tüskefehérje és a nukleokapszid fehérjék elleni poliklonális szérum felismeri a SARS-CoV-2-t (3. ábra, B, C panelek). A nukleokapszid fehérje, amely erősen konzervált az egész 2B csoportos családban, >90%-os aminosav azonosságot mutat a SARS-CoV és a SARS-CoV-2 között. A replikációs eredményekkel összhangban (3. ábra, A panel) a SARS-CoV-2 mindkét Vero sejttípusban erőteljes nukleokapszid fehérjét mutatott, kevesebb fehérjét HUH7.0 és 293T sejtekben, és minimális fehérjét A549 és EFK3B sejtekben (3. ábra, B panel). A SARS-CoV spike protein antitest a SARS-CoV-2 spike proteinjét is felismerte, ami keresztreaktivitásra utal (3. ábra, C panel). A SARS-CoV-val összhangban a SARS-CoV-2 spike fehérjének több hasított és nem hasított formája volt megfigyelhető. A Calu3 sejtekből, egy légzőszervi sejtvonalból származó SARS spike pozitív kontroll hasítási mintázata kissé eltér, ami a SARS-CoV-2-ben előre jelzett furin hasítóhely beillesztése miatt a 2 vírus között a spike fehérjék proteolitikus hasítása közötti különbségekre utalhat (16). A sejttípus és a körülmények közötti különbségek azonban megnehezítik ezt az értelmezést, és azt jelzik, hogy további vizsgálatokra van szükség egyenértékű rendszerekben. Összességében a SARS-CoV nukleokapszid és spike protein antitestek fehérjeexpressziós adatai összefoglalják a replikációs eredményeket, és azt jelzik, hogy a SARS-CoV-reagensek felhasználhatók a SARS-CoV-2 fertőzés jellemzésére.
4. ábra
4. ábra. A súlyos akut légzőszervi szindrómás koronavírus 2 többlépcsős növekedési görbéje koronavírusos betegből, Egyesült Államok, 2020. Vero CCL81 (fekete) és HUH7.0 sejteket (zöld) fertőztünk…
Végezetül a SARS-CoV-2 szaporodási kinetikáját többlépcsős növekedési görbén értékeltük. Röviden, Vero CCL-81 és HUH7.0 sejteket fertőztünk SARS-CoV-2-vel alacsony fertőzési multiplicitással (0,1), és a vírus replikációját 6 óránként értékeltük 72 órán keresztül a beoltás után, a sejt-asszociált és a felülúszó kompartmentben történő külön gyűjtésekkel (4. ábra). A SARS-CoV-hoz hasonlóan a SARS-CoV-2 is gyorsan szaporodott a Vero sejtekben a kezdeti fogyatkozási fázist követően, 24 órával a fertőzést követően elérte a 105 TCID50/ml értéket, és >106 TCID50/ml értéken tetőzött. Hasonló titereket figyeltünk meg a sejt-asszociált és a felülúszó kompartmentekben, ami hatékony kilépésre utal. Annak ellenére, hogy a vírustiterek 48 órával a beoltás után tetőztek, a nagyobb CPE-t csak 60 órával a beoltás után figyeltük meg, és 72 órával a beoltás után tetőzött, ami azt jelzi, hogy a fertőzött monolayereket a CPE csúcsának megfigyelése előtt le kell szedni. A HUH7.0 sejtekben a szaporodás szintén gyorsan nőtt a kezdeti fogyatkozási fázist követően, de 24 órával a beoltás után az intracelluláris kompartmentben 2 × 103 TCID50/ml-nél elérte a platóját, és 66 órával a beoltás után csökkent. A vírus a fertőzött HUH7 sejtek felülúszójában 36 óráig nem volt kimutatható, és minden időpontban alacsonyabb titereket mutatott (4. ábra). HUH7.0 sejtekben soha nem figyeltek meg nagyobb CPE-t. Ezek az eredmények összhangban vannak a SARS-CoV és a MERS-CoV korábbi jelentéseivel, amelyek a zoonózisos CoV-törzsek hasonló replikációs dinamikájára utaltak (23,24).
