Generikus név: lidokain-hidroklorid
Adagolási forma: helyi zselé
A Drugs.com által orvosilag felülvizsgált. Utolsó frissítés: 2020. október 1.
- Áttekintés
- Mellékhatások
- Adagolás
- Szakorvosi
- Interakciók
- Tovább
Csak
- LEÍRÁS
- KLINIKAI FARMAKOLÓGIA
- HATÁS ÉS ALKALMAZÁS
- VISSZAVALLATOK
- FIGYELMEZTETÉSEK
- FELHATÁSOK
- Vemhességben való alkalmazás:
- Mellékhatások
- TÚLADAGOLÁS
- ADAGOLÁS ÉS ADAGOLÁS
- MAGAS Dózis
- HOW SUPPLIED
- Tovább a lidokain helyi alkalmazásáról
- Fogyasztói források
- Szakmai források
- Szakmai források
- Kapcsolódó kezelési útmutatók
LEÍRÁS
A lidokain HCI 2% zselé steril, vizes készítmény, amely helyi érzéstelenítő hatóanyagot tartalmaz és helyileg alkalmazzák. (A konkrét felhasználási célokat lásd az INDIKÁCIÓK között.)
A lidokain HCI 2% zselé lidokain HCI-t tartalmaz, amelynek kémiai megnevezése acetamid, 2-(dietilamino)-N-(2,6-dimetilfenil)-,monohidroklorid és a következő szerkezeti képletű:
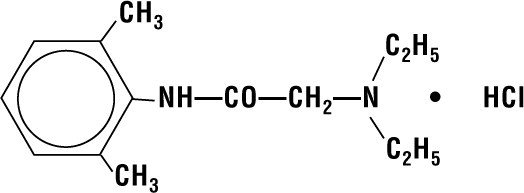
Molekulaformulája C14H22N2O – HCI és molekulatömege 270 db.80.
A Lidocain HCI 2%-os zselé hipromellózt is tartalmaz, és az így kapott keverék maximalizálja a nyálkahártyával való érintkezést, és kenést biztosít a műszeres kezeléshez. A fel nem használt részt az első használat után el kell dobni.
A Lidocaine HCI 2% Jelly 30 ml-es és 5 ml-es tubusok összetétele: Minden ml 20 mg lidokain HCI-t tartalmaz. A készítmény metilparabént, propilparabént, hipromellózt és nátrium-hidroxidot és/vagy sósavat is tartalmaz a pH 6,0 és 7,0 közötti beállításához.
KLINIKAI FARMAKOLÓGIA
Hatásmechanizmus: A lidokain stabilizálja a neuronális membránt az impulzusok megindulásához és vezetéséhez szükséges ionáramlások gátlásával, ezáltal helyi érzéstelenítő hatást fejt ki.
A hatás kezdete: A hatás kezdete 3-5 perc. Érintetlen bőrön alkalmazva hatástalan.
Hemodinamika: A túlzott vérszintek változásokat okozhatnak a szívtérfogatban, a teljes perifériás ellenállásban és az artériás középnyomásban. Ezek a változások a helyi érzéstelenítő szer közvetlen depresszív hatásának tulajdoníthatók a szív- és érrendszer különböző összetevőire.
Farmakokinetika és anyagcsere: A lidokain a nyálkahártyákra történő helyi alkalmazást követően felszívódhat, a felszívódás mértéke és mértéke a koncentrációtól és a beadott teljes dózistól, az alkalmazás konkrét helyétől és az expozíció időtartamától függ. Általánosságban elmondható, hogy a helyi érzéstelenítő szerek felszívódási sebessége a helyi alkalmazást követően a leggyorsabban az intratracheális beadást követően következik be. A lidokain a gasztrointesztinális traktusból is jól felszívódik, de a májban történő biotranszformáció miatt kevés intakt hatóanyag jelenhet meg a keringésben.
A lidokain a májban gyorsan metabolizálódik, a metabolitok és a változatlan hatóanyag a vesén keresztül ürül. A biotranszformáció magában foglalja az oxidatív N-dealkilezést, a gyűrű hidroxilezést, az amidkötés hasítását és a konjugációt. Az N-dealkilezés, a biotranszformáció egyik fő útvonala, a monoetilglicinexilidid és a glicinexilidid metabolitokat eredményezi. E metabolitok farmakológiai/toxikológiai hatása hasonló, de kevésbé erős, mint a lidokainé. A beadott lidokain körülbelül 90%-a különböző metabolitok formájában ürül ki, és kevesebb mint 10%-a ürül ki változatlan formában. A vizeletben az elsődleges metabolit a 4-hidroxi-2,6-dimetil-lanilin konjugátja.
A lidokain plazmában való kötődése a gyógyszerkoncentrációtól függ, és a koncentráció növekedésével csökken a megkötött frakció. A szabad bázis 1-4 mcg/ml koncentrációjánál a lidokain 60-80 százaléka fehérjéhez kötődik. A kötődés az alfa-I-sav glikoprotein plazmakoncentrációjától is függ.
A lidokain átjut a vér-agy és a placentáris gáton, feltehetően passzív diffúzióval.
A lidokain metabolizmusának intravénás bolusinjekciót követő vizsgálatai azt mutatták, hogy a szer eliminációs felezési ideje jellemzően 1,5-2,0 óra. A lidokain gyors metabolizációs sebessége miatt a májműködést befolyásoló bármely állapot megváltoztathatja a lidokain kinetikáját. Májműködési zavarban szenvedő betegeknél a felezési idő kétszeresére vagy többszörösére is meghosszabbodhat. A veseműködési zavar nem befolyásolja a lidokain kinetikáját, de fokozhatja a metabolitok felhalmozódását.
Az olyan tényezők, mint az acidózis és a CNS stimulánsok és depresszánsok alkalmazása befolyásolják a lidokainnak a szisztémás hatások kifejeződéséhez szükséges CNS-szintjét. Az objektív káros manifesztációk egyre nyilvánvalóbbá válnak a vénás plazmaszintek 6 mcg szabad bázis/ml feletti emelkedésével. A rhesus majomban a 18-21 mcg/ml artériás vérszintek a görcsös aktivitás küszöbértékének bizonyultak.
HATÁS ÉS ALKALMAZÁS
A lidokain HCI 2%-os zselé a férfi és női húgycsővel kapcsolatos eljárások során fellépő fájdalom megelőzésére és csillapítására, a fájdalmas húgycsőgyulladás helyi kezelésére, valamint endotracheális intubáció (orális és orális) érzéstelenítő kenőanyagaként javallott.
VISSZAVALLATOK
A lidokain ellenjavallt olyan betegeknél, akiknél ismert az amid típusú helyi érzéstelenítőkkel vagy a Lidocain HCI 2%-os zselé egyéb összetevőivel szembeni túlérzékenység.
FIGYELMEZTETÉSEK
A túl nagy adagolás vagy az adagok közötti rövid időközök magas plazmaszintet és súlyos mellékhatásokat eredményezhetnek. A BETEGEKET ARRA KELL UTASÍTANI, HOGY SZIGORÚAN TARTSÁK BE A JELEN BETEGTÁJÉKOZTATÓBAN MEGHATÁROZOTT AJÁNLOTT ADAGOLÁSI ÉS ALKALMAZÁSI ELŐÍRÁSOKAT.
Az endotracheális tubus kenésére történő alkalmazáskor ügyelni kell arra, hogy a termék ne kerüljön a tubus lumenébe. Ne használja a zselét az endotracheális stiletták kenésére. Ha a zselé a belső lumenbe kerül, a zselé a belső felületen megszáradhat, és maradványt hagyhat maga után, amely hajlításkor hajlamos csomósodni, szűkítve a lument. Ritkán előfordult, hogy ez a maradék a lumen elzáródását okozta. (Lásd még: MELLÉKHATÁSOK és ADAGOLÁS ÉS ALKALMAZÁS.)
FELHATÁSOK
Általános: A lidokain biztonságossága és hatékonysága a megfelelő adagolástól, a helyes technikától, a megfelelő óvintézkedésektől és a vészhelyzetekre való felkészültségtől függ. (Lásd: FIGYELMEZTETÉSEK és MELLÉKHATÁSOK.) A magas plazmaszint és a súlyos mellékhatások elkerülése érdekében a legalacsonyabb adagot kell alkalmazni, amely hatékony érzéstelenítést eredményez. A lidokain ismételt adagolása a gyógyszer vagy metabolitjainak lassú felhalmozódása miatt minden egyes ismételt adaggal jelentős vérszintnövekedést okozhat. Az emelkedett vérszintekkel szembeni tolerancia a beteg állapotától függően változik. Legyengült, idős betegeknek, akut betegeknek és gyermekeknek életkoruknak és fizikai állapotuknak megfelelő, csökkentett adagokat kell adni. A lidokain súlyos sokkban vagy szívblokkban szenvedő betegeknél is óvatosan alkalmazható.
A Lidocain HCI 2%-os zselé ismert gyógyszerérzékenységben szenvedő betegeknél óvatosan alkalmazható. A para-aminobenzoesav-származékokra (prokain, tetrakain, benzokain stb.) allergiás betegek nem mutattak keresztérzékenységet a lidokainra.
Az altatás során alkalmazott számos gyógyszer a familiáris malignus hipertermia potenciális kiváltójának tekinthető. Mivel nem ismert, hogy az amid típusú helyi érzéstelenítők kiválthatják-e ezt a reakciót, és mivel a kiegészítő általános érzéstelenítés szükségességét nem lehet előre megjósolni, javasolt, hogy rendelkezésre álljon egy standard protokoll a kezelésre. A korai, megmagyarázhatatlan tachycardia, tachypnoe, labilis vérnyomás és metabolikus acidózis jelei megelőzhetik a hőmérséklet emelkedését. A sikeres kimenetel a korai diagnózistól, a feltételezett kiváltó szer(ek) azonnali abbahagyásától és a kezelés megkezdésétől függ, beleértve az oxigénterápiát, az indikált támogató intézkedéseket és a dantrolént (használat előtt olvassa el a dantrolén-nátrium intravénás alkalmazási előírást).
Tájékoztatás a betegeknek: Helyi érzéstelenítők szájban történő alkalmazásakor a betegnek tisztában kell lennie azzal, hogy a helyi érzéstelenítés előállítása károsíthatja a nyelést, és így fokozhatja az aspiráció veszélyét. Ezért a szájban vagy a torok területén alkalmazott helyi érzéstelenítő készítmények alkalmazását követően 60 percig nem szabad ételt bevenni. Ez különösen fontos gyermekeknél, mivel ők gyakrabban esznek.
A nyelv vagy a szájnyálkahártya zsibbadása fokozhatja az akaratlan harapási trauma veszélyét. A száj vagy a garat területének érzéstelenítése közben nem szabad ételt vagy rágógumit fogyasztani.
Karcinogenezis – Állatokon végzett hosszú távú vizsgálatokat nem végeztek a lidokain karcinogén potenciáljának értékelésére.
Mutagenezis – A lidokain mutagén potenciálját vizsgálták az Ames-féle Salmonella reverz mutációs teszttel és in vitro kromoszóma-aberrációs teszttel emberi limfocitákon, valamint in vivo egér mikronukleusz teszttel. Ezek a vizsgálatok nem utaltak mutagén hatásra.
A termékenység károsodása – A lidokain termékenységre gyakorolt hatását patkánymodellben vizsgálták. A 30 mg/kg, s.c. (180 mg/m2) adagolása a párzó párnak nem okozott változásokat a patkányok termékenységében vagy általános reprodukciós teljesítményében. Nincs olyan vizsgálat, amely a lidokain spermaparaméterekre gyakorolt hatását vizsgálta volna. Nem volt bizonyíték a termékenység megváltozására.
Vemhességben való alkalmazás:
Teratogén hatások: B terhességi kategória.
Patkányokon és nyulakon egyaránt végeztek reprodukciós vizsgálatokat a lidokainra vonatkozóan. A patkánymodellben 50 mg/kg lidokain szubkután dózisig (300 mg/m2 testfelületre vonatkoztatva) nem volt bizonyíték a magzat károsodására. A nyúlmodellben nem volt bizonyíték a magzat károsodására 5 mg/kg sz.c. dózis (60 mg/m2 a testfelületre vonatkoztatva) esetén. A nyulak 25 mg/kg (300 mg/m2) adaggal történő kezelése az anyai toxicitás és a magzati fejlődés késleltetésének bizonyítékát eredményezte, beleértve a magzati súly nem szignifikáns csökkenését (7%) és a kisebb csontrendszeri rendellenességek (koponya- és szegycsontdefektus, az ujjpercek csökkent csontosodása) növekedését. A lidokainnak a születés utáni fejlődésre gyakorolt hatását patkányokon úgy vizsgálták, hogy vemhes nőstény patkányokat naponta szubkután kezeltek 2, 10 és 50 mg/kg (12, 60 és 300 mg/m2 ) dózisban a vemhesség 15. napjától a szülés utáni 20. napig. A 10 mg/kg (60 mg/m2) dózisig bezárólag sem az anyaállatokban, sem a kölykökben nem észleltek káros hatásokra utaló jeleket; 50 mg/kg (300 mg/m2) adagolásnál azonban csökkent a túlélő kölykök száma, mind a születéskor, mind a laktációs időszak alatt, és ez a hatás valószínűleg az anyai toxicitás következménye. Ebben a vizsgálatban az alom méretére, az alom súlyára, a kölykök rendellenességeire és a kölykök fizikai fejlődésére semmilyen más hatást nem tapasztaltak.
Egy második vizsgálat a lidokainnak a születés utáni fejlődésre gyakorolt hatását vizsgálta patkányon, amely a kölykök értékelését foglalta magában az elválasztástól az ivarérettségig. A patkányokat 8 hónapon keresztül 10 vagy 30 mg/kg s.c. lidokainnal kezelték (60 mg/m2 és 180 mg/m2 testfelületre vonatkoztatva). Ez az időszak 3 párzási időszakot foglalt magában. Nem volt bizonyíték a születés utáni fejlődés megváltozására egyik utódnál sem; azonban mindkét lidokain dózis jelentősen csökkentette az első 2 párzási időszakból származó utódok elválasztásáig almonként túlélő kölykök átlagos számát.
Vemhes nőkön azonban nincsenek megfelelő és jól kontrollált vizsgálatok. Mivel az állatokon végzett reprodukciós vizsgálatok nem mindig jósolják meg az emberi reakciót, ezt a gyógyszert terhesség alatt csak akkor szabad alkalmazni, ha egyértelműen szükséges.
Vemhesség és szülés: A lidokain nem ellenjavallt vajúdás és szülés során. Amennyiben a Lidocaine HCl 2% Jelly-t más lidokain tartalmú készítményekkel egyidejűleg alkalmazzák, az összes készítmény által biztosított teljes dózist kell szem előtt tartani.
Szoptató anyák: A lidokain kiválasztódik az emberi tejben. Ennek a megfigyelésnek a klinikai jelentősége nem ismert. Óvatosságot kell tanúsítani, ha lidokaint adnak szoptató anyáknak.
Pediatriai alkalmazás: Bár a Lidocain 2%-os zselé biztonságosságát és hatékonyságát gyermekgyógyászati betegeknél nem állapították meg, egy 19 koraszülött újszülöttön (terhességi kor <33 hét) végzett vizsgálat nem talált összefüggést a lidokain vagy a monoetilglicinexilidid plazmakoncentrációja és a csecsemő testsúlya között, amikor mérsékelt mennyiségű lidokain (azaz 0,3 ml/kg lidokain gél 20 mg/ml) kenésére használtak intranazális és endotracheális tubusokat egyaránt. Egyetlen újszülöttnél sem volt 750 mcg/L feletti lidokain plazmaszint. Gyermekeknél az adagokat az életkornak, a testsúlynak és a fizikai állapotnak megfelelően csökkenteni kell. (Lásd DOSAGE AND ADMINISTRATION.)
Mellékhatások
A lidokain beadását követő mellékhatások hasonló jellegűek, mint a más amid helyi érzéstelenítőknél megfigyeltek. Ezek a nemkívánatos tapasztalatok általában dózisfüggőek, és a túlzott adagolás vagy a gyors felszívódás okozta magas plazmaszintekből eredhetnek, vagy a beteg túlérzékenységéből, idioszinkráziájából vagy csökkent toleranciájából adódhatnak. A súlyos mellékhatások általában szisztémás jellegűek. A következő típusok a leggyakrabban jelentett típusok:
Ritkán beszámoltak endotracheális tubus elzáródásáról, amely a tubus belső lumenében lévő szárított zselé maradványok jelenlétével függött össze. (Lásd még a FIGYELMEZTETÉSEK és az ADAGOLÁS ÉS BEADAGOLÁS.)
Központi idegrendszer: A központi idegrendszeri megnyilvánulások gerjesztő és/vagy depresszív hatásúak, és szédülés, idegesség, aggodalom, eufória, zavartság, szédülés, álmosság, fülzúgás, homályos vagy kettős látás, hányás, hő-, hideg- vagy zsibbadásérzés, rángások, remegés, görcsök, eszméletvesztés, légzésdepresszió és leállás jellemezheti őket. Az izgalmi megnyilvánulások nagyon rövid ideig tarthatnak, vagy egyáltalán nem is jelentkezhetnek, ebben az esetben a toxicitás első megnyilvánulása az eszméletvesztésbe és légzésleállásba átmenő álmosság lehet.
A lidokain beadását követő álmosság általában a gyógyszer magas vérszintjének korai jele, és a gyors felszívódás következményeként jelentkezhet.
Szív- és érrendszer: A szív- és érrendszeri megnyilvánulások általában depressziósak, és bradikardia, hipotenzió és szív- és érrendszeri összeomlás jellemzi őket, ami szívmegálláshoz vezethet.
Allergiás: Az allergiás reakciókat bőrelváltozások, csalánkiütés, ödéma vagy anafilaktoid reakciók jellemzik. Az allergiás reakciók akár a helyi érzéstelenítő szerrel, akár a készítmény egyéb összetevőivel szembeni érzékenység következtében léphetnek fel. A lidokainra való érzékenység következtében fellépő allergiás reakciók rendkívül ritkák, és ha mégis előfordulnak, azokat hagyományos eszközökkel kell kezelni. Az érzékenység bőrpróbával történő kimutatása kétséges értékű.
TÚLADAGOLÁS
A helyi érzéstelenítők okozta akut vészhelyzetek általában a helyi érzéstelenítők terápiás alkalmazása során előforduló magas plazmaszintekhez kapcsolódnak. (Lásd: MELLÉKHATÁSOK, FIGYELMEZTETÉSEK és ÓVIGYELMEZTETÉSEK.)
A helyi érzéstelenítéssel járó vészhelyzetek kezelése: Az első szempont a megelőzés, ami a legjobban a kardiovaszkuláris és légzési életjelek, valamint a beteg tudatállapotának gondos és folyamatos ellenőrzésével érhető el minden egyes helyi érzéstelenítő beadása után. A változás első jelére oxigént kell adni.
A görcsök kezelésének első lépése a szabad légutak fenntartására és az asszisztált vagy ellenőrzött lélegeztetésre való azonnali odafigyelés oxigénnel és olyan ellátórendszerrel, amely maszk segítségével azonnali pozitív légúti nyomást tesz lehetővé. Közvetlenül e lélegeztetési intézkedések bevezetése után értékelni kell a keringés megfelelőségét, szem előtt tartva, hogy a görcsök kezelésére használt gyógyszerek intravénásan adagolva néha csökkentik a keringést. Amennyiben a görcsök a megfelelő légzéstámogatás ellenére is fennállnak, és ha a keringés állapota megengedi, kis adagokban ultra-rövid hatású barbiturátot (pl. tiopentál vagy tiamilál) vagy benzodiazepint (pl. diazepám) lehet intravénásan beadni. A klinikusnak a helyi érzéstelenítők alkalmazása előtt ismernie kell ezeket a görcsoldó gyógyszereket. A keringési depresszió támogató kezelésére szükség lehet intravénás folyadék és adott esetben a klinikai helyzetnek megfelelően vazopresszor (pl. efedrin) adására.
Ha nem kezelik azonnal, mind a görcsök, mind a keringési depresszió hypoxiát, acidózist, bradycardiát, aritmiát és szívmegállást eredményezhet. Amennyiben szívmegállás lépne fel, a szokásos kardiopulmonális újraélesztési intézkedéseket kell bevezetni.
A lidokain akut túladagolásának kezelésében a dialízis elhanyagolható értékű.
A lidokain HCI szájon át adható LD50 értéke nem éhező nőstény patkányoknál 459 (346-773) mg/kg (mint só) és 214 (159-324) mg/kg (mint só) éhező nőstény patkányoknál.
ADAGOLÁS ÉS ADAGOLÁS
Ha a Lidocain HCI 2%-os zselét más lidokain tartalmú készítményekkel egyidejűleg alkalmazzák, szem előtt kell tartani az összes készítmény által adott teljes dózist.
A dózis változó, és függ az érzéstelenítendő területtől, a szövetek érzetétől, az egyéni toleranciától és az érzéstelenítés technikájától. A hatékony érzéstelenítéshez szükséges legkisebb adagot kell beadni. Gyermekeknél, valamint idős és legyengült betegeknél az adagokat csökkenteni kell. Bár a Lidocain HCI 2%-os zselével a mellékhatások előfordulása meglehetősen alacsony, óvatosságra int, különösen nagy mennyiségek alkalmazásakor, mivel a mellékhatások előfordulása egyenesen arányos a beadott helyi érzéstelenítő szer teljes dózisával.
A felnőtt férfi húgycső felületi érzéstelenítésére: Lidocain 2%-os zselés 30 ml-es tubusok használata esetén a műanyag kúpot 5 percig sterilizálja forró vízben, hűtse le, és rögzítse a tubushoz. A kúp tetszés szerint gázsterilizálható vagy hidegen sterilizálható. Lassan csepegtessen kb. 15 ml-t (300 mg lidokain HCI) a húgycsőbe, vagy amíg a beteg nem érez feszültséget. Ezután néhány percre péniszbilincset alkalmazunk a koronánál. A megfelelő érzéstelenítéshez további, legfeljebb 15 mL (300 mg) adagot lehet instillálni.
A megfelelő érzéstelenítés eléréséhez a hangvizsgálat vagy a cisztoszkópia előtt 5-10 percig péniszbilincset kell alkalmazni. A férfi húgycső kitöltéséhez és tágításához általában 30 ml (600 mg) teljes adag szükséges.
Katéterezés előtt általában kisebb, 5-10 ml (100-200 mg) mennyiség is elegendő a síkosításhoz.
A felnőtt női húgycső felületi érzéstelenítéséhez: Lidocain 2%-os zselés 30 ml-es tubusok használata esetén a műanyag kúpot 5 percig sterilizálja forró vízben, hűtse le, és rögzítse a tubushoz. A kúp tetszés szerint gázsterilizálható vagy hidegen sterilizálható. Lassan csepegtessen 3-5 ml (60-100 mg lidokain HCI) zselét a húgycsőbe. Ha szükséges, néhány zselét vattapamacsra lehet helyezni, és azt a húgycsőbe bevezetni. A megfelelő érzéstelenítés érdekében néhány percet kell hagyni az urológiai beavatkozások elvégzése előtt.
Lubrikálás endotracheális intubáláshoz: Alkalmazzon mérsékelt mennyiségű zselét az endotracheális tubus külső felületére röviddel a használat előtt. Ügyelni kell arra, hogy a termék ne kerüljön a tubus lumenébe. Ne használja a zselét az endotracheális stiletták kenésére. A belső lumen elzáródásáról szóló ritka jelentésekkel kapcsolatban lásd a FIGYELMEZTETÉSEK és MELLÉKHATÁSOK című részt. A külső felületre száradt zselével ellátott endotracheális tubusok használata is kerülendő a kenőhatás hiánya miatt.
MAGAS Dózis
Nem adható 600 mg-nál több lidokain HCI 12 órán belül.
Gyermekek: Nehéz bármilyen gyógyszer maximális adagját ajánlani gyermekek számára, mivel ez az életkor és a testsúly függvényében változik. Tíz évnél fiatalabb, normál sovány testtömegű és normál sovány testfejlődésű gyermekek esetében a maximális dózis meghatározható a standard gyermekgyógyászati gyógyszerformulák egyikének alkalmazásával (pl. Clark-szabály). Például egy ötéves, 50 kilós gyermeknél a lidokain-hidroklorid adagja nem haladhatja meg a 75-100 mg-ot, ha a Clark-szabály szerint számítják ki. Mindenesetre a Lidocain HCI beadott maximális mennyisége nem haladhatja meg a 4,5 mg/ttkg testtömeg-kilogrammot.
HOW SUPPLIED
A Lidocain HCI 2%-os zselé a felsorolt adagolási formákban kerül forgalomba.
NDC 17478-840-30 30 ml-es alumínium tubus
NDC 17478-840-05 5 ml-es alumínium tubus
A 30 ml-es dobozban található egy levehető applikátor kúp és egy kulcs a tartalom kinyomására.
Tárolás: A 30 ml-es dobozban található: Tárolás: 20°-25°C-on (68°-77°F) .
PREMIERProRx®
Gyártó:
Akorn, Inc.
Lake Forest, IL 60045
A PremierProRx® a Premier Inc. bejegyzett védjegye, licenc alapján használják.
PLD00N Rev. 10/15
Főcímke szövege a dobozcímkéhez:
NDC 17478-840-05 Premier Logo
Lidocain Hydrochloride Jelly USP, 2%
Kizárólag Rx
Steril 5 ml

Főcímke szövege a dobozcímkéhez:
NDC 17478-840-05 Steril 5 ml
Lidokain-hidroklorid zselé USP, 2%
Kizárólag RX
Premier Logo

| LIDOCAINE lidokain-hidroklorid zselé |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Címke – Akorn, Inc. (117696770)
Registráns – Akorn, Inc. Akorn Operating Company LLC (117693100)
| Telephely | |||
| Név | Cím | ID/FEI | Operations |
| Akorn, Inc | 117696840 | KÉSZÍTÉS(17478-840), ELEMZÉS(17478-840), SZTERILIZÁLÁS(17478-840), PACK(17478-840), CÍMKE(17478-840) | |
Tovább a lidokain helyi alkalmazásáról
- Mellékhatások
- Terhesség vagy szoptatás alatt
- Adagolási információ
- Kölcsönhatások
- Alternatívák összehasonlítása
- Árképzés & Kuponok
- En Español
- 208 Vélemények
- A gyógyszercsoport:
Fogyasztói források
- Betegtájékoztatás
- Lidokain Helyi alkalmazás (haladó olvasás)
Szakmai források
Tájékoztatás
Szakmai források
- Receptköteles információk
- Lidokain (helyileg alkalmazható) (Szakszerű betegtájékoztatás)
- Lidokain krém (FDA)
- Lidokain gél (FDA)
- Lidokain gégeoldat (FDA)
- … +9 még
Egyéb márkák Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 még
Kapcsolódó kezelési útmutatók
- Anális viszketés
- Gasztrointesztinális sebészet
- Anesztézia
- Égés, külső
- … +9 még
Egészségügyi jogi nyilatkozat
