 |
|
A sav-bázis reakciók mindenütt előfordulnak. Vizes oldatokban a savak növelik a hidrogénion (H+) koncentrációját. A bázisok viszont növelik a hidroxidion (OH-) koncentrációját. Amikor egy sav és egy bázis reakcióba lép egy vizes oldatban, a H+ és OH- ionok vízzé egyesülnek. Ezek az ionok így “semlegesítik” egymást:
A legtöbb sav általános képlete HA, ahol A- egy anion, a legtöbb bázisé pedig BOH, ahol B+ egy megfelelő kation. A savak és bázisok két általános típusba sorolhatók: erős és gyenge savak és bázisok. A kettő közötti különbség egyszerű: egy erős sav vízoldatban 100%-ban bomlik protonra (H+) és anionra (A-)
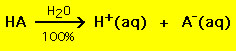
A legtöbb gyenge sav viszont vízoldatban 100%-nál lényegesen kisebb mértékben bomlik:
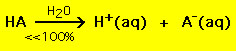 .
.Más szóval a legtöbb gyenge savmolekula érintetlenül marad a vízben. Hasonló kémiai egyenletek érvényesek az erős és gyenge bázisokra is.
A gyenge savak és bázisok közül csak néhány létezik, ezek a következők:
| |
|
|
HCl (sósav) HNO3 (salétromsav) HClO4 (perklórsav) H2SO4 (kénsav) |
NaOH (nátrium-hidroxid) KOH (kálium-hidroxid) Ca(OH)2 (kalcium-hidroxid) |
A többi sav és bázis gyenge. Bármilyen anionból gyenge sav keletkezik. Példák az alábbiakban
| |
|
|
F- (fluorid) Br- (bromid) I- (jodid) HCO3- (bikarbonát) C2H3O2- (acetát) MnO4- (permanganát) PO4-3 (foszfát) CrO4-2 (kromát) CN- (cianid) NO2- (nitrit) SO3-…2 (szulfit) |
HF (fluorsav) HBr (brómsav) HI (jódsav) H2CO3 (szénsav) HC2H3O2 (ecetsav) HMnO4 (permangánsav) H3PO4 (foszforsav) H3PO4 (foszforsav) sav) H2CrO4 (krómsav) HCN (ciánsav) HNO2 (salétromsav) H2SO3 (kénsav) |
A tipikus sav-bázis reakcióban a sav és a bázis reakciója során só és víz keletkezik e.g., ciánsav és nátrium-hidroxid:
