A klinikusokat régóta frusztrálja az intraokuláris nyomás (IOP) aránytalan szerepe a glaukóma kezelésében. Mint az egyetlen orvosi vagy sebészeti beavatkozásra alkalmas tényező, szerepe létfontosságú. A tonometria azonban eleve korlátozott: A néhány havonta elvégzett egyetlen mérés nem képes ábrázolni az IOP napszakos hullámzását. Még a betegek többszöri tonometriás mérésre történő behozása sem nyújt ideális képet a beteg IOP jellemzőiről.

|
|
| Ez a beültethető mikrofluidikus 24 órás IOP-monitorozó szenzor jelenleg a Stanford Egyetemen fejlesztés alatt áll. Fotó: Ishmail E. Araci |
A szakértők úgy vélik, hogy végül egy kontaktlencsén vagy szemüvegen elhelyezett apró érzékelőt fognak a betegeknek beültetni, vagy elküldik őket szemészhez, hogy beültessenek egyet a szemükbe. Ez folyamatosan mérné az IOP-t, exponenciálisan növelve a kapott adatok mennyiségét – és remélhetőleg értékét is. Ha az IOP dokumentálásának jelenlegi megközelítése olyan, mint egy pillanatfelvétel készítése, akkor a folyamatos 24 órás IOP-monitorozás inkább hasonlít egy videófelvételhez, amely az időbeli változásokat rögzíti, ahelyett, hogy csak egy statikus értéket adna meg.
Ezek a szerkentyűk még fejlesztés alatt állnak. Készen állnak a főműsoridőre? Nézzük meg, hogyan ingadozik az IOP, az ebből adódó klinikai kihívásokat és a jelenlegi legmodernebb technológiákat, amelyek megpróbálják jobban nyomon követni az IOP-t a jobb klinikai megértés érdekében.
A mozgó célpont
A célzott IOP elérésén alapuló kezelési terv felállítása trükkös, ha maga a célpont mozog. Az IOP a nap folyamán óráról órára, percről percre, sőt másodpercről másodpercre ingadozik, számos endogén és exogén tényező alapján.
A szemrendszerben az IOP függhet a vizes nedvtermelés, a kiáramlási lehetőség (mennyire könnyen hagyja el a vizes nedv a szemet), az episzklerális vénás nyomás (a szem felszínén lévő vénákban uralkodó nyomás) és az uveoszklerális kiáramlás (a vizes nedvnek a szemet elhagyó másodlagos útja) egyensúlyától.
A kiáramlási lehetőség növekedése vagy a vizes nedv termelésének csökkenése például csökkentené az IOP-t, mondja Dr. Arthur J. Sit, a minnesville-i Rochesterben található Mayo Clinic glaukómakutatója. Az IOP rövid távú ugrásai a pislogás vagy a szem dörzsölése miatt a szemre gyakorolt nyomás miatt is előfordulhatnak, vagy akár a szemmozgás vagy a vérnyomás lüktetése során.
A szemnyomás ingadozik a testhelyzet, a napszak (éjszakai csúcsok, nappali mélypontok), a vérnyomás és a hozzá kapcsolódó szemperfúziós nyomás (OPP) fogalma, a stressz vagy a fájdalom szintje, a víz- és koffeinfogyasztás miatt is.
Az erőteljes aktivitás és a stressz ráadásul a vérnyomást, az IOP-t és az OPP-t is csúcsra járathatja, mondja Dr. Kaweh Mansouri, MPH, a Genfi Egyetem és a University of Colorado Denver szemészorvosa. A vérnyomásnak az IOP-val együtt történő mérése értékes annak meghatározására, hogy a vérnyomás hogyan befolyásolja az IOP-t, mondja Dr. Mansouri. A kutatók jelenleg 24 órás IOP-monitorozó készülékekkel vizsgálják ezeket a hatásokat a glaukóma progressziójára.
|
Dos and Don’ts of IOP Measurement Ne diagnosztizáljon vagy kezeljen egyetlen mérés után. Dr. Sowka azt tanácsolja az optometristáknak, hogy ne kezdjék el azonnal a kezelést, kivéve, ha a nyomás túlságosan magas, vagy a látóidegek már súlyosan károsodtak és sérülékenyek; ehelyett mérjenek többször nyomást. Az is jó ötlet, hogy a terápia megkezdése után több nyomásmérést végezzenek, hogy megállapítsák, hogy a gyógyszer hat-e – mondja Dr. Sowka. Egyetlen IOP-mérés a gyógyszeres kezelés megkezdése után valóban nem elegendő a valódi hatékonyság megítéléséhez. Mondja a betegeknek, hogy nyugodjanak meg. Mint korábban említettük, a betegek a tonometria során megfeszülhetnek vagy visszatarthatják a lélegzetüket. Mondja el nekik rendszeresen, hogy lazítsanak és lélegezzenek normálisan az eljárás során, sürgeti Dr. Mansouri. Ne engedjen a gyanúból. Ha a páciens IOP-mérései látszólag nem egyeznek a látótér- és látóidegvizsgálatokkal, akkor lehet, hogy több van a beteg IOP-jával, mint amire rájött, mondja Dr. Hartwick. Kérje meg, hogy jöjjön vissza, és mérje meg az IOP-ját egy másik napszakban, teszi hozzá. Megfontolandó a napszakos görbe alkalmazása bizonyos betegeknél. A napszakos görbe tonometrikus felvétele a legtöbb beteg számára nem praktikus és fárasztó. De ha az IOP szintje és a károsodás mértéke összeegyeztethetetlennek tűnik – például ha normális feszültségű glaukómára gyanakszik -, fontolja meg a lehetőséget, mondja Dr. Davey. Ha a beteg beleegyezik, hozza be kora reggel, és nyolc-tíz órán keresztül óránként rögzítse az IOP-t. “Így megkapjuk az irodai napszakos görbét, amely lehet, hogy nem teljesen reprezentálja a nappali/éjszakai értékeket, de legalább egynél több mérést ad” – mondja. |
Íme, hogyan befolyásolják ezek a változók az IOP-t:
– Testhelyzet. Attól függően, hogy a beteg milyen helyzetben van a székben, a nyomás növekedhet vagy csökkenhet. Az IOP például akkor a legalacsonyabb, amikor a beteg semleges helyzetben ül. “Szinte bármi más növeli az IOP-t, beleértve a nyak előrehajlását, a fej hátrahajtását, a fej oldalra fordítását, a fekvést, a lehajolást, a pislogást vagy a szem dörzsölését” – mondja Dr. Sit.
– Vízfogyasztás. A nagy mennyiségű vízivás hatására a beteg vérmennyisége rövid időre megnő. A vénás nyomás is megemelkedik, ha a beteg több vizet fogyaszt. “Mindössze 16-32 unciát kell elfogyasztaniuk, ami egy vagy két kis üveg víz, és öt percen belül a nyomás 6 mm Hg-rel emelkedik” – mondja Pinakin Gunvant Davey, PhD, OD, a kaliforniai Pomona városában található Western University of Health Sciences Optometry College professzora és glaukóma szakértője.
– Napszak. A szakirodalom szerint az IOP csúcsértéke a betegek kétharmadánál éjszaka jelentkezik. Az ok: a víztartalom éjszaka alulszekretálódik, mondja Joseph Sowka, OD, a Nova Southeastern University College of Optometry optometriai professzora Ft. Lauderdale-ben, Flauderdale-ben.
Dr. Mansouri például 24 órán át figyelte a betegeket alváslaborban, és azt találta, hogy a legmagasabb IOP éjszaka volt. Bár az Ön páciensei nem lesznek alvásvizsgálatnak alávetve, előfordulhat, hogy este jönnek az Ön rendelőjébe – ha így van, számoljon azzal, hogy a nap más időszakaihoz képest megemelkedett IOP-értékeket fog látni.
– Vérnyomás. A kiindulási IOP a szívciklus, a szisztolés és a diasztolés vérnyomás alapján. A vér szembe juttatásához használt erő a szem perfúziós nyomása, magyarázza James L. Fanelli, OD, a Cape Fear Eye Institute (Wilmington, NC) munkatársa.
Ha a vérnyomás alacsony, kevesebb erő “nyomja” a vért a szembe, és ezért kevesebb perfúziós nyomás jut a szembe. Azok a tényezők, amelyek az IOP emelkedését okozzák, hatással vannak a perfúziós nyomás csökkenésére, és azok a tényezők, amelyek a vérnyomást csökkentik, szintén alacsonyabb perfúziós nyomást eredményeznek – vagy e tényezők bármelyikének kombinációja szerepet játszhat, mondja Dr. Fanelli. A vérnyomás hajlamos a kora reggeli alvás idején lecsökkenni, ami egyben az a napszak is, amikor az IOP általában a legmagasabb.1 Ez a két ellentétes hatású tényező duplikáltan csökkentheti az OPP-t az éjszakai órákban, ami lehetővé teheti a szemidegfej fokozott károsodását.
– Stressz. A stressz növekedése vagy csökkenése hormonális változásokat okoz, amelyek az IOP-szintet felfelé vagy lefelé tolják. Dr. Mansouri egyik páciensének – akit egy kontaktlencsére szerelt 24 órás IOP-monitorozó szenzorral vizsgáltak – nyomáscsúcsok jelentkeztek, valahányszor kutyájának éjjel epilepsziás rohama volt.
– Általános “idegek”. Lehetséges, hogy egyes betegeknél maga a szemészeti vizsgálat okozta stressz – például ha aggódnak, hogy glaukómát diagnosztizálnak náluk – okozhatja az IOP emelkedését, mondja Andrew Hartwick, OD, PhD, az Ohio State University College of Optometry docense Columbusban. Például összeszoríthatják a szemüket, mert stresszelnek a vizsgálat miatt, és az IOP-értékek megugranak.
– A fájdalom is okoz IOP-emelkedést, mert stresszt okoz. Dr. Mansouri egyik páciense csúnyán beverte a lábát egy parkolóban. A 24 órás monitorozás adatai szerint az IOP-szintje pontosan abban a pillanatban ugrott meg, amikor a balesetre emlékezett.
A pontatlan IOP-értékek következményei
A tanulmányok szerint az IOP csúcsértékei hozzájárulhatnak a glaukóma progressziójához.2,3 Ha azonban akkor vizsgálja meg a beteget, amikor az IOP a legalacsonyabb vagy legmagasabb értéken van, akkor túl- vagy alulbecsülheti a glaukóma diagnózisát vagy a beteg számára szükséges kezelést.
“Ha a beteget a mélyponton kapjuk el, amikor az IOP a legalacsonyabb, az elvezethet minket a glaukóma megfontolásától”, különösen, ha az érték a statisztikailag normális tartományba esik, mondja Dr. Sowka. “Máskor viszont előfordulhat, hogy az IOP csúcsértékénél kapjuk el őket, ahol egy kicsivel a normális felett van – ez a forgatókönyv hajlamos arra, hogy a szakemberek feleslegesen aggódjanak.”
|
|
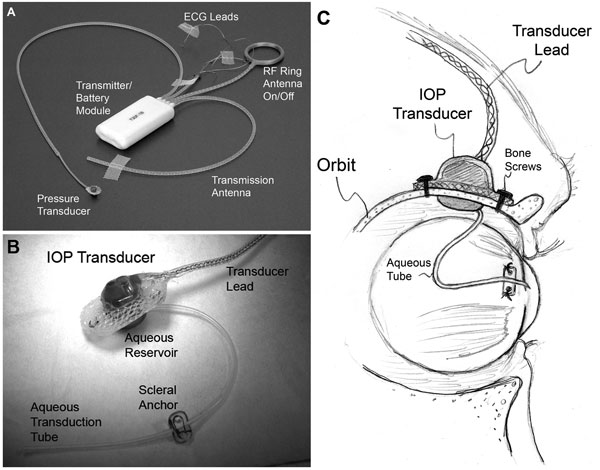
| (A) Egy tipikus T30F teljes implantációs rendszer (Konigsberg Instruments). (B) Az egyedi IOP-transzducer házának extraorbitális felülete. (C) Egy 23 milliméteres szilikoncső vizet szállít az elülső kamrából a transzducer intraorbitális oldalán lévő folyadéktartályba (B-ben részben elrejtve); A csövet (a szemmozgást lehetővé tevő megfelelő lazasággal) levágták és behelyezték az elülső kamrába. |
A IOP-tartomány rögzítése potenciálisan lehetővé tenné a glaukóma diagnózisának és kezelésének javítását. “Ha a kutatók ki tudnák mutatni, hogy bizonyos 24 órás IOP-minták összefüggnek a glaukóma progressziójával, akkor van remény arra, hogy e minták észlelése segíthet a progresszió szempontjából fokozottan veszélyeztetett betegek azonosításában, és lehetővé teszi, hogy kezelésüket ennek megfelelően alakítsuk” – mondja Dr. Mansouri.
A glaukóma hamarabb azonosítható lenne, így a műtét vagy a gyógyszeres kezelés gyorsabban megkezdhető lenne – teszi hozzá. A szemorvosok azt is meg tudnák határozni, hogy az IOP-csökkentő gyógyszerek hatékonyak-e éjszaka vagy bizonyos, az IOP-t megemelő tevékenységek során.
A valódi IOP-tartomány megállapításához folyamatos, 24 órás IOP-monitorozásra lenne szükség. Ez kihívást jelent, mivel a szokásos rendelői órák alatt gyűjtött egyetlen IOP-mérés nem ragadja meg a beteg IOP-tartományát, annak csúcspontjait vagy változásait a nap folyamán.4
Az IOP-tartomány meghatározása jelenleg Goldman applanációs tonometria (GAT) segítségével lehetséges egy napszakos feszültséggörbe (DTC) segítségével, ahol az IOP-értékeket a rendelői órák alatt különböző időpontokban rögzítik. Ez azonban mind a gyakorló orvos, mind a beteg számára problémás. Az éjszakai görbéket nem rögzítik, és a betegek kevesebb mint 1%-ánál végeznek DTC-t vagy alváslaborban IOP-monitorozást.4
Tényleg, kutatók 24 órán keresztül mérték az IOP-t, és nemcsak azt dokumentálták, hogy az IOP éjjel tetőzik, hanem azt is, hogy az IOP ingadozása sokkal nagyobb a rendelőn kívüli órákban.5 Egy 35 beteggel végzett vizsgálatban, akiknek az IOP-ját 24 órán keresztül pneumatonométerrel rögzítették alváslaborban, a legtöbb csúcs IOP-t éjszaka regisztrálták az idősebb glaukomás betegeknél az egészséges emberekhez képest, akár ülve, akár fekve.6
A közelmúltban a 24 órás monitorozást alkalmazó kutatók megtudták, hogy az átlagos IOP nem csak éjszaka emelkedik, hanem valójában folyamatosan emelkedik – és napközben még inkább, mint éjszaka.7 Az oregáliai Portlandben működő Devers Eye Institute kutatói egy majomszembe beültetett telemetriai rendszerrel másodpercenként 500 IOP-mérést rögzítettek.
Megállapították, hogy az IOP sokkal jobban ingadozik, mint korábban hitték. “A pislogások és a szemmozgások nagy IOP-csúcsokat generálnak, amelyek óránként körülbelül 12 000-szer fordulnak elő, és a teljes IOP-energia körülbelül 12%-át teszik ki, amelyet a szemnek az ébrenléti órák alatt el kell nyelnie” – állapították meg a kutatók. Úgy vélik, hogy ez az adat a majmoknál körülbelül ugyanez lesz az embernél is. “Az IOP-t most már dinamikusnak és folyamatosan változónak kell tekintenünk, és az IOP-ingadozás a glaukóma fontos tényezőjének bizonyulhat. “8
A kutatók azt is megállapították, hogy a napszakos ciklus nem ismétlődik napról napra. Ezért van szükség a folyamatos IOP-monitorozásra. A jelenlegi prototípusok közé tartoznak a beültetett érzékelők és a kontaktlencse-alapú eszközök.
Intelligent Implantables
Már több start-up cég fejlesztett ki telemetrikus nyomásérzékelőket, amelyeket szürkehályog- vagy glaukómaműtét során lehet beültetni. “A telemetrikus azt jelenti, hogy a nyomásértékeket távolról (azaz a szem belsejéből) rögzítik, és vezeték nélkül továbbítják egy külső leolvasóhoz” – mondja Dr. Sit.
A jelenleg vizsgált beültethető eszközök közé tartoznak:

|
|
|
A Pro-IOP érzékelő egy telemetrikus eszköz, amelyet az IOL-hoz hasonlóan beültetnek. Fotó: Implandata Ophthalmic Products GmbH |
– Pro-IOP. A németországi székhelyű Implandata Ophthalmic Products a Pro-IOP-on dolgozik, egy vezeték nélküli szemnyomásmérőn (WIT), amely telemetrikusan, egy kézben tartott eszközzel működik. Az apró műanyag gyűrűre hasonlító WIT átmérője 11,3 mm.9 Egyetlen mikroelektromechanikus rendszerben nyomásérzékelőket, hőmérsékletérzékelőt, azonosító kódolót, analóg-digitális kódolót és telemetriai egységet foglal magában.9
Egy beépített antennával ellátott RFID-chip 24 órás IOP-értékeket sugároz egy külső kézi olvasónak. A páciens és az orvos idővel arra is képes lehet, hogy az adatokat egy okostelefon-alkalmazáson keresztül kapja meg. A beteg az alkalmazáson keresztül is kommunikálhatna az orvossal az IOP-értékekről.
A készülék Európában még nem kapta meg a CE-jelölést, az Egyesült Államokban pedig az FDA jóváhagyását, de németországi kutatók nemrég beültették a Pro-IOP-ot az első emberi alanyba, egy 60-as éveiben járó nőbe; adatokat még nem publikáltak.9
– AcuMEMs. Az AcuMEMs egy azonos nevű amerikai cég által fejlesztés alatt álló beültethető eszköz, amely a Pro-IOP-hoz hasonlóan működik. Az érzékelő egy kapacitív nyomásérzékelő, amely az IOP ingadozásával változtatja alakját. “Amikor megváltoztatja az alakját, megváltozik az elektromos kapacitása, és ez külsőleg érzékelhető a leolvasóval” – mondja Dr. Sit.
A szenzor önálló eljárásként vagy a glaukómaműtét részeként beültethető az elülső kamrába; a szürkehályogműtét során a kapszulazsákba is beültethető.
– Mikrofluidikus IOL-implantátum. A Stanford Egyetem és az izraeli Bar-Ilan Egyetem kutatói közösen fejlesztenek ki egy beültethető mikrofluidikai érzékelőt. A készülék szabadalma szerint a szenzorban lévő kamrákban lévő intraokuláris folyadék és gáz között kialakult egyensúlyi nyomásfelület alapján mérnék az IOP értékét. A betegek és az orvosok okostelefonjukat vagy egy külső leolvasót használhatnának az IOP ellenőrzésére.10 A feltalálók az érzékelő szabadalmi jóváhagyására várnak.
A szembe ültetett eszközök által továbbított jel elméletileg pontosabb lehet, mint a kontaktlencsékhez rögzítetteké, mondja Dr. Davey. A jel erőssége attól függ, hogy az eszköz mennyi energiát bocsát ki. “Mindkét eszközt (Pro-IOP és AcuMEM) beültettük, és nem működtek olyan jól” – mondja Dr. Davey.
A Pro-IOP és az AcuMEMs leolvasókat potenciálisan egy szemüvegre is rá lehetne erősíteni, és az adatok gyűjtése ugyanúgy történne, mondja Dr. Sit.
Clever kontaktlencse
A kutatók először az 1970-es években vizsgálták a kontaktlencse-érzékelőket, de a rendelkezésre álló kemény kontaktlencsék túl kényelmetlenek voltak, és Dr. Davey szerint megváltoztatták a páciens szemének szerkezeti integritását.
|
|
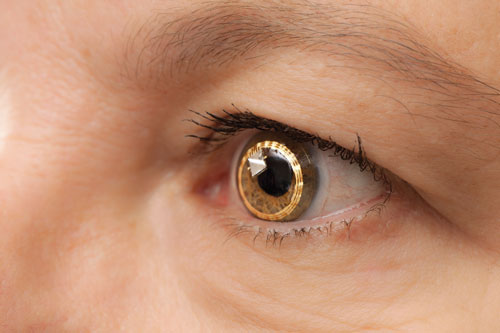
| A Sensimed Triggerfish a szemen. Az Egyesült Államokban még folynak a klinikai vizsgálatok. |
A szenzorok sem voltak elég érzékenyek. “A “puhább” szemű személynek pontosabb volt a leolvasása, mint a merevebb szeműnek” – mondja Dr. Davey. “A technológia nem volt elég jó ahhoz, hogy IOP-értékeket kapjunk”. A vastagabb szaruhártya kevésbé könnyen reagál az IOP változásaira, így a tonometria (és a kontaktlencse-érzékelők) kevésbé pontosak.
A kontaktlencse-alapú IOP-érzékelők közé tartoznak:
– A Triggerfish (Sensimed). A svájci Genfi Egyetemen szemészek Dr. Mansouri és mások vezetésével korai vizsgálatokat végeztek a Triggerfish nevű kontaktlencsével kapcsolatban.
A Triggerfish egy hidrofil lágy kontaktlencse, amely kontaktlencse-érzékelővel (CLS) van ellátva. A CLS két, a limbus körül elhelyezett nyúlásmérővel rendelkezik, amelyek érzékelik a szemkörfogat változását. “Úgy gondoljuk, hogy a szemkörfogat e változásai összefüggnek az IOP és az intraokuláris térfogat változásaival, és ezt enukleált szemeken be is bizonyították” – mondja Dr. Mansouri. A készülék az IOP, az intraokuláris térfogat és a biomechanikai tulajdonságok változásainak (a szaruhártya és a szklerális hiszterézis és merevség kombinációja) keverékét méri, amelyek korrelálnak az IOP ingadozásaival. Egy külső leolvasó 24 órán keresztül rögzíti az adatokat.
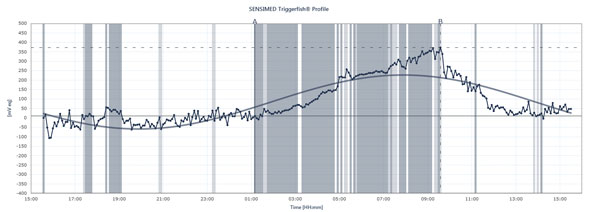
A folyamatábra a Sensimed Triggerfish-t viselő betegnél az IOP csúcs- és mélypontjait mutatja 24 órán keresztül.
A Triggerfish Európában CE-jelöléssel rendelkezik. Az FDA jóváhagyása az Egyesült Államokban még nem történt meg, és az eszköz még klinikai vizsgálatok alatt áll.
|
A Triggerfish másképp követi az IOP-t A külső leolvasón megjelenített adatok a szemnyomás, az intraokuláris térfogat és a szem biomechanikai tulajdonságainak kombinációja, magyarázza Dr. Mansouri. “Hasznosabb képet adni a 24 óra alatt bekövetkező minőségi változásokról, mint a mennyiségi változásokról, mert ezeket nem tudjuk higanymilliméterre lefordítani” – mondja.” A Triggerfish mindazonáltal értékes információkat szolgáltat. A készüléket használó jövőbeli vizsgálatok segíthetnek megmagyarázni, hogy a nyomás 24 órán keresztül mennyire volt instabil vagy stabil, mikor jelentkeznek az éjszakai IOP-csúcsok, hogyan befolyásolja a kezelés bevezetése vagy a kezelés megváltoztatása a 24 órás IOP-mintákat, és hogyan befolyásolják bizonyos tevékenységek a 24 órás IOP-mintákat, például a jógapozíciók, a koffeinbevitel, a stresszhelyzetek és a fent leírt IOP-csúcsok egyéb okai. Dr. Mansouri a normál vagy alacsony vérnyomású glaukómás betegeket egyidejűleg 24 órás vérnyomás- és 24 órás IOP-monitorozásnak is aláveti, mivel a csúcsok hatással lehetnek az OPP-re. De a Triggerfish összefüggést fog mutatni a 24 órás IOP-minták és a glaukóma progressziója között? Számos vizsgálat van folyamatban ennek a lényeges kérdésnek a megválaszolására.
|
– Rezonanciaáramköri érzékelő kontaktlencse. Egy másik fejlesztés alatt álló intelligens CLS eszköz a szaruhártya görbületének deformációját érzékelő tekerccsel kombinált vékonyréteg-kondenzátorból álló rezonanciaáramkör. A fejlesztés korai szakaszában van David C.C. Lam vezetésével a Hongkongi Tudományos és Technológiai Egyetem Gépészeti és Űrhajózási Mérnöki Tanszékén.
Egy 2014. szeptemberi tanulmányban a CLS-t egy szilikongumi szemmodellen tesztelték. Megállapították, hogy az érzékelő pontosan követi az IOP ingadozását.11
Mint ahogy a cukorbetegeknél a glükózszint napi egyszeri mérése vagy a szívbetegeknél a vérnyomás napi egyszeri mérése, az egyetlen IOP-mérésre való hagyatkozás téves IOP-adatokat eredményezhet. De talán a nem túl távoli jövőben a sci-fi filmekből ismert eszközök – a kontaktlencsék és a beültethető érzékelők – lehetővé teszik, hogy az IOP-t nagyobb megértéssel és kevesebb gonddal kövesse Ön és betegei számára.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. A nappali és éjszakai szemperfúziós nyomás laboratóriumi értékelése emberekben. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Az intraokuláris nyomáscsúcsok és a látótérvesztés progressziója közötti összefüggés. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Szükséges-e a 24 órás szemnyomás-monitorozás glaukómában? Semin Opththalmol. May 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. A szokásos rendelési időn kívüli intraokuláris nyomásmonitorozás klinikai haszna glaukómás betegeknél. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Az éjszakai csúcs intraokuláris nyomások közötti korreláció egészséges személyeknél és glaukómás betegeknél. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24 órás IOP-telemetria főemlősöknél: az implantátumrendszer teljesítménye és az IOP kezdeti jellemzése több időskálán. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Emerging trends and hot topics. Előadás 2014. május 5-én, hétfőn az ARVO éves ülésén. Elérhető: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Hozzáférés 2014. november 19.
9. Melki S, Todani A, Cherfan G. Egy beültethető intraokuláris nyomásátalakító kezdeti biztonsági eredményei. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Beültethető mikrofluidikus eszköz a szemnyomás monitorozására. Elérhető a következő címen: www.google.com/patents/WO2014137840A1?cl=en. Hozzáférés 2014. október 17.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Puha, viselhető kontaktlencse-érzékelő a folyamatos intraokuláris nyomás monitorozására. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24 órás intraokuláris nyomásritmus fiatal egészséges alanyoknál, amelyet kontaktlencse-érzékelővel történő folyamatos monitorozással értékeltek. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
