Learning Outcomes
- A nyolcas szabály meghatározása és szerepe a kémiai kötésekben
Nem minden elemnek van annyi elektronja, hogy a legkülső héjakat kitöltse, de egy atom akkor a legstabilabb, ha a legkülső héj összes elektronhelye betöltött. A legkülső héjakban lévő üres helyek miatt alakulnak ki kémiai kötések, vagyis két vagy több azonos vagy különböző elem közötti kölcsönhatások, amelyek molekulák kialakulását eredményezik. A nagyobb stabilitás elérése érdekében az atomok arra törekszenek, hogy teljesen kitöltsék külső héjukat, és e cél elérése érdekében más elemekkel kötődnek azáltal, hogy elektronokat osztanak meg, elektronokat vesznek át egy másik atomtól, vagy elektronokat adnak egy másik atomnak. Mivel az alacsony atomszámú elemek (egészen a 20-as atomszámú kalciumig) legkülső héjai nyolc elektront képesek befogadni, ezt nevezik oktett-szabálynak. Egy elem adhat, elfogadhat vagy megoszthat elektronokat más elemekkel, hogy kitöltse a külső héját, és megfeleljen a nyolcados szabálynak.
Az atom korai modelljét 1913-ban Niels Bohr (1885-1962) dán tudós dolgozta ki. A Bohr-modell az atomot egy protonokat és neutronokat tartalmazó központi atommagként ábrázolja, az elektronok pedig az atommagtól meghatározott távolságban lévő körkörös elektronhéjakban helyezkednek el, hasonlóan a Nap körül keringő bolygókhoz. Minden egyes elektronhéjnak más-más energiaszintje van, az atommaghoz legközelebbi héjak energiája alacsonyabb, mint az atommagtól távolabbiaké. Megállapodás szerint minden héjhoz egy számot és egy n jelet rendelünk – például az atommaghoz legközelebbi elektronhéjat 1n-nek nevezzük. Ahhoz, hogy egy elektron a héjak között mozoghasson, pontosan a héjak közötti energiakülönbségnek megfelelő energiamennyiséget kell elnyelnie vagy leadnia. Például, ha egy elektron energiát nyel el egy fotonból, akkor gerjesztetté válik, és egy magasabb energiájú héjba kerül; fordítva, ha egy gerjesztett elektron visszahull egy alacsonyabb energiájú héjba, akkor energiát szabadít fel, gyakran hő formájában.
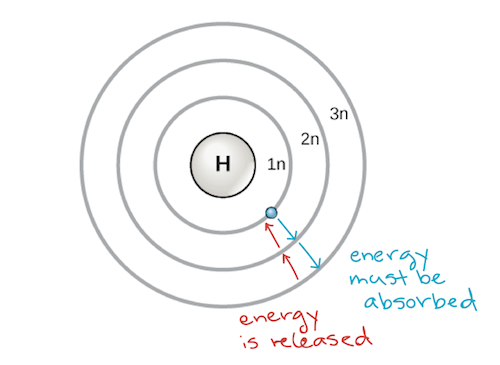
Az atom Bohr-modellje, amely az energiaszinteket az atommagot körülvevő koncentrikus körökként mutatja. Energiát kell hozzáadni ahhoz, hogy egy elektron kifelé mozogjon egy magasabb energiaszintre, és energia szabadul fel, amikor egy elektron egy magasabb energiaszintről egy közelebbi energiaszintre esik le. Képhitel: modified from OpenStax Biology
Az atomok, akárcsak más, a fizika törvényei által szabályozott dolgok, hajlamosak a lehető legalacsonyabb energiájú, legstabilabb konfigurációt felvenni. Így az atom elektronhéjai belülről kifelé haladva töltődnek fel, az elektronok az atommaghoz közelebbi, alacsony energiájú héjakat töltik fel, mielőtt a távolabbi, magasabb energiájú héjakba költöznek. Az atommaghoz legközelebbi héj, az 1n, két elektront, a következő, 2n, nyolc, a harmadik, 3n, pedig akár tizennyolc elektront is tartalmazhat.
Az adott atom legkülső héjában lévő elektronok száma határozza meg az atom reakcióképességét, vagyis azt, hogy hajlamos-e más atomokkal kémiai kötéseket kialakítani. Ezt a legkülső héjat valenciahéjnak nevezzük, és a benne található elektronokat valenciaelektronoknak nevezzük. Általában az atomok akkor a legstabilabbak, legkevésbé reaktívak, ha a legkülső elektronhéjuk tele van. A legtöbb, a biológiában fontos elemnek nyolc elektronra van szüksége a legkülső héjában ahhoz, hogy stabil legyen, és ezt az ökölszabályt oktett-szabálynak nevezik. Egyes atomok akkor is stabilak lehetnek nyolcaddal, ha a valenciahéjuk a 3n héj, amely akár 18 elektront is tartalmazhat. Ennek okát az alábbiakban az elektronpályák tárgyalásakor fogjuk megvizsgálni.
Az alábbiakban néhány semleges atomra és elektronkonfigurációikra mutatunk példákat. Ebben a táblázatban látható, hogy a héliumnak teljes valenciahéja van, két elektronnal az első és egyetlen, 1n héjában. Hasonlóképpen a neonnak is teljes, 2n külső héja van, amely nyolc elektront tartalmaz. Ezek az elektronkonfigurációk teszik a héliumot és a neont nagyon stabillá. Bár az argon technikailag nem rendelkezik teljes külső héjjal, mivel a 3n héj akár tizennyolc elektront is tartalmazhat, a neonhoz és a héliumhoz hasonlóan stabil, mivel nyolc elektronja van a 3n héjban, és így megfelel a nyolcas szabálynak. Ezzel szemben a klórnak csak hét elektron van a legkülső héjában, míg a nátriumnak csak egy. Ezek a minták nem töltik ki a legkülső héjat, és nem felelnek meg a nyolcados szabálynak, így a klór és a nátrium reaktívvá válik, és arra törekszik, hogy elektronokat nyerjen vagy veszítsen egy stabilabb konfiguráció elérése érdekében.
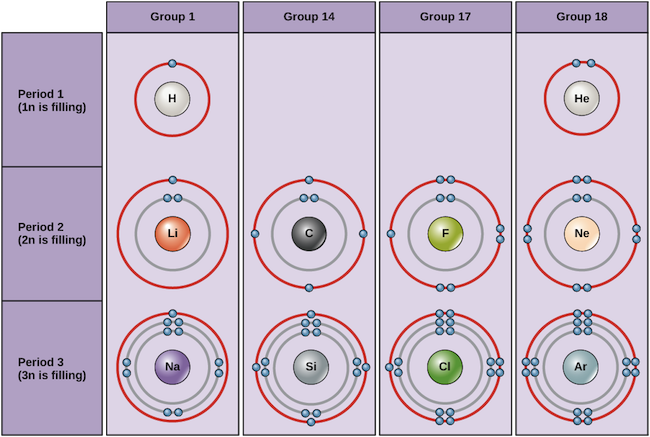
A különböző elemek Bohr-diagramjai Kép hitel: OpenStax Biology
Elektronkonfigurációk és a periódusos rendszer
A periódusos rendszerben az elemek az atomszámuk alapján kerülnek sorrendbe, vagyis hogy hány protonjuk van. Egy semleges atomban az elektronok száma megegyezik a protonok számával, így az elektronszámot könnyen meghatározhatjuk az atomszámból. Ezenkívül egy elemnek a periódusos rendszerben elfoglalt helye – az oszlop, vagyis a csoport és a sor, vagyis a periódus – hasznos információt nyújt arról, hogy ezek az elektronok hogyan helyezkednek el.
Ha csak a táblázat első három sorát tekintjük, amelyek az élet szempontjából fontos fő elemeket tartalmazzák, minden sor egy másik elektronhéj kitöltésének felel meg: a hélium és a hidrogén az 1n héjba helyezi elektronjait, míg a második sor elemei, például a Li a 2n héj kitöltését kezdik, és a harmadik sor elemei, például a Na a 3n héjjal folytatják. Hasonlóképpen, egy elem oszlopszáma információt ad a valenciaelektronok számáról és a reaktivitásról. Általában a valenciaelektronok száma azonos egy oszlopon belül, és balról jobbra haladva növekszik egy soron belül. Az 1. csoportba tartozó elemeknek csak egy valenciaelektronjuk van, a 18. csoportba tartozó elemeknek pedig nyolc, kivéve a héliumot, amelynek összesen csak két elektronja van. Így a csoportszám jó előrejelzője annak, hogy az egyes elemek mennyire lesznek reaktívak:
- A hélium (He), a neon (Ne) és az argon (Ar) mint 18-as csoportba tartozó elemek külső elektronhéja teljes, vagy megfelel a nyolcad-szabálynak. Ez teszi őket egyetlen atomként rendkívül stabillá. Nem reakcióképességük miatt inert gázoknak vagy nemesgázoknak nevezik őket.
- A hidrogén (H), a lítium (Li) és a nátrium (Na), mint az 1. csoportba tartozó elemek, csak egy elektronnal rendelkeznek a legkülső héjukban. Egyetlen atomként instabilak, de az egy valenciaelektronjuk elvesztésével vagy megosztásával stabillá válhatnak. Ha ezek az elemek teljesen elveszítik egy elektronjukat – ahogyan a Li és a Na jellemzően teszi -, pozitív töltésű ionokká válnak:
- A fluor (F) és a klór (Cl), mint 17. csoportba tartozó elemek, hét elektronnal rendelkeznek a legkülső héjukban. Hajlamosak úgy elérni a stabil nyolchetest, hogy más atomoktól vesznek el egy-egy elektront, így negatív töltésű ionokká válnak: F- és Cl-.
- A szén (C), mint 14. csoportba tartozó elem, négy elektronnal rendelkezik a külső héjában. A szén jellemzően megosztja az elektronokat a teljes valenciahéj elérése érdekében, több más atomtal kötést alkotva.
A periódusos rendszer oszlopai tehát az egyes elemek valenciahéjában található elektronok számát tükrözik, ami viszont meghatározza, hogy az elem hogyan fog reagálni.
Kipróbáld
Tegyél hozzá!
Javítsd ezt az oldaltTudj meg többet
