15.4 A karbonsavak fizikai tulajdonságai
Tanulási célok
- Hasonlítsa össze a karbonsavak forráspontját a hasonló moláris tömegű alkoholokkal.
- Hasonlítsa össze a karbonsavak vízben való oldhatóságát a hasonló alkánok és alkoholok vízben való oldhatóságával.
Néhány karbonsav színtelen, kellemetlen szagú folyadék. Az 5-10 szénatomos karbonsavak mindegyike “kecskeszagú” (ez magyarázza a Limburger sajt szagát). Ezeket a savakat a bőrbaktériumok az emberi faggyú (bőrzsír) hatására is termelik, ami a rosszul szellőző öltözők szagát magyarázza. A 10-nél több szénatomot tartalmazó savak viaszszerű szilárd anyagok, és szaguk a moláris tömeg növekedésével és az ebből következő csökkenő illékonysággal csökken.
A karbonsavak erős hidrogénkötést mutatnak a molekulák között. Ezért más, hasonló moláris tömegű anyagokhoz képest magas a forráspontjuk.
A karboxilcsoport könnyen hidrogénkötést létesít vízmolekulákkal (15.3. ábra “Hidrogénkötés egy ecetsavmolekula és vízmolekulák között”). Az egytől négy szénatomos savak teljesen elegyednek a vízzel. Az oldhatóság a szénlánc hosszának növekedésével csökken, mivel a dipóluserők veszítenek jelentőségükből, és a diszperziós erők válnak dominánssá. A hexánsav alig oldódik vízben (kb. 1,0 g/100 g vízben). A palmitinsav , nagyméretű nem poláros szénhidrogén komponensével, lényegében vízben nem oldódik. A karbonsavak általában olyan szerves oldószerekben oldódnak, mint az etanol, a toluol és a dietil-éter.
15. ábra.3 Hidrogénkötés egy ecetsavmolekula és vízmolekulák között
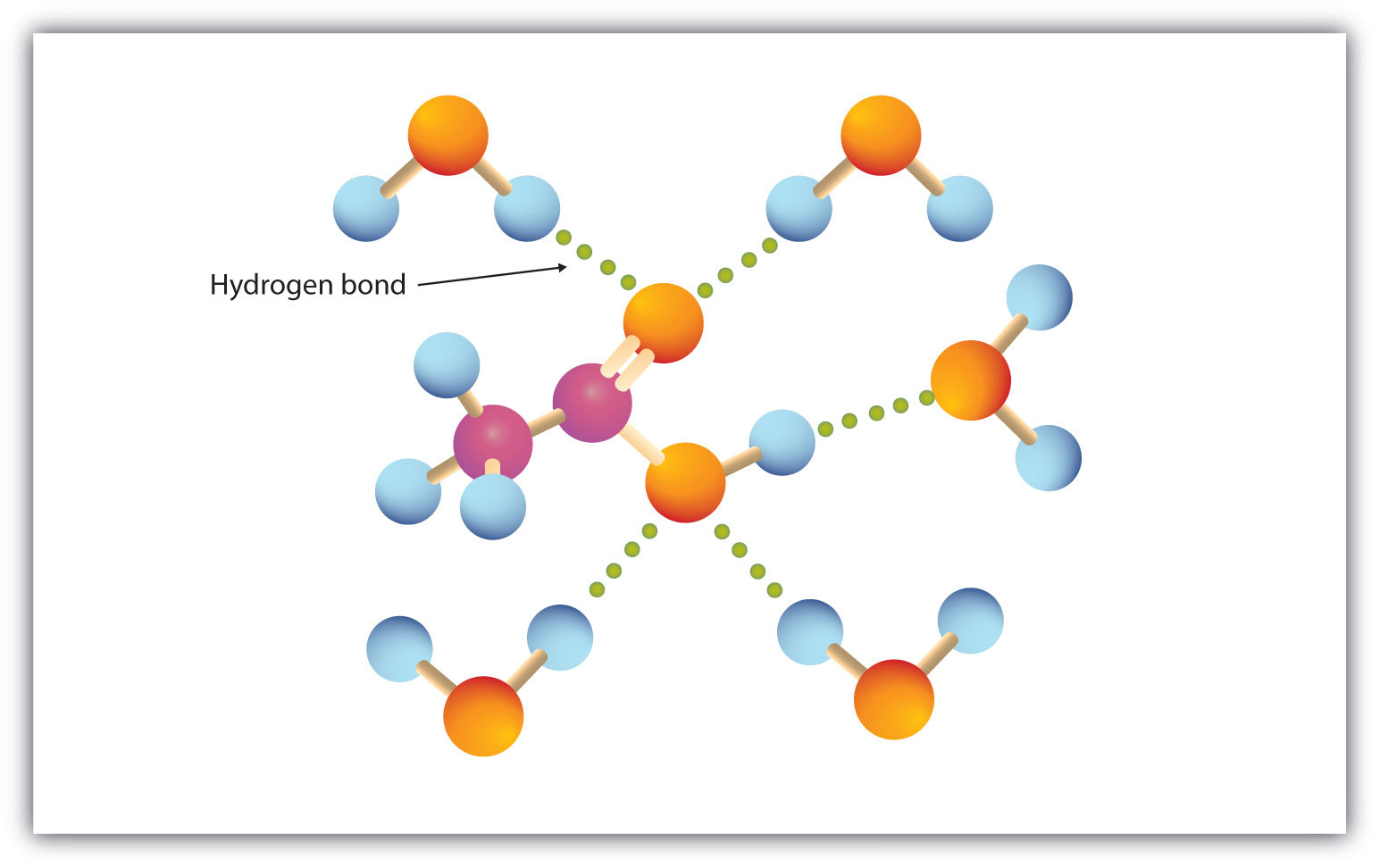
A kis moláris tömegű karbonsavak meglehetősen jól oldódnak vízben.
A 15.2. táblázat “A karbonsavak fizikai állandói” felsorol néhány fizikai tulajdonságot kiválasztott karbonsavakra. Az első hat homológ. Vegyük észre, hogy a forráspontok a moláris tömeg növekedésével nőnek, de az olvadáspontok nem mutatnak szabályos mintázatot.
Táblázat 15. táblázat.2 Karbonsavak fizikai állandói
| Sűrített szerkezeti képlet | Sav neve | olvadáspont (°C) | forrási pont (°C) | oldhatóság (g/100 g víz) |
|---|---|---|---|---|
| HCOOH | hangyasav | 8 | 100 | keverhető |
| CH3COOH | ecetsav | 17 | 118 | keverhető |
| CH3CH2COOH | propionsav | -22 | 141 | keverhető |
| CH3(CH2)2COOH | vajsav | -5 | 163 | keverhető |
| CH3(CH2)3COOH | valeriánsav | -35 | 187 | 5 |
| CH3(CH2)4COOH | kapronsav | -3 | 205 | 1.1 |
| C6H5COOH | benzoesav | 122 | 249 | 0.29 |
Koncepció áttekintő gyakorlatok
-
Melyik vegyületnek magasabb a forráspontja – a butánsavnak (moláris tömege 88) vagy a 2-pentanonnak (moláris tömege 86)? Magyarázza meg.
-
Várható, hogy a vajsav (butánsav) jobban vagy kevésbé oldódik vízben, mint az 1-butanol? Magyarázza meg.
Válaszok
-
a vajsav a hidrogénkötés miatt (A 2-pentanonban nincs intermolekuláris hidrogénkötés.)
-
jobban oldódik, mert kiterjedtebb a hidrogénkötés
Főbb tanulságok
- A karbonsavak forráspontja magas más hasonló moláris tömegű anyagokhoz képest. A forráspontok a moláris tömeggel nőnek.
- Az egy-négy szénatomot tartalmazó karbonsavak teljesen elegyednek a vízzel. Az oldhatóság a moláris tömeggel csökken.
Feladatok
-
Melyik vegyületnek magasabb a forráspontja: CH3CH2CH2OCH2CH3 vagy CH3CH2CH2COOH? Magyarázd meg.
-
Melyik vegyületnek van magasabb forráspontja-CH3CH2CH2CH2CH2CH2OH vagy CH3CH2CH2COOH? Magyarázd meg.
-
Melyik vegyület oldódik jobban vízben-CH3COOH vagy CH3CH2CH2CH2CH3? Magyarázd meg.
-
Melyik vegyület oldódik jobban vízben-CH3CH2COOH vagy CH3CH2CH2CH2CH2CH2COOH? Magyarázza meg.
Válaszok
-
CH3CH2CH2COOH a hidrogénkötés miatt (A CH3CH2CH2OCH2CH3 esetében nincs intermolekuláris hidrogénkötés.)
-
CH3COOH, mert hidrogénkötést létesít a vízzel (Nincs molekulák közötti hidrogénkötés a CH3CH2CH2CH2CH3-mal.)
