Tanulási célok
- Írd meg egy egyszerű ionos vegyület kémiai képletét.
- Ismerd fel a többatomos ionokat a kémiai képletekben.
Egyszerű ionos vegyületek kémiai képleteivel már találkoztunk. A kémiai képlet a vegyületben lévő elemek és azok arányainak tömör felsorolása. Ahhoz, hogy jobban megértsük, mit jelent egy kémiai képlet, meg kell vizsgálnunk, hogyan épül fel egy ionos vegyület az ionjaiból.
Az ionos vegyületek pozitív és negatív ionok váltakozásaként léteznek szabályos, háromdimenziós tömbökben, amelyeket kristályoknak nevezünk (\(\PageIndex{1}\) ábra). Mint látható, a tömbben nincsenek egyedi NaCl “részecskék”; ehelyett a nátrium- és kloridionok váltakozásából álló folyamatos rács van. A nátriumionok és a kloridionok arányát azonban a lehető legkisebb egész számokban kifejezve használhatjuk a vegyület leírására. A nátrium-klorid esetében a nátriumionok és a kloridionok aránya a legkisebb egész számokban kifejezve 1:1, így a NaCl (egy Na- és egy Cl-jel) jelet használjuk a vegyület ábrázolására. A NaCl tehát a nátrium-klorid kémiai képlete, amely tömören kifejezi a vegyületben lévő különböző ionok relatív számát. Egy makroszkópikus minta NaCl-párok miriádjaiból áll; minden egyes párt képletegységnek nevezünk. Bár kényelmes azt gondolni, hogy a NaCl-kristályok egyedi NaCl-egységekből állnak, a \(\PageIndex{1}\) ábra azt mutatja, hogy egyetlen ion sem társul kizárólagosan egyetlen másik ionhoz. Minden iont ellentétes töltésű ionok vesznek körül.
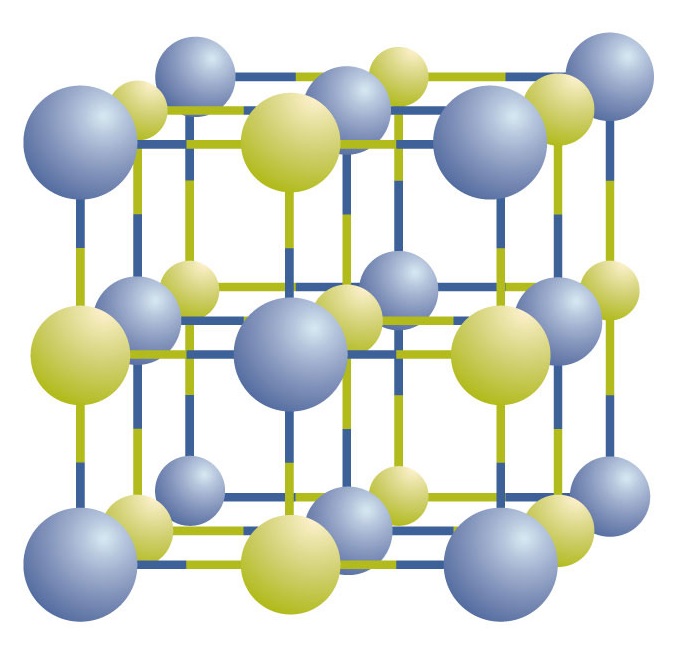
\(\PageIndex{1}\) ábra Egy nátrium-klorid kristály. A kristály váltakozó pozitív és negatív ionok háromdimenziós elrendezését tartalmazza. A pontos mintázat a vegyülettől függ. Az itt látható nátrium-klorid kristálya nátrium- és klórionok váltakozó halmaza.
Az ionos vegyületek képlete többféle konvenciót követ. Először is, a kationt az anion elé írjuk. Mivel a legtöbb fém kationokat, a legtöbb nemfém pedig anionokat képez, a képletekben általában először a fém, majd a nemfém szerepel. Másodszor, a töltéseket nem írják a képletbe. Ne feledje, hogy egy ionos vegyületben az alkotórészek ionok, nem pedig semleges atomok, még akkor is, ha a képlet nem tartalmaz töltéseket. Végül, egy ionos vegyület megfelelő képlete mindig a következő szabálynak engedelmeskedik: az összes pozitív töltésnek meg kell egyeznie az összes negatív töltéssel. Bármely ionkombináció helyes képletének meghatározásához határozzuk meg, hogy az egyes ionokból mennyi szükséges ahhoz, hogy a vegyület összes pozitív és negatív töltése egyensúlyban legyen.
Ez a szabály végső soron azon a tényen alapul, hogy az anyag összességében elektromosan semleges.
A konvenció szerint feltételezzük, hogy csak egy atom van, ha nincs index. Nem használunk 1-et indexként.
Ha megnézzük a lítiumionokból és brómionokból álló ionos vegyületet, akkor azt látjuk, hogy a lítiumionnak 1+ töltése van, a brómionnak pedig 1- töltése. Mindkettőből csak egy-egy ionra van szükség e töltések kiegyenlítéséhez. A lítiumbromid képlete LiBr.
Amikor magnéziumból és oxigénből ionos vegyület keletkezik, a magnéziumionnak 2+ töltése van, az oxigénatomnak pedig 2- töltése. Bár mindkét ionnak nagyobb a töltése, mint a lítiumbromidban lévő ionoknak, mégis egy az egyben egyensúlyban vannak egymással. Ezért ennek az ionos vegyületnek a helyes képlete MgO.
Most nézzük meg a magnézium és a klór által alkotott ionos vegyületet. A magnéziumionnak 2+ töltése van, míg a klórionnak 1-es töltése:
Mg2+ Cl-
Azáltal, hogy mindkettőből egy-egy iont egyesítünk, a pozitív és negatív töltések nem egyenlítődnek ki teljesen. A legegyszerűbb módja e töltések kiegyenlítésének, ha minden egyes magnéziumionhoz két kloridion jelenlétét feltételezzük:
Mg2+ Cl- Cl-
Most a pozitív és negatív töltések egyensúlyban vannak. Ennek az ionos vegyületnek a kémiai képletét írhatnánk úgy is, hogy MgClCl, de a konvenció szerint numerikus indexet használunk, ha egynél több ion van egy adott típusból – MgCl2. Ez a kémiai képlet azt mondja, hogy ebben a képletben egy magnéziumion és két kloridion van. (A képlet “Cl2” részét ne úgy olvassuk, mint a kétatomos elemi klór molekuláját. A klór ebben a vegyületben nem létezik kétatomos elemként. Inkább két önálló kloridionként létezik). A konvenció szerint az ionos vegyületek képleteiben a legkisebb egész számarányt használják. Az Mg2Cl4 képletben az ionok 1:2 arányban kiegyensúlyozott töltéssel rendelkeznek, de ez nem a legkisebb egész szám arány.
A konvenció szerint az ionok képleteiben az ionok legkisebb egész szám arányát használják. Kivételt képeznek bizonyos ionok, például a Hg22+
Példa \(\PageIndex{1}\)
Írd meg az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a nátriumion és a kénion
- az alumíniumion és a fluoridion
- a 3+ vasion és az oxigénion
Solution
- A valenciahéj-oktett kialakításához a nátrium 1+ töltésű iont alkot, míg a kénion 2- töltésű. A kénion 2-es töltésének ellensúlyozásához két nátrium 1+ ionra van szükség. Ahelyett, hogy a képletet NaNaS-ként írnánk, egyezményesen Na2S-re rövidítjük.
- Az alumíniumionnak 3+ töltése van, míg a fluor által képzett fluoridionnak 1-es töltése van. Az alumíniumion 3+ töltésének kiegyenlítéséhez három fluor 1-ionra van szükség. Ezt a kombinációt AlF3.
- Az elektron két lehetséges iont is képezhet, de itt a 3+ töltéssel rendelkező ion van megadva. Az oxigénatom ionként 2-es töltéssel rendelkezik. A pozitív és negatív töltések kiegyenlítéséhez a legkisebb közös többszörös-6-ot keressük: két vas 3+ ion 6+-ot, míg három 2-es oxigénion 6-ot ad, így kiegyenlítődik az összes pozitív és negatív töltés. Így ennek az ionos vegyületnek a képlete Fe2O3.
GYakorlat \(\PageIndex{1}\)
Írd meg az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a kalciumion és az oxigénion
- a 2+ rézion és a kénion
- a 1+ rézion és a kénion
Poliatomos ionok
Egyes ionok egymáshoz kötött atomcsoportokból állnak és összességében elektromos töltéssel rendelkeznek. Mivel ezek az ionok egynél több atomot tartalmaznak, poliatomos ionoknak nevezzük őket. A többatomos ionoknak jellegzetes képleteik, neveik és töltéseik vannak, amelyeket érdemes megjegyezni. Például az NO3- a nitrátion; egy nitrogén- és három oxigénatomot tartalmaz, és összességében 1-es töltéssel rendelkezik. A \(\PageIndex{1}\) táblázat a leggyakoribb többatomos ionokat sorolja fel.
| Név | Formula |
|---|---|
| ammóniumion | NH4+ |
| acetátion | C2H3O2- |
| karbonátion | CO32- |
| hidrogén-karbonátion (bikarbonátion) | HCO3- |
| cianidion | CN- |
| hidroxidion | OH- |
| foszfátion | PO43- |
| hidrogén-foszfátion | HPO42- |
| dihidrogén-foszfátion | H2PO4- |
| nitrátion | NO3- |
| szulfition | SO32- |
A többatomos ionokat tartalmazó ionos vegyületek képleteinek felállítására ugyanaz a szabály érvényes, mint az egyatomos (egyszeres) ionokat tartalmazó képletekre.atomos) ionokat tartalmaznak: A pozitív és negatív töltéseknek egyensúlyban kell lenniük. Ha egy adott többatomos ionból egynél többre van szükség a töltésegyensúlyhoz, akkor a többatomos ion teljes képletét zárójelbe kell tenni, és a numerikus indexet a zárójelen kívül kell elhelyezni. Ez azt mutatja, hogy az index a teljes többatomos ionra vonatkozik. Egy példa: Ba(NO3)2.
Példa \(\PageIndex{2}\)
Írd meg az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a káliumion és a szulfátion
- a kalciumion és a nitrátion
Solution
- A káliumionok töltése 1+, míg a szulfátionoké 2-. Két káliumionra lesz szükségünk a szulfátion töltésének kiegyenlítéséhez, így a helyes kémiai képlet: K2SO4.
- A kalciumionok töltése 2+, míg a nitrátionoké 1-. Két nitrátionra lesz szükségünk, hogy minden egyes kalciumion töltését kiegyenlítsük. A nitrát képletét zárójelbe kell tenni. Így ennek az ionos vegyületnek a képleteként Ca(NO3)2-t írunk.
gyakorlat \(\PageIndex{2}\)
Írd meg az egyes ionpárokból álló ionos vegyület kémiai képletét.
- a magnéziumion és a karbonátion
- az alumíniumion és az acetátion
Ionvegyületek felismerése
Az ionvegyületek felismerésének két módja van. Először is, a fém és nemfém elemek közötti vegyületek általában ionosak. Például a CaBr2 tartalmaz egy fémes elemet (kalcium, 2A csoportba tartozó fém) és egy nemfémes elemet (bróm, 7A csoportba tartozó nemfém). Ezért valószínűleg ionos vegyületről van szó. (Valójában ionos.) Ezzel szemben az NO2 vegyület két olyan elemet tartalmaz, amelyek mindketten nemfémek (az 5A csoportba tartozó nitrogén és a 6A csoportba tartozó oxigén). Ez nem ionos vegyület; a máshol tárgyalt kovalens vegyületek kategóriájába tartozik. Vegyük észre azt is, hogy a nitrogén és az oxigén ezen kombinációja nem rendelkezik meghatározott elektromos töltéssel, tehát nem a nitritionról van szó.
Második, ha egy vegyületben felismerjük a többatomos ion képletét, akkor a vegyület ionos. Ha például a Ba(NO3)2 képletet látja, akkor az “NO3” részt felismerheti a nitrátionként, \(\rm{NO_3^-}\). (Ne feledje, hogy az ionos vegyületek képleteinek írásakor az a szokás, hogy az ionos töltés nem szerepel a képletben). Ez arra utal, hogy a képlet másik része, a Ba, valójában a Ba2+ ion, amelynek 2+ töltése kiegyenlíti a két nitrátion összes 2-es töltését. Így ez a vegyület is ionos.
Példa \(\PageIndex{3}\)
Az egyes vegyületek ionos vagy nem ionos jellegének meghatározása.
- Na2O
- PCl3
- NH4Cl
- OF2
Solution
- A nátrium fém, az oxigén pedig nem fém, ezért a Na2O várhatóan ionos lesz.
- A foszfor és a klór is nem fém. Ezért a PCl3 nem ionos.
- A képletben szereplő NH4 az ammóniumiont, az NH4+-t jelenti, ami arra utal, hogy ez a vegyület ionos.
- Az oxigén és a fluor egyaránt nem fém. Ezért az OF2 nem ionos.
GYakorlat \(\PageIndex{3}\)
Identifikáljuk az egyes vegyületeket ionosnak vagy nem ionosnak.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Nézzünk közelebb!
A tudomány már régóta felismerte, hogy a vér és a tengervíz összetétele hasonló. Hiszen mindkét folyadékban ionos vegyületek vannak oldva. A hasonlóság több lehet, mint puszta véletlen; sok tudós úgy véli, hogy a földi élet első formái az óceánokban keletkeztek. Közelebbről megvizsgálva azonban kiderül, hogy a vér és a tengervíz egészen más. A nátrium-klorid 0,9%-os oldata megközelíti a vérben található sókoncentrációt. Ezzel szemben a tengervíz alapvetően 3%-os nátrium-klorid oldat, ami több mint háromszorosa a vérben lévő koncentrációnak. Íme egy összehasonlítás a vérben és a tengervízben található ionok mennyiségéről:
| Ion | százalék a tengervízben | százalék a vérben |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl- | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
A legtöbb ion a tengervízben nagyobb mennyiségben fordul elő, mint a vérben, néhány fontos kivétellel. A vérben sokkal több hidrogén-karbonátion (HCO3-) van, mint a tengervízben. Ez a különbség azért jelentős, mert a hidrogén-karbonátion és néhány rokon ion döntő szerepet játszik a vér sav-bázis tulajdonságainak szabályozásában. A hidrogén-foszfátionok – HPO42- és H2PO4 – mennyisége a tengervízben nagyon alacsony, de a vérben nagyobb mennyiségben vannak jelen, ahol szintén befolyásolják a sav-bázis tulajdonságokat. Egy másik jelentős különbség, hogy a vérben nincs jelentős mennyiségű szulfátion (SO42-), de ez az ion jelen van a tengervízben.
Főbb tanulságok
- Az ionos vegyületek helyes kémiai képletei kiegyensúlyozzák a teljes pozitív töltést a teljes negatív töltéssel.
- Léteznek össztöltéssel rendelkező atomcsoportok is, amelyeket többatomos ionoknak neveznek.
Megosztók és hozzárendelések
-
Névtelen
