Sykliinin
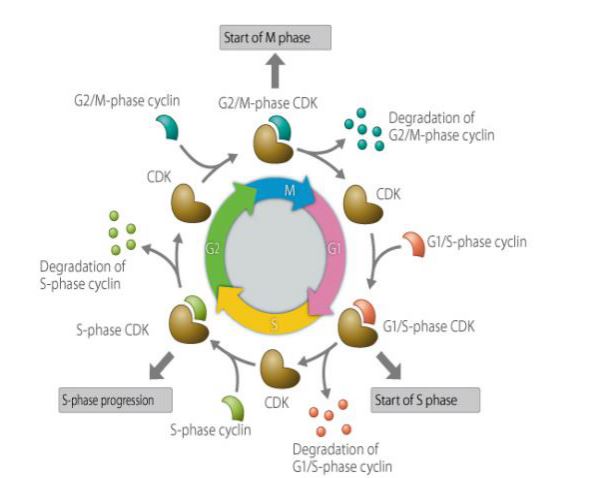
Sykliini on eräänlainen proteiini, joka ekspressoituu, kerääntyy ja hajoaa solusyklin aikana, ja se on vuorovaikutuksessa sykliini-riippuvaisten kinaasien kanssa vaikuttaakseen solusyklin toimintaan. Sykliini on mukana solusyklin säätelemissä proteiineissa, ja sen pitoisuus on syklinen ja syklinen solusyklissä. Solusyklin vaiheesta riippuen pitoisuus on joskus jopa useita tuhansia kertoja, ja joskus se laskee nollaan. Säätelyalayksikkönä sykliini sitoutuu sykliiniriippuvaisiin proteiinikinaaseihin ja aktivoi niitä. Eri sykliinit ilmentyvät solusyklin eri vaiheissa. Nisäkässoluissa sykliini A alkaa ilmentyä ja kertyä vähitellen varhaisessa G1-vaiheessa, jolloin se saavuttaa G1/S-risteyksen, ja pitoisuus saavuttaa maksimin ja pysyy G2/M-vaiheessa. Sykliini B ekspressoituu myöhäisestä G1-vaiheesta alkaen ja kertyy vähitellen. Se saavuttaa maksiminsa myöhäisessä G2-vaiheessa ja säilyy M-vaiheen keskivaiheeseen asti, minkä jälkeen se hajoaa nopeasti. Sykliini D, joka on G1-vaiheen sykliini, ilmentyy jatkuvasti solusyklin aikana, kun taas sykliini E alkaa ilmentyä ja vähitellen kertyä myöhäisessä M-vaiheessa ja varhaisessa G1-vaiheessa saavuttaen maksiminsa myöhäisessä G1-vaiheessa ja saavuttaen sitten vähitellen maksimipitoisuutensa, joka vähenee myöhäiseen G2-vaiheeseen asti. Sykliinillä on tärkeä rooli solusyklin säätelyssä. Sykliinien mekanismin tutkimisella on suuri merkitys syövän hoidossa.
Sykliiniperheen jäsenet ja niiden tehtävät vastaavasti
Tähän mennessä ihmisen sykliinit on eristetty ja nimetty yhteensä kahdeksaan luokkaan, nimittäin A:sta H:han, ja niihin kuuluu joitakin alaluokkia (kuten sykliini D1, D2, D3), joista F, G ja H ovat viimeisimpiä löytäjiä. Kaikilla sykliineillä on tiettyjä aminohapposekvenssin yhtäläisyyksiä, ja ne toimivat siten sykliinien molekyylirakenteellisina merkkiaineina. Tämä homologinen aminohappoalue sykliinissä on niin sanottu sykliinikasetti, joka on erittäin konservoitunut 100-150 aminohapon sekvenssialue eri organismien sykliinien välillä. Ihmisen sykliini sisältää myös viallisen kasetin tai aminohapposekvenssialueen, joka sisältää runsaasti proliini-, glutamiinihappo-, asparagiinihappo-, seriini- ja treoniinijäämiä (jäljempänä ’PEST-aminohapposekvenssialue’). Sykliini B:n sitoutuminen sykliini-riippuvaiseen kinaasiin p34CDC2:een kontrolloi mitoosiin pääsyä ja sieltä poistumista, joka syntetisoituu S-vaiheesta G2 /M-vaiheeseen ja vähitellen kerääntyy ja sitoutuu p34CDC2:een. M-vaiheessa se vähitellen hajoaa; päinvastoin, M-vaiheesta poistuminen riippuu sykliinin nopeasta hajoamisesta jakautumisen loppuvaiheessa, mikä johtaa inaktiivisen alayksikön p34CDC2 vapautumiseen. Ihmissoluissa sykliini B kerääntyy sytoplasmaan ja pääsee tumaan ennen kuin ydinkalvo katoaa. Aktivoituaan sykliini B/CDC fosforyloi ryhmän proteiineja, mukaan lukien lamiini, vimentiini ja kalsium, jolla on tärkeä rooli kromosomien keskittymisessä, ydinkalvon hajoamisessa, intermediääristen filamenttien depolymerisaatiossa ja mikrofilamenttien uudelleenorganisoinnissa. Sykliini B:llä on myös tärkeä rooli mitoosin faasimuutoksessa, joka on klassinen pilkkoutumissyklin proteiini. Sykliini A:lla on rooli sekä G2/M- että G1/S-vaiheen siirtymissä. Sitä esiintyy ennen DNA-synteesin alkua, ja se lisääntyy vähitellen jakautumista edeltävään vaiheeseen asti ja hajoaa keskivaiheessa. Kun se indusoi mitoosia, se eroaa monilta osin todellisesta mitoottisesta sykliini B:stä. Sykliini C:n pitoisuus muuttuu vain vähän koko solusyklin ajan, ja se lisääntyy vain hieman G1:n alussa. Sykliini C:n mRNA:n huippu on G1:n puolivälissä synkronoiduissa HeLa-soluissa, mikä on aikaisemmin kuin sykliini A:lla, jolla saattaa olla merkitystä G1:ssä. Sykliini E:llä on selvä jaksottainen ilmentyminen solusyklin aikana, ja sen huippu on G1/S-vaiheen siirtymävaiheessa. Sen tehtävänä on ohjata solua siirtymään S-vaiheeseen, mikä voi olla nopeutta rajoittava tekijä G1/S-vaiheen siirtymässä. Nisäkässoluissa se sitoutuu sykliini A:n tavoin p33CDK2:een, kompleksiin, jolla on histoni H1:n kinaasiaktiivisuutta G1- ja S-vaiheen alkuvaiheessa, mutta sykliini A ja E voivat olla vuorovaikutuksessa retinoblastoomaproteiinin kanssa erillisten kompleksien muodostamiseksi, mikä viittaa siihen, että CDK2/sykliini A:n tai E:n muodostamat kompleksit voivat epäsuorasti säädellä geenien ilmentymistä G1- ja S-vaiheissa. Sykliini E:llä voi olla rooli sykliini D:ssä, jolla on tärkeä rooli DNA:n replikaation käynnistymisessä, G1 /S-muunnoksessa, ja sen yliekspressio nopeuttaa solun pääsyä S-vaiheeseen. Sykliini D saattaa kontrolloida prosessin varhaista G1-vaihetta joko ennen sykliini E:tä tai samanaikaisesti sen kanssa. Sykliini D:llä on kolme alatyyppiä (D1, D2, D3), ja sen ilmentyminen vaihtelee solukohtaisesti, ja sitä kontrolloivat eri kromosomialueet (D1: 11q13; D2: 12p13; D3: 6p21). Alatyypeillä voi olla erilaisia vaikutuksia. Sykliini D:n huomattavia ominaisuuksia ovat: se indusoituu ilmentymään vastauksena ulkoisiin ärsykkeisiin, ja sillä on suuri kasvutekijäindusoituvuus, ja se toimii kasvutekijäanturina, jolla on tärkeä rooli ulkoisten signaalien ja solun sisäisen syklin yhdistämisessä. Rooli puolestaan johtaa sen hallitsemattomaan ilmentymiseen, jolloin solusykli ei ole enää tai on vähemmän riippuvainen kasvutekijöistä ja voi aiheuttaa syöpää. Sykliini D-CDK-kompleksi on paras ehdokas G1-vaiheen retinoblastooma (Rb) -proteiinikinaasi. Sykliini D sitoutuu Rb-proteiinin N-terminaaliseen alueeseen, fosforyloi Rb:n myöhäisessä G1-vaiheessa, ja sykliini D1:n synteesi ja aktivoituminen johtaa Rb:n fosforylaation inaktivoitumiseen ja sykliini D1:n alaregulaatioon, ja D1-CDK4-kompleksi muodostaa negatiivisen takaisinkytkennän G1-vaiheessa, mikä puolestaan sammuttaa sykliini D1:n ekspression. Sykliini D:llä ja Rb:llä on tärkeä rooli solujen lisääntymisessä ja erilaistumisessa, kun sykliini D1 on erilainen G1-vaiheessa. Lähde-ekspressiossa Rb-fosforylaatio on normaalia aikaisemmin; G1-vaihe kiihtyy, ja antisykliini D1 -vasta-aine mikroinjektoidaan G1-alkuisiin metafaasisoluihin; useimmat solut pysähtyvät ennen S-vaihetta, eikä toimivan Rb:n puute voi aiheuttaa tätä estoa; päätellään, että sykliini D1:n tärkeä tehtävä on inaktivoida Rb:n fosforylaatio, mikä indusoi pääsyä S-vaiheeseen ja DNA:n replikaatiota. SykliiniF on runsain sykliiniproteiini (molekyylipaino 87 kDa), ja sen mRNA ilmentyy yleisesti ihmisen eri kudossoluissa, ja solusyklissä tapahtuu merkittäviä muutoksia. Huippu on G2-vaiheessa, kuten sykliini A:lla, ja se laskee ennen kuin sykliini B:n mRNA-taso laskee. Sykliini F -proteiini kertyy solujen välisessä vaiheessa ja tuhoutuu mitoosivaiheessa. Se on useimmissa soluissa tuman sisällä. Yliekspressio tai mutaatio ihmissoluissa johtaa PEST-aminohapposekvenssialueiden puuttumiseen, mikä johtaa G2-vaiheen solujen lisääntymiseen. Sykliini G muistuttaa eniten fissiohiivan sykliini B:tä, jolla on rooli G1/S-muunnoksessa, mutta sykliini G:n mRNA:lla ei ole selvää soluriippuvuutta, mutta se voi stimuloitua solun kasvun myötä. Tekijä indusoi ja ylläpitää kohonnutta tasoa. Sykliini g -geeni sisältää kaksi erilaista p53:n sitoutumiskohtaa, joista toinen on transkription aloituskohdan yläjuoksulla, mikä viittaa siihen, että p53:lla on mahdollisuus aktivoida tehokkaasti sykliini g -geeni. Sykliini H, joka on ainakin biologiselta vaikutukseltaan p53:n downstream-välittäjä, on molekyylipainoltaan 37 kD:n proteiini, joka löydettiin eristämällä ja puhdistamalla CDK:ta aktivoiva kinaasi (CAK).
Sykliinin
funktio Sykliinin
solusyklin ja syövän välisten yhteyksien tutkimuksella on suuntaa-antava merkitys kliinisen onkologian tutkimukselle. Se voi tarjota tiettyjä kohteita kliinistä hoitoa varten, kuten sykliini D:n estäminen, tai jäljitellä solusyklin estäjien vaikutusta syöpäsolujen jakautumisen estämiseksi, ja tarjota joitakin indikaattoreita kliinistä diagnoosia, erotusdiagnoosia ja ennustetta varten. Michaelet al analysoi bcl-1-geenin uudelleenjärjestelyä ja sykliini D1 -proteiinin ilmentymistä 32 tapauksessa manttelisolulymfoomaa, 17 tapauksessa bcl-1-geenin uudelleenjärjestelyä ja 24 tapauksessa sytoplasmisen sykliini D1:n ilmentymistä, ja 40 tapauksessa kontrolliryhmässä vain 9 tapausta ei-MCL B-solulymfoomaa oli positiivinen. He uskovat, että sykliini D1:tä voidaan käyttää MCL:n erotusdiagnoosina ja B-solulymfooman erotusdiagnoosina. Sykliini ilmentyy ajoittain solusyklin aikana, ja tietyt erityiset sykliini-CDK-kompleksit ovat välttämättömiä tietyn solusyklin läpikäymiseen, mikä viittaa siihen, että sykliiniä voidaan käyttää solujen proliferatiivisen tilan indikaattorina. Tietyn sykliinin ilmentymissuhde voi ennustaa tietyn kudoksen solujen osuutta tietyssä solusyklissä. Mitä suurempi on kasvainsolujen pahanlaatuisuus, sitä vakavampi on solusyklin häiriö, joten solusyklin osoittaman tiedon avulla on mahdollista heijastaa potilaiden ennustetta ja toimia mahdollisena ennusteindikaattorina. Keyomarsi et al. käyttivät kontrollitutkimuksina 9 rintasyöpäkirurgista näytettä ja viereisiä ei-syöpäkudoksia: Kahdeksassa tapauksessa syöpäkudoksen sykliini E ilmentyi laadultaan ja määrältään epänormaalisti, ja siinä oli vähintään kolme erilaista molekyylipainoa. Sykliini E oli yliekspressoitunut, kun taas c-erbB2 oli yliekspressoitunut vain 3 tapauksessa. Kasvaimen porrastuksen lisääntyessä sykliini E -proteiinin pitoisuus kasvoi merkittävästi, kun taas proliferoivan solun ydinantigeenin (PCNA) taso kasvoi vain vähän. Sykliini E:n rakennetta havaittiin neljässä korkeimmassa staging-asteessa. Dutta et al. käyttivät antisykliini A, B, E -vasta-aineita 48 rintasyövän parafiinileikkeessä ja havaitsivat, että sykliini A:n ja B:n keskimääräinen positiivinen indeksi kasvoi merkittävästi S-vaiheen lisääntyessä (P < 0,05). Sykliini A korreloi positiivisesti Ki-67:n ja S-vaiheen fraktion kanssa (P < 0,05). Bellacosaet al tutkivat 51 tapausta primaarista kurkunpään levyepiteelikarsinoomaa ja seurasivat niitä 29 kuukauden ajan. Uskotaan, että sykliinigeenin amplifikaatiota voidaan käyttää kurkunpään syövän itsenäisenä ennusteindikaattorina. Bettiche ym. tutkivat kuitenkin 53 ei-pienisoluisen keuhkosyövän tapausta, joissa oli tehty kirurginen resektio, ja 25 tapauksessa oli sykliini D1:n yliekspressio, joka liittyi huonoon kudosdifferentiaatioon, vähäisempään lymfosyyttiseen infiltraatioon kasvaimessa ja alhaisempaan paikalliseen uusiutumisprosenttiin (P < 0. 05). He katsovat, että tarvitaan laajempia kliinisiä tutkimuksia, jotta sykliini D1:n ilmentymisen prognostista merkitystä voidaan testata tarkemmin.
Viite
- He G, Kuang J, Koomen J ym. trimeerisen proliferoivan solun ydinantigeenin rekrytoituminen G1-vaiheen sykliini-riippuvaisten kinaasien toimesta DNA-vaurion jälkeen platinapohjaisten kasvainlääkkeiden avulla. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Temporal and Spatial Expression of Cyclin H in Rat Spinal Cord Injury. Neuromolecular Medicine. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, ym. bcl-2:n, sykliini D1:n, p53:n ja proliferoivan solun ydinantigeenin kliiniset piirteet ja ilmentyminen syndroomisessa ja ei-syndroomisessa keratokystisessa odontogeenisessä kasvaimessa. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. HOXB5:n, sykliini D1:n ja PCNA:n yliekspressio synnynnäisessä kystisessä adenomatoidisessa epämuodostumassa. Fetal Diagnosis & Therapy. 2011, 29(4):315-320.
