Lääkäreitä on jo pitkään turhauttanut silmänsisäisen paineen (intraocular pressure, IOP) suhteettoman suuri merkitys glaukooman hoidossa. Koska se on ainoa tekijä, johon voidaan tehdä lääketieteellisiä tai kirurgisia toimenpiteitä, sen rooli on elintärkeä. Tonometria on kuitenkin luonnostaan rajallinen: Muutaman kuukauden välein tehty yksittäinen lukema ei pysty kuvaamaan IOP:n vuorokautista nousua ja laskua. Jopa potilaiden tuominen useisiin tonometrialukemiin ei anna ihanteellista käsitystä potilaan IOP-ominaisuuksista.

|
|
| Tämä implantoitava mikrofluidinen 24-tunnin IOP-sensori on tällä hetkellä kehitteillä Stanfordin yliopistossa. Kuva: Ishmail E. Araci |
Asiantuntijat uskovat, että potilaille sovitetaan aikanaan piilolinssiin tai silmälaseihin sijoitettu pieni anturi tai heidät lähetetään silmälääkärille silmään istutettavaksi. Se mittaisi jatkuvasti IOP:tä, mikä lisäisi eksponentiaalisesti saatujen tietojen määrää – ja toivottavasti myös niiden arvoa. Jos nykyinen lähestymistapa silmänpaineen dokumentointiin on kuin tilannekuvan ottaminen, jatkuva 24 tunnin silmänpaineen seuranta muistuttaa enemmän videokuvaa, joka tallentaa muutokset ajan mittaan sen sijaan, että se antaisi vain yhden staattisen lukeman.
Nämä vempaimet ovat edelleen kehitteillä. Ovatko ne valmiita prime timeen? Katsotaanpa, miten silmänpaineen vaihtelu tapahtuu, millaisia kliinisiä haasteita se aiheuttaa ja mitä nykyisiä huipputekniikoita on käytössä, joilla pyritään seuraamaan silmänpaineen vaihtelua paremmin, jotta kliinistä ymmärrystä voitaisiin lisätä.
Liikkuva tavoite
Hoitosuunnitelman laatiminen silmänpaineen tavoitetason saavuttamisen perusteella on hankalaa, kun itse tavoite liikkuu. Silmänpaine vaihtelee päivän mittaan tunti tunnilta, minuutti minuutilta ja jopa sekunti sekunnilta useiden endogeenisten ja eksogeenisten tekijöiden perusteella.
Silmäjärjestelmässä IOP voi riippua tasapainosta kammionesteen tuotannon, ulosvirtauksen helppouden (kuinka helposti kammioneste poistuu silmästä), episkleraalisen laskimopaineen (silmän pinnalla olevien laskimoiden paine) ja uveoskleraalisen ulosvirtauksen (kammionesteen toissijainen reitti silmästä poistumiseen) välillä.
Esimerkiksi ulosvirtausmahdollisuuden lisääntyminen tai kammionesteen tuotannon väheneminen alentaisi IOP:tä, sanoo Arthur J. Sit, MD, glaukoomatutkija Mayo Clinicissä Rochesterissa, Minnesotessa. Lyhytaikaisia IOP:n hyppäyksiä voi tapahtua myös silmän räpyttelystä tai hieromisesta aiheutuvan silmään kohdistuvan paineen vuoksi tai jopa silmän liikkeiden tai verenpaineen pulsaatioiden aikana.
Intraokulaarinen paine vaihtelee myös kehon asennon, vuorokaudenaikojen (huippuarvot yöllä, laskusuhdanteet päivällä), verenpaineen ja siihen liittyvän silmän perfuusiopaineen (Ocular Perfusion Pressure, OPP) käsitteen, stressin tai kivun voimakkuuden sekä veden- ja kofeiininjuonnin vuoksi.
Lisäksi voimakas aktiivisuus ja stressi voivat saada verenpaineen, IOP:n ja OPP:n nousemaan huippuunsa, sanoo Kaweh Mansouri, MD, MPH, silmälääkäri Geneven yliopistosta ja Coloradon Denverin yliopistosta. Verenpaineen mittaamisella yhdessä IOP:n kanssa on arvoa sen määrittämiseksi, miten verenpaine vaikuttaa IOP:hen, tohtori Mansouri sanoo. Tutkijat käyttävät parhaillaan 24 tunnin IOP-seurantalaitteita tutkiakseen näitä vaikutuksia glaukooman etenemiseen.
|
Dos and Don’ts of IOP Measurement Älä tee diagnoosia tai hoitoa vain yhden mittauksen jälkeen. Tohtori Sowka neuvoo optikoita olemaan aloittamatta hoitoa heti, ellei paine ole liian korkea tai ellei näköhermo ole jo vakavasti vaurioitunut ja haavoittuva; sen sijaan mittaa paine useita kertoja. On myös hyvä ottaa useita painemittauksia hoidon aloittamisen jälkeen, jotta voidaan selvittää, toimiiko lääkitys, tohtori Sowka sanoo. Yksi IOP-lukema lääkityksen aloittamisen jälkeen ei todellakaan riitä todellisen tehon arviointiin. Kehota potilaita rentoutumaan. Kuten aiemmin mainittiin, potilaat saattavat jännittää tai pidättää hengitystään tonometrian aikana. Kehota heitä säännöllisesti rentoutumaan ja hengittämään normaalisti prosessin aikana, kehottaa tohtori Mansouri. Älkää luopuko epäilyksistänne. Jos potilaan IOP-mittaukset eivät näytä täsmäävän näkökenttä- ja näköhermoarvioiden kanssa, potilaan IOP:n kanssa saattaa olla tekeillä enemmän kuin olet tajunnut, sanoo tohtori Hartwick. Pyydä potilasta tulemaan takaisin ja mittaamaan silmänpaineensa eri vuorokaudenaikana, hän lisää. Harkitse valikoiduilla potilailla vuorokausikäyrää. Vuorokausikäyrän tallentaminen tonometrisesti on useimmille potilaille epäkäytännöllistä ja työlästä. Mutta jos silmänpaineen taso ja vaurion laajuus vaikuttavat epäjohdonmukaisilta – esimerkiksi epäiltäessäsi normaalijännitysglaukoomaa – harkitse mahdollisuutta, tohtori Davey sanoo. Jos potilas suostuu siihen, tuo hänet varhain aamulla ja kirjaa silmänpaine tunnin välein kahdeksan tai kymmenen tunnin ajan. ”Näin saat toimiston vuorokausikäyrän, joka ei ehkä edusta täysin päivä- ja yöarvoja, mutta ainakin saat enemmän kuin yhden mittauksen”, hän sanoo. |
Näin nämä muuttujat vaikuttavat IOP:hen:
– Kehon asento. Riippuen potilaan asennosta tuolissa paine voi nousta tai laskea. Esimerkiksi IOP on alhaisin, kun potilas istuu neutraaliasennossa. ”Lähes kaikki muu aiheuttaa IOP:n nousua, kuten niskan taivuttaminen eteenpäin, pään taivuttaminen taaksepäin, pään kääntäminen sivulle, makaaminen, kumartuminen, silmien räpyttely tai hierominen”, sanoo tohtori Sit.
– Vedenkulutus. Suuren vesimäärän juominen saa potilaan veritilavuuden kasvamaan lyhyeksi ajaksi. Myös laskimopaine nousee, kun potilas kuluttaa enemmän vettä. ”Heidän tarvitsee vain juoda 16-32 unssia eli yksi tai kaksi pientä pulloa vettä, ja viidessä minuutissa paine nousee 6 mm Hg”, sanoo Pinakin Gunvant Davey, PhD, OD, professori ja glaukooma-asiantuntija Western University of Health Sciencesin optometrian korkeakoulussa Pomonassa, Kaliforniassa.
– Kellonaika. Kirjallisuuden mukaan IOP-huippu esiintyy yöllä kahdella kolmasosalla potilaista. Syynä on se, että yöllä vesikalvoa erittyy liian vähän, sanoo Joseph Sowka, OD, optometrian professori Nova Southeastern University College of Optometry -korkeakoulussa Ft. Lauderdalessa, Flauderdalen osavaltiossa.
Tohtori Mansouri esimerkiksi tarkkaili potilaita 24 tuntia unilaboratorioissa ja havaitsi, että korkeimmat silmänpaineen nousut olivat yöllä. Vaikka potilaillesi ei tehdä unitutkimuksia, he saattavat tulla vastaanotollesi illalla – jos näin on, voit odottaa näkeväsi kohonneita IOP-arvoja muihin vuorokaudenaikoihin verrattuna.
– Verenpaine. Lähtötason IOP perustuu sydänsykliin, systoliseen ja diastoliseen verenpaineeseen. Voima, jolla veri tuodaan silmään, on silmän perfuusiopaine, selittää James L. Fanelli, OD, Cape Fear Eye Institute, Wilmington, NC.
Jos verenpaine on alhainen, on vähemmän voimaa ”työntää” verta silmään, ja siksi silmän perfuusiopaine on pienempi. Tekijät, jotka aiheuttavat IOP:n kohoamisen, vaikuttavat perfuusiopaineen alenemiseen, ja tekijät, jotka alentavat verenpainetta, johtavat myös alhaisempaan perfuusiopaineeseen – tai näiden tekijöiden yhdistelmällä voi olla merkitystä, tohtori Fanelli sanoo. Verenpaineella on taipumus laskea unen aikana varhain aamulla, mikä on myös vuorokaudenaika, jolloin IOP on yleensä korkeimmillaan.1 Näillä kahdella vastakkaisella tekijällä voi olla päällekkäinen vaikutus OPP:n alentamiseen yöaikaan, mikä voi mahdollistaa silmän hermopään lisääntyneen vaurioitumisen.
– Stressi. Stressin lisääntyminen tai väheneminen aiheuttaa hormonaalisia muutoksia, jotka nostavat tai laskevat IOP-tasoja. Eräällä tohtori Mansourin potilaalla – jota tutkittiin käyttämällä piilolinssiin kiinnitettyä 24 tunnin IOP-seuranta-anturia – oli painepiikkejä aina, kun hänen koirallaan oli yöllä epileptisiä kohtauksia.
– Yleiset ”hermot”. On mahdollista, että joillakin potilailla itse silmätutkimuksen aiheuttama stressi – esimerkiksi jos he ovat huolissaan siitä, että heillä diagnosoidaan glaukooma – voi aiheuttaa IOP:n nousun, sanoo Andrew Hartwick, OD, PhD, dosentti Ohio State University College of Optometrysta Columbuksessa. He saattavat esimerkiksi puristaa silmiään, koska ovat stressaantuneita tutkimuksesta, ja IOP-lukemat nousevat.
– Myös kipu aiheuttaa IOP:n nousua, koska se aiheuttaa stressiä. Yksi tohtori Mansourin potilaista löi jalkansa pahasti parkkipaikalla. Ympärivuorokautisen seurannan tietojen mukaan hänen IOP-tasossaan oli piikki juuri sillä hetkellä, kun hän muisteli onnettomuuden tapahtuneen.
Tarkkojen IOP-lukemien seuraukset
Tutkimukset ovat osoittaneet, että IOP-piikit voivat vaikuttaa glaukooman etenemiseen.2,3 Mutta jos tutkit potilaan silloin, kun IOP-arvo on alhaisimmillaan tai korkeimmillaan, glaukooman diagnoosia tai potilaan tarvitsemaa hoitoa saatetaan yliarvioida tai aliarvioida.
”Jos saamme potilaan kiinni laskusuhdanteessa, jolloin silmänpaineen lasku on alhaisin, se voi johtaa meidät pois glaukooman harkinnasta”, varsinkin jos lukema kuuluu tilastollisesti normaaliin vaihteluväliin, tohtori Sowka sanoo. ”Toisinaan taas saatamme saada hänet kiinni IOP-huipussa, jolloin se on hieman normaalia korkeampi – skenaario, joka saa lääkärit yleensä huolestumaan turhaan.”
|
|
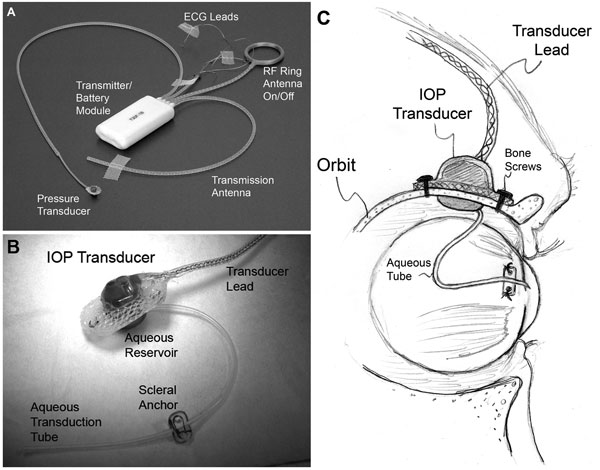
| (A) Tyypillinen T30F-totaali-implanttijärjestelmä (Konigsberg Instruments). (B) Räätälöidyn IOP-anturikotelon ekstraorbitaalinen pinta. (C) 23-ulotteinen silikoniputki kuljettaa vesivettä etukammiosta anturin intraorbitaalisella puolella olevaan nestesäiliöön (osittain näkymättömissä B:ssä); Putki (jossa on asianmukainen löysyys silmän liikkeen sallimiseksi) leikattiin ja työnnettiin etukammioon. |
IOP-arvon kirjaaminen mahdollistaisi mahdollisesti glaukooman diagnoosin ja hoidon parantamisen. ”Jos tutkijat voisivat osoittaa, että tietyt 24 tunnin IOP-mallit ovat yhteydessä glaukooman etenemiseen, on toivoa, että näiden mallien havaitseminen voisi auttaa tunnistamaan potilaat, joilla on kohonnut etenemisriski, ja että voisimme mukauttaa heidän hoitoaan vastaavasti”, tohtori Mansouri sanoo.
Glaukooma voitaisiin tunnistaa aikaisemmin, jolloin leikkaus tai lääkitys voitaisiin aloittaa nopeammin, hän lisää. Silmälääkärit voisivat myös määrittää, ovatko silmänpainetta alentavat lääkkeet tehokkaita yöllä tai tiettyjen silmänpainetta nostavien toimintojen aikana.
Todellisen silmänpaineen vaihteluvälin määrittäminen edellyttäisi jatkuvaa ympärivuorokautista silmänpaineen seurantaa. Tämä on haasteellista, koska yksittäinen IOP-mittaus, joka on kerätty normaalin vastaanottoajan aikana, ei kuvaa potilaan IOP:n vaihteluväliä, sen huippuja tai muutoksia päivän aikana.4
Juuri nyt IOP:n vaihteluvälin määrittäminen on mahdollista Goldmanin applanaatiotonometrialla (GAT) päiväkohtaisen jännityskäyrän (DTC) avulla, jossa IOP-lukemat kerätään eri ajankohtina klinikka-aikana. Tämä on kuitenkin ongelmallista sekä lääkärin että potilaan kannalta. Yöaikaisia käyriä ei kirjata, ja alle 1 prosentille potilaista tehdään DTC tai IOP:n seuranta unilaboratoriossa.4
Tutkijat mittasivat IOP:tä 24 tunnin ajan ja dokumentoivat, että IOP:n huiput olivat korkeimmillaan yöllä ja että IOP:n vaihtelu oli paljon suurempaa muina kuin virka-aikoina.5 Tutkimuksessa, johon osallistui 35 potilasta, joiden IOP:tä kirjattiin pneumonometrillä unilaboratoriossa 24 tunnin ajan, iäkkäämmillä glaukoomapotilailla kirjattiin iänmukaistettuihin ihmisiin verrattuna suurin osa korkeimmista IOP:n huippulukemista yöllä riippumatta siitä, oliko istumassa vai makuulta.6
Viime aikoina tutkijat, jotka käyttivät 24 tunnin seurantaa, ovat oppineet, että keskimääräinen silmänpaine ei nouse vain yöllä, vaan se itse asiassa piikittää jatkuvasti – ja enemmän päivällä kuin yöllä.7 Portlandissa, Oregon osavaltiossa sijaitsevan Deversin silmäinstituutin tutkijat käyttivät apinoiden silmiin istutettua telemetriajärjestelmää, joka tallensi 500 silmänpaineen mittausta sekunnissa.
He havaitsivat, että IOP vaihtelee paljon enemmän kuin aiemmin uskottiin. ”Räpäytykset ja silmänliikkeet synnyttävät suuria IOP-piikkejä, joita esiintyy noin 12 000 kertaa tunnissa ja jotka muodostavat noin 12 % IOP:n kokonaisenergiasta, joka silmän on absorboitava valveillaoloaikana”, tutkijat havaitsivat. He uskovat, että nämä apinoilla saadut tiedot ovat suunnilleen samat ihmisillä. ”IOP:tä on nyt pidettävä dynaamisena ja jatkuvasti muuttuvana, ja IOP:n vaihtelut voivat osoittautua tärkeäksi glaukooman aiheuttajaksi. ”8
Tutkijat havaitsivat myös, että vuorokausisykli ei toistu päivästä toiseen. Siksi tarvitaan jatkuvaa IOP:n seurantaa. Nykyisiä prototyyppejä ovat implantoitavat anturit ja piilolinsseihin perustuvat laitteet.
Intelligent Implantables
Muutamat start-up-yritykset ovat kehittäneet telemetrisiä paineantureita, jotka voidaan istuttaa kaihi- tai glaukoomaleikkauksen yhteydessä. ”Telemetrinen tarkoittaa, että painelukemat kerätään etänä (eli silmän sisältä) ja lähetetään langattomasti ulkoiseen lukulaitteeseen”, tohtori Sit sanoo.
Tällä hetkellä tutkitaan muun muassa seuraavia implantoitavia laitteita:

|
|
|
Pro-IOP-anturi on telemetrinen laite, joka implantoidaan implantoitavaksi IOL-lasin tavoin. Kuva: Implandata Ophthalmic Products GmbH |
– Pro-IOP. Saksalainen Implandata Ophthalmic Products työskentelee Pro-IOP:n parissa, joka on langaton silmänpaineanturi (WIT), joka saa virtansa telemetrisesti käsikäyttöisestä laitteesta. Pientä muovirengasta muistuttava WIT on halkaisijaltaan 11,3 mm.9 Se sisältää paineanturit, lämpötila-anturin, tunnistuskooderin, analogis-digitaalisen kooderin ja telemetriayksikön yhdeksi mikroelektromekaaniseksi järjestelmäksi.9
RFID-siru, jossa on sisäänrakennettu antenni, lähettää 24 tunnin IOP-lukemat ulkoiseen käsikäyttöiseen lukulaitteeseen. Potilaalla ja lääkärillä voi lopulta olla myös mahdollisuus vastaanottaa tiedot älypuhelinsovelluksen kautta. Potilas voisi myös kommunikoida lääkärin kanssa IOP-lukemista sovelluksen kautta.
Laite ei ole vielä saanut CE-merkintää Euroopassa eikä FDA:n hyväksyntää Yhdysvalloissa, mutta saksalaiset tutkijat asensivat hiljattain Pro-IOP:n ensimmäiseen ihmiskoehenkilöön, kuusikymppiseen naiseen; tietoja ei ole vielä julkaistu.9
– AcuMEMs. AcuMEMs on samannimisen amerikkalaisen yrityksen kehitteillä oleva implantoitava laite, joka toimii samalla tavalla kuin Pro-IOP. Sensori on kapasitiivinen paineanturi, joka muuttaa muotoaan IOP:n vaihteluiden myötä. ”Kun sen muoto muuttuu, sähköinen kapasitanssi muuttuu, ja tämä voidaan havaita ulkoisesti lukulaitteella”, tohtori Sit sanoo.
Anturi voidaan istuttaa etukammioon erillisenä toimenpiteenä tai osana glaukoomaleikkausta; se voidaan myös asettaa kapselipussiin kaihileikkauksen yhteydessä.
– Mikrofluidinen IOL-implantti. Stanfordin yliopiston ja israelilaisen Bar-Ilanin yliopiston tutkijat kehittävät yhdessä implantoitavaa mikrofluidista anturia. Laitepatentin mukaan silmänpaine mitattaisiin ”silmänsisäisen nesteen ja kaasun välisen vakiintuneen tasapainopaineen rajapinnan perusteella”, joka sisältyy anturin kammioihin. Potilaat ja lääkärit voisivat käyttää älypuhelinta tai ulkoista lukulaitetta IOP:n tarkistamiseen.10 Keksijät odottavat anturin patenttihyväksyntää.
Silmään istutettujen laitteiden lähettämä signaali voi teoriassa olla tarkempi kuin piilolinsseihin kiinnitettyjen laitteiden, sanoo tohtori Davey. Signaalin voimakkuus riippuu siitä, kuinka paljon energiaa laite tuottaa. ”Istutimme molemmat laitteet (Pro-IOP ja AcuMEM), eivätkä ne toimineet kovin hyvin”, tohtori Davey sanoo.
Kumpikin Pro-IOP- ja AcuMEMs-lukulaite voitaisiin mahdollisesti kiinnittää silmälaseihin, ja tiedot kerättäisiin samalla tavalla, tohtori Sit sanoo.
Ovelat piilolinssit
Tutkijat tutkivat ensimmäisen kerran piilolinssiantureita 1970-luvulla, mutta saatavilla olevat kovat piilolinssit olivat tohtori Daveyn mukaan liian epämiellyttäviä ja muuttivat potilaan silmän rakenteellista eheyttä. Se on yhä kliinisissä kokeissa Yhdysvalloissa.
Sensorit eivät myöskään olleet tarpeeksi herkkiä. ”Henkilöllä, jolla oli ’pehmeämpi’ silmä, oli tarkemmat lukemat kuin henkilöllä, jolla oli jäykempi silmä”, tohtori Davey sanoo. ”Tekniikka ei ollut tarpeeksi hyvä IOP-arvojen saamiseksi.” Paksumpi sarveiskalvo reagoi huonommin IOP:n muutoksiin, mikä tekee tonometriasta (ja piilolinssiantureista) epätarkempia.
Kontaktilinsseihin perustuvia IOP-antureita ovat:
– Triggerfish (Sensimed). Geneven yliopistossa Sveitsissä silmälääkärit tekivät tohtori Mansourin ja muiden johdolla varhaisia tutkimuksia Triggerfish-nimisestä piilolinssistä.
Triggerfish on hydrofiilinen pehmeä piilolinssi, joka on varustettu piilolinssisensorilla (CLS). CLS:ssä on kaksi limbuksen ympärillä sijaitsevaa rasitusmittaria, jotka havaitsevat muutokset silmän ympärysmitassa. ”Näiden silmän ympärysmitan muutosten uskotaan liittyvän IOP:n ja silmänsisäisen tilavuuden muutoksiin, ja tämä on todistettu enukleoiduissa silmissä”, Mansouri sanoo. Laite mittaa silmänpaineen, silmänsisäisen tilavuuden ja biomekaanisten ominaisuuksien muutosten (sarveiskalvon ja kovakalvon hystereesin ja jäykkyyden yhdistelmä) yhdistelmää, joka korreloi silmänpaineen vaihteluiden kanssa. Ulkoinen lukulaite tallentaa tiedot 24 tunnin ajalta.
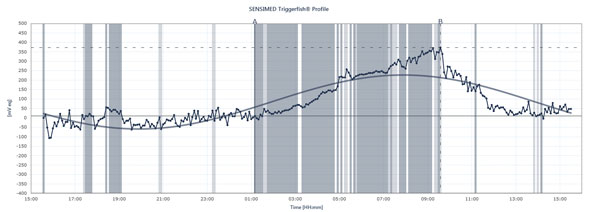
Virtauskaavio osoittaa IOP:n huiput ja notkahdukset potilaalla, joka käyttää Sensimed Triggerfish -laitteistoa 24 tunnin aikana.
Triggerfish on CE-merkinnällä hyväksytty Euroopassa. Yhdysvalloissa FDA:n hyväksyntää ei ole saavutettu, ja laite on edelleen kliinisissä tutkimuksissa.
|
Triggerfish seuraa IOP:tä eri tavalla Ulkoisen lukulaitteen näyttämät tiedot ovat yhdistelmä silmänsisäistä painetta, silmänsisäistä tilavuutta ja silmän biomekaanisia ominaisuuksia, selittää tohtori Mansouri. ”Se on hyödyllisempi antamaan käsityksen laadullisista muutoksista 24 tunnin aikana kuin määrällisistä muutoksista, koska emme voi kääntää niitä elohopeamillimetreiksi”, hän sanoo. Triggerfish antaa kuitenkin arvokasta tietoa. Tulevat tutkimukset, joissa käytetään laitetta, voisivat auttaa selittämään, kuinka epävakaa tai vakaa paine on ollut 24 tunnin aikana, milloin yölliset IOP-huiput esiintyvät, kuinka hoidon tai hoitomuutosten käyttöönotto vaikuttaa 24 tunnin IOP-kuvioihin ja kuinka tietyt toiminnot vaikuttavat 24 tunnin IOP-kuvioihin, kuten jooga-asennot, kofeiinin saanti, stressitilanteet ja muut edellä kuvatut IOP-piikkien syyt. Tohtori Mansouri teettää myös normaaleilla tai matalan verenpaineen glaukoomapotilailla samanaikaisen 24 tunnin verenpaineen ja 24 tunnin IOP:n seurannan, koska piikit voivat vaikuttaa OPP:hen. Mutta osoittaako Triggerfish korrelaatiota 24 tunnin IOP-mallien ja glaukooman etenemisen välillä? Tähän olennaiseen kysymykseen vastaamiseksi on meneillään useita tutkimuksia.
|
– Resonanssipiirin anturikontaktilinssi. Toinen kehitteillä oleva älykäs CLS-laite on ohutkalvokondensaattorista valmistettu resonanssipiiri, joka on yhdistetty sarveiskalvon kaarevuuden muodonmuutoksen havaitsevaan anturikelaan. Se on kehityksensä alkuvaiheessa, ja sitä kehittää David C.C. Lam Hongkongin tiede- ja teknologiayliopiston kone- ja avaruustekniikan laitoksella.
Syyskuussa 2014 tehdyssä tutkimuksessa CLS:ää testattiin silikonikumista valmistetulla silmämallilla. Anturin todettiin seuraavan tarkasti IOP:n vaihtelua.11
Kuten glukoosipitoisuuden mittaaminen kerran päivässä diabetesta sairastaville potilaille tai verenpaineen mittaaminen kerran päivässä sydänsairauspotilaille, luottamus yhteen IOP-mittaukseen voi johtaa virheellisiin IOP-tietoihin. Mutta ehkäpä jo lähitulevaisuudessa science fiction -elokuvasta tuttujen laitteiden – piilolinssien ja implantoitavien antureiden – avulla voit seurata silmänpaineen laskua ymmärrettävämmin ja vaivattomammin sinulle ja potilaillesi.
1. Liu JH1, Gokhale PA, Loving RT, Kripke DF, Weinreb RN. Päivittäisten ja yöllisten silmän perfuusiopaineiden laboratorioarviointi ihmisillä. J Ocul Pharmacol Ther. 2003 Aug;19(4):291-7.
2. Zeimer RC, Wilensky JT, Gieser DK, Viana MA. Silmänsisäisen paineen huippujen ja näkökenttäpuutoksen etenemisen välinen yhteys. Ophthalmology. 1991 Jan;98(1):64-69.
3. Konstas AG, Quaranta L, Mikropoulos DG, et al. Peak Intraocular Pressure and Glaucomatous Progression in Primary Open-Angle Glaucoma. J Ocul Pharmacol Ther. 2012 Feb;28(1):26-32.
4. Mansouri K, Weinreb RN, Medeiros FA. Onko 24 tunnin silmänpaineen seuranta välttämätöntä glaukoomassa? Semin Opththalmol. May 2013: 28(3):157-164.
5. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Kliininen hyöty silmänpaineen seurannasta normaalin virka-ajan ulkopuolella glaukoomapotilailla. Arch Ophthalmol. 2006 Jun;124(6):793-7.
6. Mosaed S, Liu H, Weinreb RN. Korrelaatio terveiden henkilöiden ja glaukoomapotilaiden yöllisten silmänsisäisten huippupaineiden välillä. Am J Ophthalmol. 2005; Feb;139(2):320-4.
7. Downs JC, Burgoyne CF, Seigfreid WP, et al. 24-hour IOP telemetry in the nonhuman primate: implant system performance and initial characterization of IOP at multiple timescales. Invest Ophthalmol Vis Sci. 2011 Sep 21;52(10):7365-75.
8. Association for Research in Vision and Ophthalmology: Emerging trends and hot topics. Esitetty maanantaina 5. toukokuuta 2014 ARVO:n vuosikokouksessa. Saatavilla osoitteessa: www.arvo.org/About_ARVO/Press_Room/Emerging_Trends_and_hot_topics__Presented_Monday,_May_5_at_the_ARVO_Annual_Meeting. Viitattu 19. marraskuuta 2014.
9. Melki S, Todani A, Cherfan G. Implantoitavan silmänsisäisen paineen muuntimen alustavat turvallisuustulokset. JAMA Ophthalmol. 2014 Oct 1;132(10):1221-5.
10. Mandel Y, Araci IE, Quake SR. Google Patents. Istutettava mikrofluidinen laite silmänsisäisen paineen seurantaan. Saatavilla osoitteessa: www.google.com/patents/WO2014137840A1?cl=en. Viitattu 17. lokakuuta 2014.
11. Chen GZ, Chan IS, Leung LK, Lam DC. Pehmeä puettava piilolinssianturi silmänsisäisen paineen jatkuvaan seurantaan. Med Eng Phys. 2014 Sep;36(9):1134-9.
12. Mottet B, Aptel F, Romanet JP, et al. 24 tunnin silmänpaineen rytmi nuorilla terveillä koehenkilöillä arvioituna jatkuvalla seurannalla piilolinssisensorin avulla. JAMA Ophthalmol. 2013 Dec;131(12):1507-16.
