Generaattinen nimi: lidokaiinihydrokloridi
annosmuoto: paikallinen hyytelö
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 1. lokakuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Professori
- Vuorovaikutukset
- Lisätiedot
Ainoastaan reseptilääke
- KUVAUS
- KLIININEN FARMAKOLOGIA
- HYVÄKSYNTÄVAIKUTUKSET JA NIIDEN KÄYTTÖAIHEET
- VALMISTELUOHJEET
- VAROITUKSET
- VAROITUKSET
- Käyttö raskauden aikana:
- Haittavaikutukset
- YLIANNOSTUS
- ANNOSTELU JA ANNOSTUS
- MAKSIMIANNOSTUS
- KUINKA ANNOSTETAAN
- Lisätietoa lidokaiinista paikallisesti
- Kuluttajalähteet
- Ammattilaislähteet
- Ammattilaislähteet
- Seuraavat hoito-oppaat
KUVAUS
Lidokaiinihydrokaiini HCI 2 %:n geeli on steriili, vesipitoinen valmiste, joka sisältää paikallispuudutusainetta ja jota annetaan paikallisesti. (Katso erityiset käyttötarkoitukset kohdasta Käyttöaiheet.)
Lidokaiini HCI 2 % hyytelö sisältää lidokaiini HCI:tä, joka on kemiallisesti nimeltään asetamidi, 2-(dietyyliamino)-N-(2,6-dimetyylifenyyli)-,monohydrokloridi ja jolla on seuraava rakennekaava:
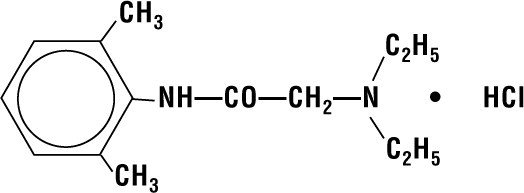
Molekyylikaavana on C14H22N2O – HCI ja molekyylipainona 270.80.
Lidokaiini HCI 2 % -hyytelö sisältää myös hypromelloosia, ja näin saatu seos maksimoi kosketuksen limakalvoon ja tarjoaa voitelun instrumentointia varten. Käyttämätön osa tulee hävittää ensimmäisen käytön jälkeen.
Lidokaiini HCI 2 % hyytelön koostumus 30 ml:n ja 5 ml:n putket: Jokainen ml sisältää 20 mg lidokaiini HCI:tä. Valmiste sisältää myös metyyliparabeenia, propyyliparabeenia, hypromelloosia ja natriumhydroksidia ja/tai suolahappoa pH:n säätämiseksi välillä 6,0-7,0.
KLIININEN FARMAKOLOGIA
Vaikutusmekanismi: Lidokaiini stabiloi hermokalvoa estämällä impulssien käynnistymiseen ja johtumiseen tarvittavia ionivirtoja, mikä saa aikaan paikallispuudutusvaikutuksen.
Vaikutuksen alkaminen: Vaikutuksen alkaminen on 3-5 minuuttia. Se on tehoton, kun sitä käytetään ehjään ihoon.
Hemodynamiikka: Liian suuret veripitoisuudet voivat aiheuttaa muutoksia sydämen minuuttitilavuudessa, perifeerisessä kokonaisvastuksessa ja keskimääräisessä valtimopaineessa. Nämä muutokset voivat johtua paikallispuudutusaineen suorasta depressiivisestä vaikutuksesta sydän- ja verenkiertoelimistön eri komponentteihin.
Farmakokinetiikka ja aineenvaihdunta: Lidokaiini voi imeytyä paikallisen annostelun jälkeen limakalvoille, ja sen imeytymisnopeus ja -laajuus riippuvat pitoisuudesta ja annetusta kokonaisannoksesta, erityisestä käyttöpaikasta ja altistuksen kestosta. Yleensä paikallispuudutteiden imeytymisnopeus paikallisen annostelun jälkeen on nopeimmillaan intratrakeaalisen annostelun jälkeen. Lidokaiini imeytyy hyvin myös ruoansulatuskanavasta, mutta verenkierrossa saattaa esiintyä vain vähän ehjää lääkettä maksassa tapahtuvan biotransformaation vuoksi.
Lidokaiini metaboloituu nopeasti maksassa, ja metaboliitit ja muuttumaton lääke erittyvät munuaisten kautta. Biotransformaatioon kuuluu oksidatiivinen N-dealkylaatio, rengashydroksylaatio, amidisidoksen pilkkoutuminen ja konjugaatio. N-dealkylaatio, joka on tärkein biotransformaatioreitti, tuottaa metaboliitteja monoetyyliglykiineksidiidiä ja glykiineksidiidiä. Näiden metaboliittien farmakologiset/toksikologiset vaikutukset ovat samankaltaisia kuin lidokaiinilla, mutta vähemmän voimakkaita kuin lidokaiinilla. Noin 90 % annetusta lidokaiinista erittyy eri metaboliitteina ja alle 10 % erittyy muuttumattomana. Ensisijainen metaboliitti virtsassa on 4-hydroksi-2, 6-dimetyylianiliinin konjugaatti.
Lidokaiinin sitoutuminen plasmaan on riippuvainen lääkeaineen pitoisuudesta, ja sitoutunut osuus pienenee pitoisuuden kasvaessa. Pitoisuuksissa 1-4 mcg vapaata emästä millilitraa kohti 60-80 prosenttia lidokaiinista sitoutuu proteiineihin. Sitoutuminen riippuu myös alfa-I-happoglykoproteiinin pitoisuudesta plasmassa.
Lidokaiini läpäisee veri-aivo- ja istukkaesteen oletettavasti passiivisen diffuusion avulla.
Tutkimukset lidokaiinin metaboliasta laskimonsisäisten bolusinjektioiden jälkeen ovat osoittaneet, että tämän lääkeaineen eliminaation puoliintumisaika on tyypillisesti 1,5-2,0 tuntia. Koska lidokaiini metaboloituu nopeasti, mikä tahansa maksan toimintaan vaikuttava tila voi muuttaa lidokaiinin kinetiikkaa. Puoliintumisaika voi pidentyä kaksi kertaa tai enemmän potilailla, joilla on maksan toimintahäiriö. Munuaisten toimintahäiriö ei vaikuta lidokaiinin kinetiikkaan, mutta saattaa lisätä metaboliittien kertymistä.
Tekijät, kuten asidoosi ja keskushermostoa stimuloivien ja masentavien lääkkeiden käyttö, vaikuttavat lidokaiinin keskushermostossa oleviin lidokaiinipitoisuuksiin, joita tarvitaan selvien systeemisten vaikutusten aikaansaamiseksi. Objektiiviset haittavaikutukset tulevat yhä ilmeisemmiksi, kun laskimoplasman pitoisuudet nousevat yli 6 mcg vapaata emästä millilitrassa. Rhesusapinoilla 18-21 mcg/ml:n valtimoveren pitoisuuksien on osoitettu olevan kynnysarvo kouristustoiminnalle.
HYVÄKSYNTÄVAIKUTUKSET JA NIIDEN KÄYTTÖAIHEET
Lidokaiini HCI 2 % hyytelö on tarkoitettu kivun ennaltaehkäisyyn ja kivun hallintaan toimenpiteissä, joihin liittyy miehen ja naisen virtsaputki, kivuliaan virtsaputken tulehduksen paikallishoitoon ja anestesia-ainelääkkeen voiteluaineeksi endotrakeaalisessa intubaatiossa (suun kautta ja nenään).
VALMISTELUOHJEET
Lidokaiini on vasta-aiheista potilaille, joilla on tiedossa yliherkkyyttä amidityyppisille paikallispuudutteille tai Lidocaine HCI 2 %:n hyytelössä oleville muille aineosille.
VAROITUKSET
KORKEA ANNOSTUS TAI LYHYET VÄLITYSJAKSOA ANNOSTELUJEN VÄLILLÄ VOIVAT SYNTYÄ KORKEISIIN PILASMASTAANIIN JA KOROSTUUI KOROSTETUIIN MAHDOLLISIIN MAHDOLLISIIN HAITTOIHIN. POTILAITA ON OHJEISTETTAVA NOUDATTAMAAN TIUKASTI TÄSSÄ PAKKAUSSELOSTEESSA ESITETTYJÄ SUOSITELTUJA ANNOSTUS- JA ANTO-OHJEITA. VAKAVIEN HAITTAVAIKUTUSTEN HOITO VOI VAATIA RESUSKITOIVIEN LAITTEIDEN, HAPEN JA MUIDEN RESUSKITOIVIEN LÄÄKKEIDEN KÄYTTÖÄ.
Lidokaiini HCI 2 % -hyytelöä on käytettävä äärimmäisen varovaisesti, jos käyttöalueella on verenmyrkytys tai vakavasti traumatisoitunut limakalvo, sillä tällaisissa olosuhteissa on olemassa mahdollisuus nopeaan systeemiseen imeytymiseen.
Käytettäessä endotrakeaaliputken voiteluun on huolehdittava siitä, ettei tuotetta pääse putken luumeniin. Älä käytä hyytelöä endotrakeaalisten stylettien voiteluun. Jos hyytelöä päästetään sisempään luumeniin, se voi kuivua sisäpinnalle jättäen jäännöksen, jolla on taipumus paakkuuntua taivutettaessa ja kaventaa luumenia. On ollut harvinaisia raportteja, joissa tämä jäämä on aiheuttanut luumenin tukkeutumisen. (Ks. myös kohta HAITTAVAIKUTUKSET ja ANNOSTUS JA ANNOSTUS.)
VAROITUKSET
Yleistä: Lidokaiinin turvallisuus ja teho riippuvat oikeasta annostuksesta, oikeasta tekniikasta, riittävistä varotoimista ja valmiudesta hätätilanteisiin. (Katso VAROITUKSET ja HAITTAVAIKUTUKSET.) Korkeiden plasmapitoisuuksien ja vakavien haittavaikutusten välttämiseksi on käytettävä pienintä annosta, jolla saadaan aikaan tehokas anestesia. Toistuvat lidokaiiniannokset voivat aiheuttaa merkittävää veren pitoisuuksien nousua jokaisen toistuvan annoksen yhteydessä lääkkeen tai sen metaboliittien hitaan kertymisen vuoksi. Kohonneiden veripitoisuuksien sietokyky vaihtelee potilaan tilan mukaan. Heikentyneille, iäkkäille potilaille, akuutisti sairaille potilaille ja lapsille on annettava pienempiä annoksia, jotka vastaavat heidän ikäänsä ja fyysistä tilaansa. Lidokaiinia tulee käyttää varoen myös potilailla, joilla on vaikea sokki tai sydämen salpaantuminen.
Lidokaiini HCI 2 % hyytelöä tulee käyttää varoen potilailla, joilla on tunnettuja lääkeaineyliherkkyyksiä. Paraaminobentsoehappojohdannaisille (prokaiini, tetrakaiini, bentsokaiini jne.) allergiset potilaat eivät ole osoittaneet ristiyliherkkyyttä lidokaiinille.
Monia anestesian aikana käytettäviä lääkeaineita pidetään potentiaalisina familiaalisen malignin hypertermian laukaisevina aineina. Koska ei tiedetä, voivatko amidityyppiset paikallispuudutteet laukaista tämän reaktion, ja koska täydentävän yleisanestesian tarvetta ei voida ennustaa etukäteen, ehdotetaan, että hoitoa varten olisi oltava käytettävissä vakiomuotoinen protokolla. Varhaiset selittämättömät takykardian, takypnean, epävakaan verenpaineen ja metabolisen asidoosin oireet voivat edeltää lämpötilan nousua. Onnistunut lopputulos riippuu varhaisesta diagnoosista, epäillyn laukaisevan aineen (laukaisevien aineiden) nopeasta lopettamisesta ja hoidon aloittamisesta, mukaan lukien happihoito, ilmoitetut tukitoimenpiteet ja dantroleeni (tutustu dantroleeninatriumin laskimonsisäisen annostelun pakkausselosteeseen ennen käyttöä).
Tietoa potilaille: Kun paikallispuudutteita käytetään suussa, potilaan on oltava tietoinen siitä, että paikallispuudutteen tuottaminen voi heikentää nielemistä ja siten lisätä aspiraatiovaaraa. Tästä syystä ruokaa ei saa nauttia 60 minuuttiin sen jälkeen, kun paikallispuudutusvalmisteita on käytetty suun tai nielun alueella. Tämä on erityisen tärkeää lapsilla, koska he syövät usein.
Kielen tai poskiontelon limakalvon mykkyys voi lisätä tahattoman puremavamman vaaraa. Ruokaa tai purukumia ei saa nauttia suun tai nielun alueen ollessa puudutettuna.
Karsinogeneesi – Lidokaiinin karsinogeenisen potentiaalin arvioimiseksi ei ole tehty pitkäaikaistutkimuksia eläimillä.
Mutageenisuus – Lidokaiinin mutageeninen potentiaali on testattu Amesin Salmonellan käänteismutaatiomäärityksessä ja in vitro kromosomipoikkeavuuksien määrityksessä ihmisen lymfosyyteissä sekä in vivo hiiren mikronukleusmäärityksessä. Näissä tutkimuksissa ei ollut viitteitä mutageenisesta vaikutuksesta.
hedelmällisyyden heikentyminen – Lidokaiinin vaikutusta hedelmällisyyteen tutkittiin rotan mallissa. 30 mg/kg s.c. (180 mg/m2) antaminen paritteluparille ei aiheuttanut muutoksia rottien hedelmällisyydessä tai yleisessä lisääntymiskyvyssä. Ei ole tutkimuksia, joissa olisi tutkittu lidokaiinin vaikutusta siittiöparametreihin. Hedelmällisyyden muuttumisesta ei ollut näyttöä.
Käyttö raskauden aikana:
Teratogeeniset vaikutukset: Raskauskategoria B.
Reproduktiotutkimuksia lidokaiinille on tehty sekä rotilla että kaneilla. Rotta-mallissa ei ollut näyttöä sikiölle aiheutuneista haitoista ihonalaisilla annoksilla, jotka olivat enintään 50 mg/kg lidokaiinia (300 mg/m2 kehon pinta-alaan suhteutettuna). Kaniinimallissa ei ollut näyttöä sikiölle aiheutuneesta haitasta annoksella 5 mg/kg s.c. (60 mg/m2 kehon pinta-alaa kohti). Kaniinien hoito annoksella 25 mg/kg (300 mg/m2 ) tuotti näyttöä äidin myrkyllisyydestä ja viiveestä sikiön kehityksessä, mukaan lukien sikiön painon ei-merkitsevä lasku (7 %) ja pienten luuston poikkeavuuksien lisääntyminen (kallo- ja sternebraldefekti, vähentynyt falangien luutuminen). Lidokaiinin vaikutusta syntymän jälkeiseen kehitykseen tutkittiin rotilla antamalla tiineille naarasrotille päivittäin ihon alle annoksia 2, 10 ja 50 mg/kg (12, 60 ja 300 mg/m2 ) 15. tiineyspäivästä alkaen ja 20 päivää synnytyksen jälkeen. Emoilla tai pennuilla ei havaittu merkkejä haitallisista vaikutuksista aina annokseen 10 mg/kg (60 mg/m2) asti; eloonjääneiden pentujen määrä kuitenkin väheni annoksella 50 mg/kg (300 mg/m2) sekä syntymän että imetyskauden aikana, ja vaikutus oli todennäköisesti toissijainen emon myrkyllisyydestä. Tässä tutkimuksessa ei havaittu muita vaikutuksia pentuekokoon, pentueen painoon, pentujen poikkeavuuksiin ja pentujen fyysiseen kehitykseen.
Toisessa tutkimuksessa tutkittiin lidokaiinin vaikutuksia rotan syntymän jälkeiseen kehitykseen, johon sisältyi pentujen arviointi vieroituksesta sukukypsyyteen. Rotille annettiin 8 kuukauden ajan 10 tai 30 mg/kg lidokaiinia s.c. (60 mg/m2 ja 180 mg/m2 kehon pinta-alaa kohti). Tämä ajanjakso kattoi 3 astutuskautta. Missään jälkeläisissä ei ollut viitteitä muuttuneesta syntymän jälkeisestä kehityksestä; molemmat lidokaiiniannokset kuitenkin vähensivät merkittävästi niiden pentuekohtaisten pentujen keskimääräistä lukumäärää, jotka jäivät eloon kahden ensimmäisen astutuskauden jälkeläisten vieroitukseen asti.
Riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla ei kuitenkaan ole. Koska eläimillä tehdyt lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulisi käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Synnytys: Lidokaiini ei ole vasta-aiheinen synnytyksessä. Jos Lidocaine HCl 2 % Jelly -valmistetta käytetään samanaikaisesti muiden lidokaiinia sisältävien valmisteiden kanssa, kaikkien valmisteiden aiheuttama kokonaisannos on pidettävä mielessä.
Imettävät äidit: Lidokaiini erittyy ihmismaitoon. Tämän havainnon kliinistä merkitystä ei tunneta. Varovaisuutta on noudatettava, kun lidokaiinia annetaan imettävälle naiselle.
Lasten käyttö: Vaikka lidokaiinin 2 %:n hyytelön turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu, 19:llä ennenaikaisella vastasyntyneellä (raskausikä <33 viikkoa) tehdyssä tutkimuksessa ei havaittu korrelaatiota lidokaiinin tai monoetyyliglykiineksidiidin plasmapitoisuuden ja lapsen ruumiinpainon välillä, kun kohtuullisia määriä lidokaiinia (eli 0,3 ml/kg lidokaiinigeeliä 20 mg/ml) käytettiin sekä intranasaalisten että endotrakeaalisten letkujen voiteluun. Yhdenkään vastasyntyneen lidokaiinipitoisuus plasmassa ei ollut yli 750 mcg/l. Lasten annoksia on pienennettävä iän, ruumiinpainon ja fyysisen kunnon mukaan. (Ks. kohta ANNOSTUS JA ANNOSTELU.)
Haittavaikutukset
Lidokaiinin antamisen jälkeiset haittakokemukset ovat luonteeltaan samankaltaisia kuin ne, joita on havaittu muiden amidisten paikallispuudutusaineiden yhteydessä. Nämä haittavaikutukset liittyvät yleensä annokseen ja voivat johtua liian suuren annoksen tai nopean imeytymisen aiheuttamista korkeista plasmapitoisuuksista tai ne voivat johtua potilaan yliherkkyydestä, idiosynkrasiasta tai heikentyneestä sietokyvystä. Vakavat haittavaikutukset ovat yleensä luonteeltaan systeemisiä. Seuraavat tyypit ovat yleisimmin raportoituja:
Harvinaisia raportteja on ollut endotrakeaaliputken tukkeutumisesta, joka on liittynyt kuivuneen hyytelöjäännöksen esiintymiseen putken sisäisessä luumenissa. (Katso myös Varoitukset ja ANNOSTUS JA ANNOSTUS.)
Keskushermosto: Keskushermoston ilmenemismuodot ovat kiihottavia ja/tai masentavia, ja niille voi olla ominaista huimaus, hermostuneisuus, huolestuneisuus, euforia, sekavuus, huimaus, uneliaisuus, tinnitus, näön hämärtyminen tai kaksoiskuvat, oksentelu, lämpö-, kylmyys- tai puutumisen tuntemukset, nykiminen, vapina, kouristukset, tajuttomuus, hengityslama ja pysähtyminen. Heräteilmiöt voivat olla hyvin lyhyitä tai niitä ei esiinny lainkaan, jolloin toksisuuden ensimmäinen ilmenemismuoto voi olla uneliaisuus, joka sulautuu tajuttomuuteen ja hengityksen pysähtymiseen.
Lidokaiinin antamisen jälkeinen uneliaisuus on tavallisesti varhainen merkki lääkkeen korkeasta pitoisuudesta veressä, ja se voi ilmetä nopean imeytymisen seurauksena.
Kardiovaskulaarinen järjestelmä: Sydän- ja verenkiertoelimistön ilmenemismuodot ovat yleensä depressiivisiä, ja niille on ominaista bradykardia, hypotensio ja kardiovaskulaarinen kollapsi, joka voi johtaa sydänpysähdykseen.
Allergiat: Allergisille reaktioille ovat tyypillisiä ihovauriot, nokkosihottuma, turvotus tai anafylaktoidiset reaktiot. Allergisia reaktioita voi esiintyä herkkyyden seurauksena joko paikallispuudutusaineelle tai valmisteen muille aineosille. Lidokaiiniyliherkkyydestä johtuvat allergiset reaktiot ovat erittäin harvinaisia, ja jos niitä ilmenee, ne on hoidettava tavanomaisin keinoin. Herkkyyden toteaminen ihotesteillä on arvoltaan kyseenalaista.
YLIANNOSTUS
Paikallispuudutteiden aiheuttamat akuutit hätätilanteet liittyvät yleensä korkeisiin plasmapitoisuuksiin, joita esiintyy paikallispuudutteiden terapeuttisen käytön aikana. (Katso HAITTAVAIKUTUKSET, VAROITUKSET ja VAROTOIMET.)
Lokaalipuudutushätätilanteiden hoito: Ensimmäinen näkökohta on ennaltaehkäisy, joka onnistuu parhaiten seuraamalla huolellisesti ja jatkuvasti sydän- ja verenkiertoelimistön ja hengityksen elintoimintoja sekä potilaan tajunnantilaa jokaisen paikallispuudutteen annon jälkeen. Happea on annettava heti ensimmäisten muutosten ilmaantuessa.
Kouristuskohtausten hoidon ensimmäinen vaihe koostuu välittömästä huomion kiinnittämisestä vapaiden hengitysteiden ylläpitämiseen ja avustettuun tai kontrolloituun ventilaatioon hapella ja syöttöjärjestelmällä, joka mahdollistaa välittömän positiivisen hengitystiepaineen antamisen maskin avulla. Välittömästi näiden hengitystoimien aloittamisen jälkeen on arvioitava verenkierron riittävyys ja pidettävä mielessä, että kouristusten hoitoon käytettävät lääkkeet voivat joskus heikentää verenkiertoa, kun niitä annetaan suonensisäisesti. Jos kouristukset jatkuvat riittävästä hengitystuesta huolimatta ja jos verenkierron tila sallii, voidaan suonensisäisesti antaa pieniä annoksia erittäin lyhytvaikutteista barbituraattia (kuten tiopentaalia tai tiamylaalia) tai bentsodiatsepiinia (kuten diatsepaamia). Kliinikon tulisi tuntea nämä kouristuksia ehkäisevät lääkkeet ennen paikallispuudutteiden käyttöä. Verenkiertohäiriön tukihoito voi edellyttää suonensisäisen nesteen antamista ja tarvittaessa vasopressoria kliinisen tilanteen mukaan (esim. efedriiniä).
Jos sitä ei hoideta välittömästi, sekä kouristukset että verenkiertohäiriö voivat johtaa hypoksiaan, asidoosiin, bradykardiaan, rytmihäiriöihin ja sydämen pysähtymiseen. Jos sydänpysähdys tapahtuu, on aloitettava tavanomaiset kardiopulmonaaliset elvytystoimenpiteet.
Dialyysillä ei ole merkittävää arvoa lidokaiinin akuutin yliannostuksen hoidossa.
Lidokaiini HCI:n suun kautta saatava LD50-arvo ei-paastoavilla naarasrotilla on 459 (346-773) mg/kg (suolana) ja paastoavilla naarasrotilla 214 (159-324) mg/kg (suolana).
ANNOSTELU JA ANNOSTUS
Kun lidokaiini HCI 2 % hyytelöä käytetään samanaikaisesti muiden lidokaiinia sisältävien valmisteiden kanssa, kaikkien valmisteiden aiheuttama kokonaisannos on pidettävä mielessä.
Annostus vaihtelee ja riippuu puudutettavasta alueesta, kudosten verisuonisuudesta, yksilöllisestä sietokyvystä ja anestesiatekniikasta. On annettava pienin annos, joka tarvitaan tehokkaan anestesian aikaansaamiseksi. Annoksia on pienennettävä lapsille sekä iäkkäille ja heikentyneille potilaille. Vaikka haittavaikutusten esiintyvyys Lidokaiini HCI 2 %:n hyytelöllä on melko alhainen, on noudatettava varovaisuutta erityisesti suuria määriä käytettäessä, koska haittavaikutusten esiintyvyys on suoraan verrannollinen annettavan paikallispuudutusaineen kokonaisannokseen.
Aikuisen miehen aikuisen virtsaputken pintapuudutukseen: Kun käytät Lidocaine 2 % Jelly 30 ml:n putkia, steriloi muovikartio 5 minuutin ajan kiehuvassa vedessä, jäähdytä ja kiinnitä putkeen. Kartio voidaan steriloida kaasu- tai kylmästeriloida halutulla tavalla. Tiputa hitaasti noin 15 ml (300 mg lidokaiini HCI:tä) virtsaputkeen tai kunnes potilas tuntee jännitystä. Tämän jälkeen käytetään penispuristinta useiden minuuttien ajan koronan kohdalla. Enintään 15 ml:n (300 mg) lisäannos voidaan tiputtaa riittävää anestesiaa varten.
Ennen luotausta tai kystoskopiaa penispuristinta on käytettävä 5-10 minuuttia riittävän anestesian saamiseksi. Miehen virtsaputken täyttämiseen ja laajentamiseen tarvitaan yleensä 30 ml:n (600 mg) kokonaisannos.
Ennen katetrointia pienemmät, 5-10 ml:n (100-200 mg) tilavuudet riittävät yleensä voiteluun.
Naisten aikuisten aikuisten virtsaputken pintaanestesiaa varten: Kun käytät Lidocaine 2 % Jelly 30 ml:n putkia, steriloi muovikartio 5 minuutin ajan kiehuvassa vedessä, jäähdytä ja kiinnitä putkeen. Kartio voidaan steriloida kaasu- tai kylmästeriloida halutulla tavalla. Tiputa hitaasti 3-5 ml (60-100 mg lidokaiini HCI:tä) hyytelöä virtsaputkeen. Haluttaessa osa hyytelöstä voidaan levittää pumpulipuikolle ja viedä virtsaputkeen. Riittävän anestesian saamiseksi on annettava useita minuutteja aikaa ennen urologisten toimenpiteiden suorittamista.
Lubrikointi endotrakeaalista intubaatiota varten: Levitä kohtalainen määrä hyytelöä endotrakeaaliputken ulkopinnalle juuri ennen käyttöä. On huolehdittava siitä, ettei tuotetta pääse putken luumeniin. Älä käytä hyytelöä endotrakeaalisten stylettien voiteluun. Katso VAROITUKSET ja HAITTAVAIKUTUKSET koskien harvinaisia raportteja sisemmän luumenin tukkeutumisesta. On myös suositeltavaa välttää sellaisten endotrakeaaliputkien käyttöä, joiden ulkopinnalla on kuivunutta hyytelöä, koska sillä ei ole voiteluvaikutusta.
MAKSIMIANNOSTUS
Lisäannoksia ei saa antaa yli 600 mg lidokaiini HCI:tä 12 tunnin aikana.
Lapset: On vaikea suositella minkään lääkkeen enimmäisannosta lapsille, koska se vaihtelee iän ja painon mukaan. Alle kymmenvuotiaille lapsille, joilla on normaali vähärasvainen ruumiinpaino ja normaali vähärasvaisen kehon kehitys, enimmäisannos voidaan määrittää soveltamalla jotakin tavallisista pediatristen lääkkeiden kaavoista (esim. Clarkin sääntö). Esimerkiksi viisivuotiaalle lapselle, joka painaa 50 kiloa, lidokaiinihydrokloridiannos ei saisi ylittää 75-100 mg:aa laskettuna Clarkin säännön mukaan. Joka tapauksessa annettavan lidokaiini-HCI:n enimmäismäärä ei saisi ylittää 4,5 mg/kg (2 mg/lb) ruumiinpainoa.
KUINKA ANNOSTETAAN
Lidokaiini-HCI 2 % hyytelöä toimitetaan luetelluissa annosmuodoissa.
NDC 17478-840-30 30 ml:n alumiinituubi
NDC 17478-840-05 5 ml:n alumiinituubi
30 ml:n kartonkipakkauksessa on irrotettava applikaattorikartio ja avain sisällön ilmaisemiseen.
Varastointi: Säilytä 20°-25°C (68°-77°F) .
PREMIERProRx®
Valmistaja:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® on Premier Inc:n rekisteröity tavaramerkki, jota käytetään lisenssin nojalla.
PLD00N Rev. 10/15
Purkin etiketin näyttöpaneelin teksti:
NDC 17478-840-05 Premier-logo
Lidokaiinihydrokloridihyytelö USP, 2 %
Vain reseptilääke
Steriili 5 ml

Kotelon etiketin näyttöpaneelin teksti:
NDC 17478-840-05 Steriili 5 ml
Lidokaiinihydrokloridihyytelö USP, 2 %
Vain Rx
Premier-logo

| LIDOKAINE lidokaiinihydrokloridihyytelö |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Merkintä – Akorn, Inc. (117696770)
Rekisteröijä – Akorn Inc. Akorn Operating Company LLC (117693100)
| Toimipaikka | |||
| Nimi | Asoite | ID/FEI | Toimipaikka |
| Akorn, Inc | 117696840 | VALMISTUS(17478-840), ANALYSOINTI(17478-840), STERILOINTI(17478-840), PAKKAAMINEN(17478-840), MERKITSEMINEN(17478-840) | |
Lisätietoa lidokaiinista paikallisesti
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Ainetiedot annostuksesta
- Lääkkeiden yhteisvaikutukset
- Vertaile vaihtoehtoja
- Hinnoittelu & Kuponkeja
- En Español
- 208 Arvostelua
- Lääkeryhmä:
Kuluttajalähteet
- Potilastiedot
- Lidokaiinin ajankohtainen käyttö (Edistynyt lukeminen)
Ammattilaislähteet
- Potilastiedot
- Lidokaiinin ajankohtainen käyttö (Edistynyt lukeminen)
Ammattilaislähteet
- Reseptitiedot
- Lidokaiini (paikallisesti) (Ammattilaisneuvonta)
- Lidokaiinivoide (FDA)
- Lidokaiinigeeli (FDA)
- Lidokaiinilääke (FDA)
- Lidokaiinilääke (FDA)
- … +9 lisää
Muut merkit Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 lisää
Seuraavat hoito-oppaat
- Anaalinen kutina
- Ruokatorven kirurgia
- Anestesia
- Palovammat, ulkoiset
- … +9 lisää
Lääketieteellinen vastuuvapauslauseke
