 |
|
Happo/emäs-reaktiot ovat yleisiä. Vesiliuoksissa hapot lisäävät vetyionien (H+) pitoisuutta. Toisaalta emäkset lisäävät hydroksidi-ionin (OH-) pitoisuutta. Kun happo ja emäs reagoivat vesiliuoksessa, H+- ja OH-ionit yhdistyvät muodostaen vettä. Nämä ionit siis ”neutraloivat” toisensa:
Useimmilla hapoilla on yleinen kaava HA, jossa A- on anioni ja useimmilla emäksillä on muoto BOH, jossa B+ on sopiva kationi. Hapot ja emäkset voidaan ryhmitellä kahteen yleiseen tyyppiin: vahvat ja heikot hapot ja emäkset. Ero näiden kahden välillä on yksinkertainen: vahva happo hajoaa vesiliuoksessa 100-prosenttisesti protoniksi (H+) ja anioniksi (A-)
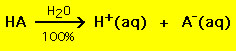
Toisaalta useimmat heikot hapot hajoavat vesiliuoksessa huomattavasti alle 100-prosenttisesti:
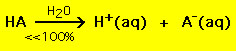 .
.Muiden sanoin useimmat heikot happomolekyylit pysyvät koskemattomina vedessä. Samanlaiset kemialliset yhtälöt pätevät vahvoille ja heikoille emäksille.
Heikkoja happoja ja emäksiä on vain muutamia, ne ovat:
| |
|
|
HCl (suolahappo) HNO3 (typpihappo) HClO4 (perkloorihappo) H2SO4 (rikkihappo) |
NaOH (natriumhydroksidi) KOH (kaliumhydroksidi) Ca(OH)2 (kalsiumhydroksidi) |
Kaikki muut hapot ja emäkset ovat heikkoja. Heikko happo syntyy mistä tahansa anionista. Alla on esimerkkejä
| |
|
|
F- (fluoridi) Br- (bromidi) I- (jodidi) HCO3- (bikarbonaatti) C2H3O2- (asetaatti) MnO4- (permanganaatti) PO4-3 (fosfaatti) CrO4-2 (kromaatti) CN- (syanidi) NO2- (nitriitti) SO3-…2 (sulfiitti) |
HF (fluorivetyhappo) HBr (bromivetyhappo) HI (jodivetyhappo) H2CO3 (hiilihappo) HC2H3O2 (etikkahappo) HMnO4 (permangaanihappo) H3PO4 (fosforihappo) H3PO4 (fosforihappo) H3PO4 (fosforihappo) happo) H2CrO4 (kromihappo) HCN (syaanivetyhappo) HNO2 (typpihappo) H2SO3 (rikkihappo) |
Tyypillisessä happo/emäs -reaktiossa happo ja emäs reagoivat keskenään muodostaen suolan ja vettä e.g., syaanivetyhappo ja natriumhydroksidi:
