15.4 Karboksyylihappojen fysikaaliset ominaisuudet
Oppimistavoitteet
- Vertaile karboksyylihappojen kiehumispisteitä samankaltaisen moolimassan omaavien alkoholien kanssa.
- Vertailla karboksyylihappojen liukoisuuksia veteen vastaavien alkaanien ja alkoholien liukoisuuksiin veteen.
Monet karboksyylihapot ovat värittömiä nesteitä, joilla on epämiellyttävä haju. Karboksyylihapoilla, joissa on 5-10 hiiliatomia, on kaikilla ”vuohen” haju (mikä selittää Limburger-juuston hajun). Näitä happoja syntyy myös ihon bakteerien vaikutuksesta ihmisen taliin (ihoöljyihin), mikä selittää huonosti tuuletettujen pukuhuoneiden hajun. Hapot, joissa on yli 10 hiiliatomia, ovat vahamaisia kiinteitä aineita, ja niiden haju vähenee moolin massan kasvaessa, jolloin haihtuvuus vähenee.
Karboksyylihapoilla on vahva vetysidos molekyylien välillä. Siksi niiden kiehumispisteet ovat korkeat verrattuna muihin vastaavan moolimassan omaaviin aineisiin.
Karboksyyliryhmä sitoutuu helposti vetysidokseen vesimolekyylien kanssa (Kuva 15.3 ”Etikkahappomolekyylin ja vesimolekyylin välinen vetysidos”). Hapot, joissa on yhdestä neljään hiiliatomia, ovat täysin sekoittuvia veden kanssa. Liukoisuus vähenee hiiliketjun pituuden kasvaessa, koska dipolivoimien merkitys vähenee ja dispersiovoimien merkitys korostuu. Heksaanihappo liukenee tuskin veteen (noin 1,0 g/100 g vettä). Palmitiinihappo, jossa on suuri pooliton hiilivetykomponentti, on olennaisesti liukenematon veteen. Karboksyylihapot liukenevat yleensä sellaisiin orgaanisiin liuottimiin kuin etanoli, tolueeni ja dietyylieetteri.
Kuva 15.3 Etikkahappomolekyylin ja vesimolekyylin välinen vetysidos
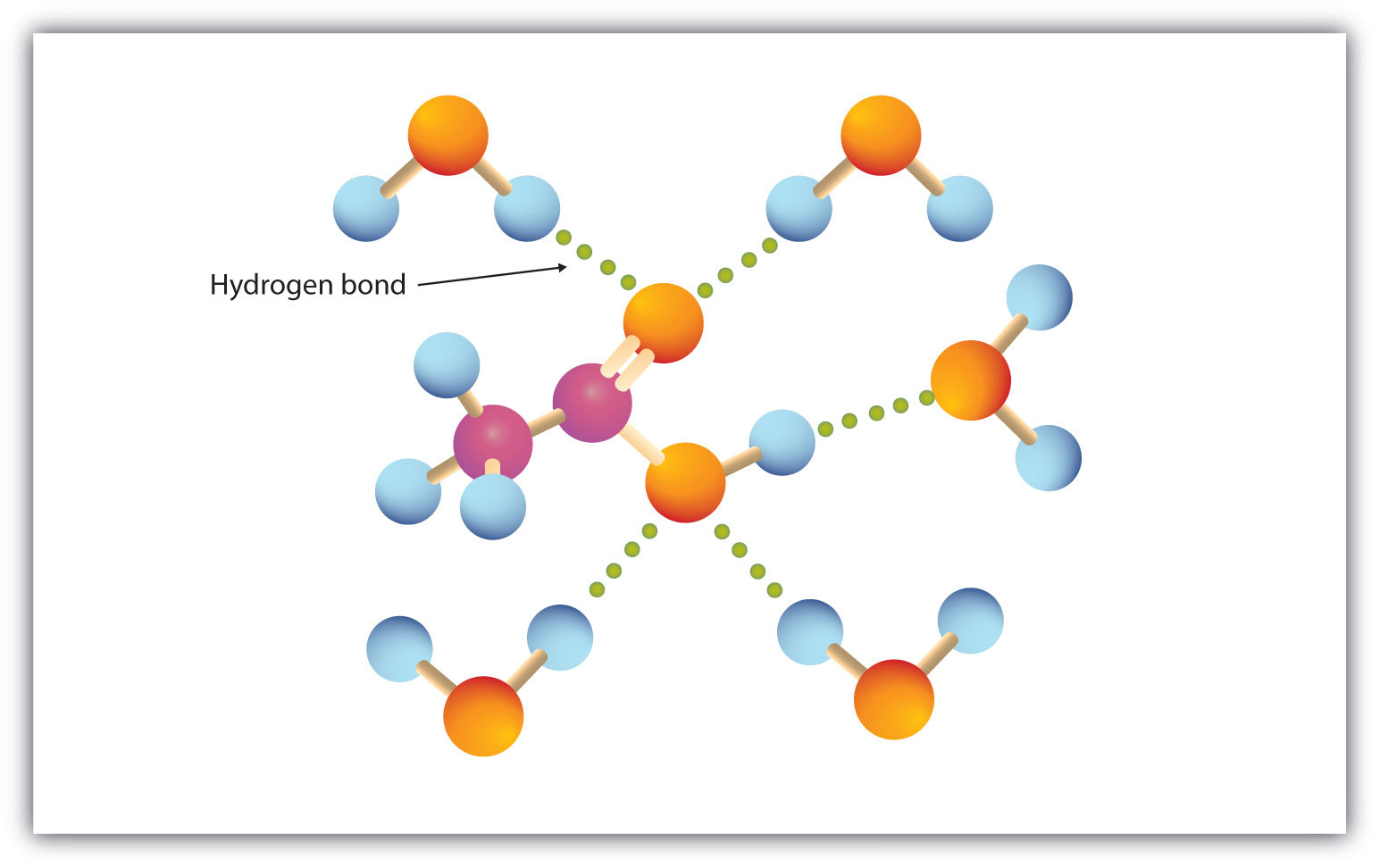
Karboksyylihapot, joiden moolimassa on pieni, liukenevat melko hyvin veteen.
Taulukossa 15.2 ”Karboksyylihappojen fysikaaliset vakiot” on lueteltu eräitä fysikaalisia ominaisuuksia tietyille karboksyylihapoille. Ensimmäiset kuusi ovat homologeja. Huomaa, että kiehumispisteet kasvavat moolimassan kasvaessa, mutta sulamispisteissä ei ole säännönmukaista kaavaa.
Taulukko 15.2 Karboksyylihappojen fysikaaliset vakiot
| Yhdistynyt rakennekaava | Hapon nimi | Sulamispiste (°C) | Kiehumispiste (°C) | Liukoisuus (g/100 g vettä) |
|---|---|---|---|---|
| HCOOH | muurahaishappo | 8 | 100 | sekoitettavissa |
| CH3COOH | etikkahappo | 17 | 118 | sekoitettavissa |
| CH3CH2COOH | propionihappo | -22 | 141 | sekoitettavissa |
| CH3(CH2)2COOH | voihappo | -5 | 163 | sekoitettavissa |
| CH3(CH2)3COOH | valeriinihappo | -35 | 187 | 5 |
| CH3(CH2)4COOH | kapronihappo | -3 | 205 | 1.1 |
| C6H5COOH | bentsoehappo | 122 | 249 | 0.29 |
Konseptin kertausharjoitukset
-
Kummalla yhdisteellä on korkeampi kiehumispiste – butaanihapolla (moolimassa 88) vai 2-pentanolilla (moolimassa 86)? Selitä.
-
Voisitko olettaa, että voihappo (butaanihappo) liukenee veteen enemmän vai vähemmän kuin 1-butanoli? Selitä.
Vastaukset
-
butaanihappo vetysidoksen vuoksi (2-pentanonissa ei ole molekyylien välistä vetysidosta.)
-
liukoisempi, koska siellä on laajempi vetysidos
Keskeiset johtopäätökset
- Karboksyylihapoilla on korkeita kiehumispisteitä verrattuna muihin aineisiin, joilla on vertailukelpoinen moolimassa. Kiehumispisteet kasvavat moolimassan myötä.
- Karboksyylihapot, joissa on yhdestä neljään hiiliatomia, ovat täysin sekoittuvia veden kanssa. Liukoisuus vähenee moolimassan myötä.
Harjoituksia
-
Kummalla yhdisteellä on korkeampi kiehumispiste-CH3CH2CH2OCH2CH3 vai CH3CH2CH2COOH? Selitä.
-
Kummalla yhdisteellä on korkeampi kiehumispiste-CH3CH2CH2CH2CH2CH2OH vai CH3CH2CH2COOH? Selitä.
-
Kumpi yhdiste liukenee paremmin veteen-CH3COOH vai CH3CH2CH2CH3? Selitä.
-
Kumpi yhdiste liukenee paremmin veteen-CH3CH2COOH vai CH3CH2CH2CH2CH2COOH? Selitä.
Vastaukset
-
CH3CH2CH2COOH vetysidoksen vuoksi (CH3CH2CH2OCH2CH3:n kanssa ei ole molekyylien välistä vetysidosta.)
-
CH3COOH, koska se sitoutuu vetysidokseen veden kanssa (CH3CH2CH2CH2CH3:n kanssa ei ole molekyylien välistä vetysidosta.)
