Learning Outcomes
- Määrittele oktettisääntö ja sen merkitys kemiallisessa sidoksessa
Kaikkeilla alkuaineilla ei ole tarpeeksi elektroneja täyttääkseen uloimmat kuorensa, mutta atomi on stabiileimmillaan silloin, kun kaikki uloimmalla kuorella olevat elektronipaikat ovat täynnä. Näiden uloimpien kuorien vapaiden paikkojen vuoksi muodostuu kemiallisia sidoksia eli kahden tai useamman saman tai eri alkuaineen välisiä vuorovaikutuksia, jotka johtavat molekyylien muodostumiseen. Saavuttaakseen suuremman vakauden atomit pyrkivät täyttämään uloimmat kuorensa kokonaan ja sitoutuvat muiden alkuaineiden kanssa tämän tavoitteen saavuttamiseksi jakamalla elektroneja, ottamalla vastaan elektroneja toiselta atomilta tai luovuttamalla elektroneja toiselle atomille. Koska matalan järjestysluvun omaavien alkuaineiden (aina kalsiumiin asti, jonka järjestysluku on 20) uloimmille kuorille mahtuu kahdeksan elektronia, tätä kutsutaan oktettisäännöksi. Alkuaine voi luovuttaa, ottaa vastaan tai jakaa elektroneja muiden alkuaineiden kanssa täyttääkseen uloimman kuorensa ja täyttääkseen oktettisäännön.
Tanskalainen tiedemies Niels Bohr (1885-1962) kehitti vuonna 1913 varhaisen atomimallin. Bohrin mallissa atomi näyttäytyy keskeisenä ytimenä, joka sisältää protonit ja neutronit, ja elektronit ovat ympyränmuotoisissa elektronikuorissa tietyillä etäisyyksillä ytimestä, samankaltaisesti kuin planeetat kiertävät aurinkoa. Jokaisella elektronikuorella on oma energiatasonsa, ja lähimpänä ydintä olevilla kuorilla on pienempi energia kuin kauempana ytimestä olevilla kuorilla. Konvention mukaan kullekin kuorelle annetaan numero ja symboli n – esimerkiksi lähimpänä ydintä olevaa elektronikuorta kutsutaan nimellä 1n. Voidakseen siirtyä kuorien välillä elektronin on absorboitava tai vapautettava energiamäärä, joka vastaa täsmälleen kuorien välistä energiaeroa. Jos elektroni esimerkiksi absorboi energiaa fotonista, se voi kiihtyä ja siirtyä korkeamman energian kuoreen; päinvastoin, kun kiihtynyt elektroni laskeutuu takaisin alemman energian kuoreen, se vapauttaa energiaa, usein lämmön muodossa.
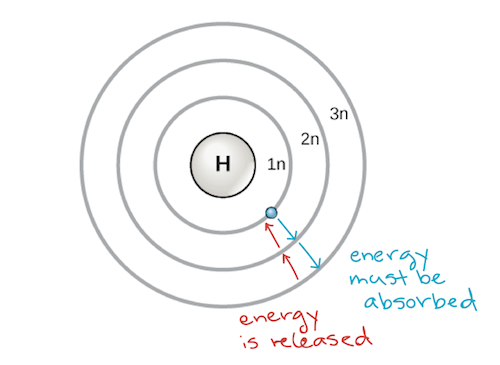
Bohrin atomimalli, jossa energiatasot näkyvät ydintä ympäröivinä konsentrisinä ympyröinä. Energiaa on lisättävä, jotta elektroni siirtyy ulospäin korkeammalle energiatasolle, ja energiaa vapautuu, kun elektroni putoaa alaspäin korkeammalta energiatasolta lähempänä olevalle energiatasolle. Image credit: modified from OpenStax Biology
Atomeilla, kuten muillakin fysiikan lakien säätelemillä asioilla, on taipumus ottaa mahdollisimman matalaenerginen ja stabiili rakenne. Näin ollen atomin elektronikuoret täyttyvät sisältä ulospäin siten, että elektronit täyttävät matalaenergiset kuoret lähempänä ydintä ennen kuin ne siirtyvät kauempana oleviin korkea-energisiin kuoriin. Lähimpänä ydintä olevaan kuoreen, 1n, mahtuu kaksi elektronia, kun taas seuraavaan kuoreen, 2n, mahtuu kahdeksan elektronia ja kolmanteen kuoreen, 3n, jopa kahdeksantoista elektronia.
Aatomin uloimman kuoren elektronien määrä määrää sen reaktiivisuuden eli taipumuksen muodostaa kemiallisia sidoksia muiden atomien kanssa. Tätä ulointa kuorta kutsutaan valenssikuoreksi, ja siinä olevia elektroneja kutsutaan valenssielektroneiksi. Yleisesti ottaen atomit ovat vakaimpia ja vähiten reaktiivisia, kun niiden uloin elektronikuori on täynnä. Useimmat biologian kannalta tärkeät alkuaineet tarvitsevat kahdeksan elektronia uloimmassa kuoressaan ollakseen stabiileja, ja tätä nyrkkisääntöä kutsutaan oktettisäännöksi. Jotkut atomit voivat olla stabiileja oktettikuorella, vaikka niiden valenssikuori on 3n-kuori, johon mahtuu jopa 18 elektronia. Tutkimme syyn tähän, kun keskustelemme elektroniorbitaaleista jäljempänä.
Alhaalla on esimerkkejä eräistä neutraaleista atomeista ja niiden elektronikonfiguraatioista. Tästä taulukosta näet, että heliumilla on täysi valenssikuori, ja sen ensimmäisessä ja ainoassa, 1n-kuoressa on kaksi elektronia. Vastaavasti neonilla on täydellinen ulompi 2n-kuori, jossa on kahdeksan elektronia. Nämä elektronikonfiguraatiot tekevät heliumista ja neonista erittäin vakaita. Vaikka argonilla ei teknisesti ole täyttä ulkokuorta, koska 3n-kuoressa voi olla jopa kahdeksantoista elektronia, se on neonin ja heliumin tavoin stabiili, koska sillä on kahdeksan elektronia 3n-kuoressa ja se täyttää siten oktettisäännön. Sitä vastoin kloorilla on vain seitsemän elektronia uloimmalla kuorellaan ja natriumilla vain yksi. Nämä kuviot eivät täytä ulointa kuorta eivätkä täytä oktettisääntöä, mikä tekee kloorista ja natriumista reaktiivisia, sillä ne haluavat saada tai menettää elektroneja saavuttaakseen vakaamman konfiguraation.
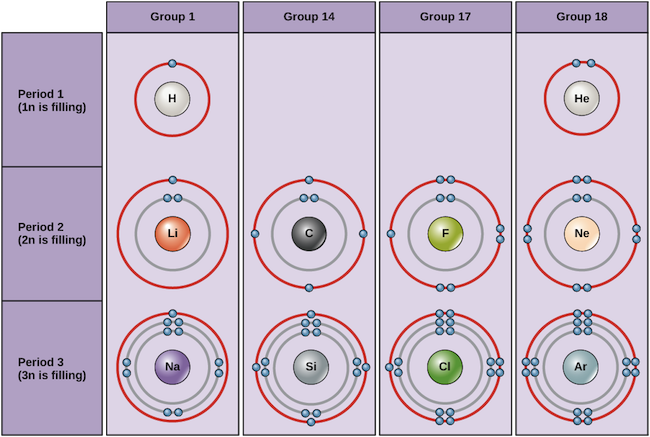
Bohr-kaaviot eri alkuaineista Image credit: OpenStax Biology
Elektronikonfiguraatiot ja jaksollinen järjestelmä
Elementit asetetaan jaksollisessa järjestelmässä järjestykseen niiden järjestysluvun, eli sen, kuinka monta protonia niillä on, perusteella. Neutraalissa atomissa elektronien määrä on yhtä suuri kuin protonien määrä, joten voimme helposti määrittää elektroniluvun atomiluvusta. Lisäksi alkuaineen sijainti jaksollisessa järjestelmässä – sen sarake eli ryhmä ja rivi eli jakso – antaa hyödyllistä tietoa siitä, miten elektronit ovat sijoittuneet.
Jos tarkastelemme vain taulukon kolmea ensimmäistä riviä, jotka sisältävät elämän kannalta tärkeät alkuaineet, kukin rivi vastaa eri elektronikuoren täyttymistä: helium ja vety sijoittavat elektroninsa 1n-kuoreen, kun taas toisen rivin alkuaineet, kuten Li, alkavat täyttää 2n-kuorta, ja kolmannen rivin alkuaineet, kuten Na, jatkavat 3n-kuorella. Vastaavasti alkuaineen sarakeluku antaa tietoa sen valenssielektronien määrästä ja reaktiivisuudesta. Yleensä valenssielektronien määrä on sama sarakkeessa ja kasvaa rivissä vasemmalta oikealle. Ryhmän 1 alkuaineilla on vain yksi valenssielektroni ja ryhmän 18 alkuaineilla kahdeksan, lukuun ottamatta heliumia, jolla on yhteensä vain kaksi elektronia. Näin ollen ryhmänumero on hyvä ennustaja siitä, kuinka reaktiivinen kukin alkuaine on:
- Heliumilla (He), neonilla (Ne) ja argonilla (Ar), jotka ovat ryhmän 18 alkuaineita, on täydet tai oktettisäännön mukaiset ulkoelektronikuoret. Tämä tekee niistä erittäin stabiileja yksittäisinä atomeina. Koska ne eivät ole reaktiivisia, niitä kutsutaan inertteiksi kaasuiksi tai jalokaasuiksi.
- Vety (H), litium (Li) ja natrium (Na) ovat ryhmän 1 alkuaineita, joiden uloimmissa kuorissa on vain yksi elektroni. Ne ovat epävakaita yksittäisinä atomeina, mutta niistä voi tulla vakaita menettämällä tai jakamalla yhden valenssielektroninsa. Jos nämä alkuaineet menettävät elektronin kokonaan – kuten Li ja Na tyypillisesti tekevät – niistä tulee positiivisesti varattuja ioneja: Li+, Na+.
- Fluorilla (F) ja kloorilla (Cl) on ryhmän 17 alkuaineina seitsemän elektronia uloimmissa kuorissaan. Ne pyrkivät saavuttamaan stabiilin kahdeksikon ottamalla elektronin muilta atomeilta, jolloin niistä tulee negatiivisesti varautuneita ioneja: F- ja Cl-.
- Hiilellä (C), ryhmän 14 alkuaineena, on neljä elektronia uloimmassa kuoressaan. Hiili jakaa tyypillisesti elektroneja täydellisen valenssikuoren saavuttamiseksi muodostaen sidoksia useiden muiden atomien kanssa.
Jaksollisen järjestelmän pylväät kuvastavat siis kunkin alkuaineen valenssikuoresta löytyvien elektronien lukumäärää, joka puolestaan määrää, miten alkuaine reagoi.
Kokeile
Kirjoita!
Paranna tätä sivuaOpi lisää
