Oppimistavoitteet
- Kirjoita yksinkertaisen ioniyhdisteen kemiallinen kaava.
- Tunnista moniatomiset ionit kemiallisissa kaavoissa.
Olemme jo törmänneet joihinkin yksinkertaisten ioniyhdisteiden kemiallisiin kaavoihin. Kemiallinen kaava on tiivis luettelo yhdisteen sisältämistä alkuaineista ja näiden alkuaineiden suhteista. Ymmärtääksemme paremmin, mitä kemiallinen kaava tarkoittaa, meidän on tarkasteltava, miten ioniyhdiste rakentuu sen ioneista.
Ioniyhdisteet ovat olemassa vuorottelevina positiivisina ja negatiivisina ioneina säännöllisissä, kolmiulotteisissa ruuduissa, joita kutsutaan kiteiksi (kuva \(\PageIndex{1}\)). Kuten näet, matriisissa ei ole yksittäisiä NaCl-”hiukkasia”; sen sijaan siinä on jatkuva natrium- ja kloridi-ionien vuorotteleva ristikko. Voimme kuitenkin käyttää natriumionien ja kloridi-ionien suhdetta pienimpinä mahdollisina kokonaislukuina ilmaistuna yhdisteen kuvaamiseen. Natriumkloridin tapauksessa natriumionien ja kloridi-ionien suhde pienimpinä kokonaislukuina ilmaistuna on 1:1, joten käytämme yhdisteen kuvaamiseen NaCl-merkkiä (yksi Na- ja yksi Cl-symboli). NaCl on siis natriumkloridin kemiallinen kaava, joka on tiivis tapa kuvata eri ionien suhteellista määrää yhdisteessä. Makroskooppinen näyte koostuu myriadeista NaCl-pareista; jokaista paria kutsutaan kaavayksiköksi. Vaikka on kätevää ajatella, että NaCl-kiteet koostuvat yksittäisistä NaCl-yksiköistä, kuva \(\PageIndex{1}\) osoittaa, että yksikään yksittäinen ioni ei ole yksinomaan yhteydessä mihinkään toiseen yksittäiseen ioniin. Jokaista ionia ympäröivät vastakkaisen varauksen omaavat ionit.
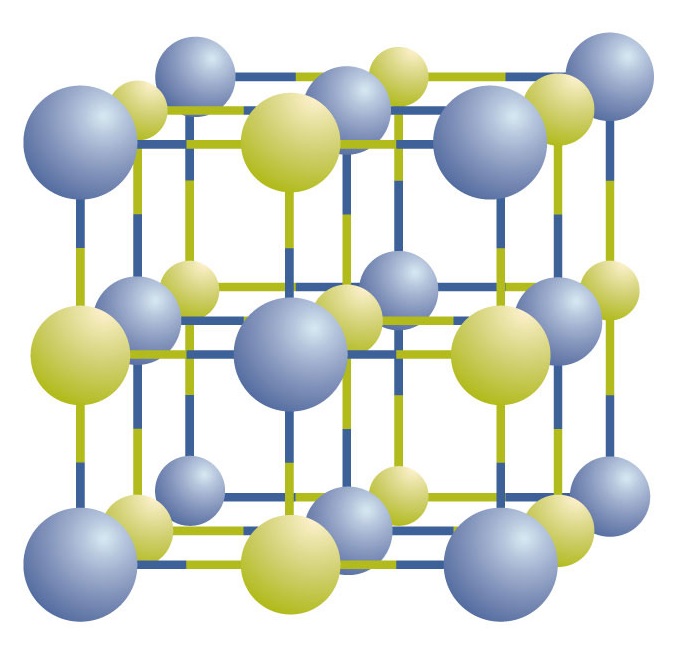
Kuva \(\PageIndex{1}\) Natriumkloridikide. Kide sisältää kolmiulotteisen joukon vuorotellen positiivisia ja negatiivisia ioneja. Tarkka kuvio riippuu yhdisteestä. Kuvassa näkyvä natriumkloridikide on kokoelma vuorottelevia natrium- ja kloori-ioneja.
Ionisen yhdisteen kaava noudattaa useita konventioita. Ensinnäkin kationi kirjoitetaan ennen anionia. Koska useimmat metallit muodostavat kationeja ja useimmat epämetallit anioneja, kaavoissa mainitaan yleensä ensin metalli ja sitten epämetalli. Toiseksi varauksia ei kirjoiteta kaavaan. Muista, että ionisessa yhdisteessä komponenttilajit ovat ioneja, eivät neutraaleja atomeja, vaikka kaavassa ei ole varauksia. Lopuksi, ionisen yhdisteen oikea kaava noudattaa aina seuraavaa sääntöä: positiivisen varauksen kokonaismäärän on oltava yhtä suuri kuin negatiivisen varauksen kokonaismäärän. Määrittääksesi minkä tahansa ioniyhdistelmän oikean kaavan, määritä, kuinka monta kutakin ionia tarvitaan tasapainottamaan yhdisteen positiivisten ja negatiivisten varausten kokonaismäärä.
Tämä sääntö perustuu viime kädessä siihen tosiasiaan, että aine on kaiken kaikkiaan sähköisesti neutraalia.
Konventionaalisesti oletetaan, että atomeja on vain yksi, jos alaindeksiä ei ole. Emme käytä 1:tä alaindeksinä.
Jos tarkastelemme litiumioneista ja bromidi-ioneista koostuvaa ioniyhdistettä, huomaamme, että litiumionilla on 1+ varaus ja bromidi-ionilla 1- varaus. Kummastakin tarvitaan vain yksi ioni näiden varausten tasapainottamiseksi. Litiumbromidin kaava on LiBr.
Kun magnesiumista ja hapesta muodostuu ioniyhdiste, magnesiumionilla on 2+ varaus ja happiatomilla 2- varaus. Vaikka näillä molemmilla ioneilla on suuremmat varaukset kuin litiumbromidin ioneilla, ne silti tasapainottavat toisiaan suhteessa yksi yhteen. Siksi tämän ioniyhdisteen oikea kaava on MgO.
Katsotaan nyt magnesiumin ja kloorin muodostamaa ioniyhdistettä. Magnesiumionilla on 2+ -varaus, kun taas kloori-ionilla on 1-varaus:
Mg2+ Cl-
Kummankin yhden ionin yhdistäminen ei täysin tasapainota positiivisia ja negatiivisia varauksia. Helpoin tapa tasapainottaa nämä varaukset on olettaa, että kutakin magnesiumionia kohden on kaksi kloridi-ionia:
Mg2+ Cl- Cl-
Nyt positiiviset ja negatiiviset varaukset ovat tasapainossa. Voisimme kirjoittaa tämän ioniyhdisteen kemiallisen kaavan muotoon MgClCl, mutta tapana on käyttää numeerista alaviivaa, kun tietyn tyyppisiä ioneja on enemmän kuin yksi – MgCl2. Tämä kemiallinen kaava kertoo, että tässä kaavassa on yksi magnesiumioni ja kaksi kloridi-ionia. (Älä lue kaavan ”Cl2”-osaa kaksiatomiseksi kloorimolekyyliksi. Klooria ei esiinny kaksiatomisena alkuaineena tässä yhdisteessä. Se esiintyy pikemminkin kahtena yksittäisenä kloridi-ionina). Yleissopimuksen mukaan ionisten yhdisteiden kaavoissa käytetään pienintä kokonaislukusuhdetta. Kaavassa Mg2Cl4 ionien varaukset ovat tasapainossa suhteessa 1:2, mutta se ei ole pienin kokonaislukusuhde.
Konvention mukaan ionien kaavoissa käytetään pienintä kokonaislukusuhdetta. Tietyille ioneille, kuten Hg22+
Esimerkki \(\PageIndex{1}\)
Kirjoita kemiallinen kaava ioniselle yhdisteelle, joka koostuu kustakin ioniparista.
- natriumioni ja rikkiioni
- alumiini-ioni ja fluoridi-ioni
- 3+ rauta-ioni ja happi-ioni
Liuos
- Valenssikuoren kahdeksikon saamiseksi natrium muodostaa ionin, jolla on 1+ -varaus, kun taas rikkiionilla on 2-varaus. Rikki-ionin 2-varauksen tasapainottamiseksi tarvitaan kaksi natrium 1+ -ionia. Sen sijaan, että kirjoittaisimme kaavan muodossa NaNaS, lyhennämme sen sopimuksen mukaan muotoon Na2S.
- Alumiini-ionilla on 3+ -varaus, kun taas fluorin muodostamalla fluoridi-ionilla on 1-varaus. Alumiini-ionin 3+ -varauksen tasapainottamiseen tarvitaan kolme fluorin 1-ionia. Tämä yhdistelmä kirjoitetaan seuraavasti: AlF3.
- Rauta voi muodostaa kaksi mahdollista ionia, mutta tässä on määritelty 3+ -varauksen omaava ioni. Happiatomilla on 2-varaus ionina. Positiivisten ja negatiivisten varausten tasapainottamiseksi etsitään pienin yhteinen monikerta-6: kaksi raudan 3+ -ionia antaa 6+, kun taas kolme 2- happi-ionia antaa 6-, mikä tasapainottaa positiiviset ja negatiiviset varaukset. Näin ollen tämän ioniyhdisteen kaava on Fe2O3.
Harjoitus \(\PageIndex{1}\)
Kirjoita kemiallinen kaava ioniyhdisteelle, joka koostuu kustakin ioniparista.
- kalsiumioni ja happi-ioni
- 2+ kupari-ioni ja rikki-ioni
- 1+ kupari-ioni ja rikki-ioni
Polyatomiset ionit
Jotkut ionit koostuvat toisiinsa sitoutuneista atomiryhmistä, ja niillä on sähköinen kokonaisvaraus. Koska nämä ionit sisältävät useamman kuin yhden atomin, niitä kutsutaan moniatomisiksi ioneiksi. Moniatomisilla ioneilla on tyypilliset kaavat, nimet ja varaukset, jotka tulisi muistaa ulkoa. Esimerkiksi NO3- on nitraatti-ioni; siinä on yksi typpiatomi ja kolme happiatomia, ja sen kokonaisvaraus on 1-. Taulukossa \(\PageIndex{1}\) luetellaan yleisimmät moniatomiset ionit.
| Name | Formula |
|---|---|
| ammoniumion | NH4+ |
| asetaatti-ioni | C2H3O2- |
| karbonaatti-ioni | CO32- |
| vetykarbonaatti-ioni (bikarbonaatti-ioni) | HCO3- |
| cyanidi-ioni | CN- |
| hydroksidi-ioni | OH- |
| fosfaatti-ioni | PO43- |
| vetyfosfaatti-ioni | HPO42- |
| divetyfosfaatti-ioni | H2PO4- | nitraatti-ioni | NO3- |
| sulfiitti-ioni | SO32- |
Polyatomisia ioneja sisältävien ioniyhdisteiden kaavojen konstruointisääntö on sama kuin moniatomisia ioneja sisältäville kaavoille (single-atomisia) ioneja: Positiivisten ja negatiivisten varausten on oltava tasapainossa. Jos varauksen tasapainottamiseen tarvitaan useampi kuin yksi tietty moniatominen ioni, koko moniatomisen ionin kaava on suljettava sulkuihin, ja numeerinen indeksi sijoitetaan sulkujen ulkopuolelle. Näin osoitetaan, että alaviite koskee koko moniatomaarista ionia. Esimerkki on Ba(NO3)2.
Esimerkki \(\PageIndex{2}\)
Kirjoita kemiallinen kaava ioniselle yhdisteelle, joka koostuu kustakin ioniparista.
- kaliumionin ja sulfaatti-ionin
- kalsiumionin ja nitraatti-ionin
Liuos
- Kaliumionien varaus on 1+, kun taas sulfaatti-ionien varaus on 2-. Tarvitsemme kaksi kaliumionia tasapainottamaan sulfaatti-ionin varauksen, joten oikea kemiallinen kaava on K2SO4.
- Kalsiumionien varaus on 2+, kun taas nitraatti-ionien varaus on 1-. Tarvitsemme kaksi nitraatti-ionia tasapainottamaan kunkin kalsiumionin varauksen. Nitraatin kaava on suljettava sulkuihin. Kirjoitamme siis Ca(NO3)2 tämän ioniyhdisteen kaavaksi.
Harjoitus \(\PageIndex{2}\)
Kirjoita kemiallinen kaava ioniyhdisteelle, joka koostuu kustakin ioniparista.
- magnesiumioni ja karbonaatti-ioni
- alumiini-ioni ja asetaatti-ioni
Ionisten yhdisteiden tunnistaminen
Ionisten yhdisteiden tunnistaminen tapahtuu kahdella tavalla. Ensinnäkin metallien ja ei-metallisten alkuaineiden väliset yhdisteet ovat yleensä ionisia. Esimerkiksi CaBr2 sisältää metallisen alkuaineen (kalsium, ryhmän 2A metalli) ja epämetallisen alkuaineen (bromi, ryhmän 7A epämetalli). Siksi se on todennäköisesti ioniyhdiste. (Itse asiassa se on ioninen.) Sitä vastoin yhdiste NO2 sisältää kaksi alkuaineita, jotka molemmat ovat epämetalleja (typpi, ryhmästä 5A, ja happi, ryhmästä 6A). Se ei ole ioniyhdiste; se kuuluu kovalenttisten yhdisteiden luokkaan, josta puhutaan toisaalla. Huomaa myös, että tällä typen ja hapen yhdistelmällä ei ole määriteltyä sähkövarausta, joten se ei ole nitriitti-ioni.
Toiseksi, jos tunnistat moniatomisen ionin kaavan yhdisteessä, yhdiste on ioninen. Jos esimerkiksi näet kaavan Ba(NO3)2, voit tunnistaa ”NO3”-osan nitraatti-ioniksi, \(\rm{NO_3^-}\). (Muista, että ionisten yhdisteiden kaavojen kirjoittamisessa ei ole tapana sisällyttää ionivarausta). Tämä on vihje siitä, että kaavan toinen osa, Ba, on itse asiassa Ba2+-ioni, jonka 2+ -varaus tasapainottaa kahden nitraatti-ionin aiheuttaman 2- kokonaisvarauksen. Näin ollen tämä yhdiste on myös ioninen.
Esimerkki \(\PageIndex{3}\)
Tunnista jokainen yhdiste ioniseksi tai ei-ioniseksi.
- Na2O
- PCl3
- NH4Cl
- OF2
Liuos
- Natrium on metalli ja happi ei-metalli, joten Na2O:n oletetaan olevan ioninen.
- Kumpikin fosfori ja kloori ovat ei-metalleja. Siksi PCl3 ei ole ioninen.
- Kaavassa oleva NH4 edustaa ammoniumionia, NH4+, mikä osoittaa, että tämä yhdiste on ioninen.
- Kumpikin happi ja fluori ovat epämetalleja. Siksi OF2 ei ole ioninen.
Harjoitus \(\PageIndex{3}\)
Tunnista jokainen yhdiste ioniseksi tai ei-ioniseksi.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Katsokaa tarkemmin: Veri ja merivesi
Tiede on jo pitkään todennut, että veri ja merivesi ovat koostumukseltaan samanlaisia. Loppujen lopuksi molempiin nesteisiin on liuennut ionisia yhdisteitä. Samankaltaisuus voi olla muutakin kuin pelkkää sattumaa; monet tiedemiehet uskovat, että ensimmäiset elämänmuodot maapallolla syntyivät valtamerissä. Lähempi tarkastelu kuitenkin osoittaa, että veri ja merivesi ovat varsin erilaisia. 0,9-prosenttinen natriumkloridiliuos vastaa suunnilleen veressä olevaa suolapitoisuutta. Sen sijaan merivesi on pääasiassa 3-prosenttista natriumkloridiliuosta, joka on yli kolminkertainen veren suolapitoisuuteen verrattuna. Tässä vertailu ionien määristä veressä ja merivedessä:
| Ioni | Prosentti merivedessä | Prosentti veressä |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl- | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0.01 |
Useimmat ionit ovat runsaampia merivedessä kuin veressä joitakin tärkeitä poikkeuksia lukuun ottamatta. Veressä on paljon enemmän vetykarbonaatti-ioneja (HCO3-) kuin merivedessä. Tämä ero on merkittävä, koska vetykarbonaatti-ionilla ja eräillä siihen liittyvillä ioneilla on ratkaiseva merkitys veren happo-emäsominaisuuksien säätelyssä. Vetyfosfaatti-ionien (HPO42- ja H2PO4-) määrä merivedessä on hyvin pieni, mutta niitä on enemmän veressä, jossa ne vaikuttavat myös happo-emäs-ominaisuuksiin. Toinen merkittävä ero on se, että veressä ei ole merkittäviä määriä sulfaatti-ionia (SO42-), mutta tätä ionia esiintyy merivedessä.
Key Takeaways
- Ionisten yhdisteiden oikeat kemialliset kaavat tasapainottavat positiivisen kokonaisvarauksen ja negatiivisen kokonaisvarauksen.
- On olemassa myös atomiryhmiä, joilla on kokonaisvaraus ja joita kutsutaan moniatomisiksi ioneiksi.
Tekijät ja attribuutiot
-
Anonyymi
