Przeglądy
Znaczenie niedokrwistości w różnych okresach życia
Guzmán Llanos, María José*; Guzmán Zamudio, José L.** y LLanos de los Reyes-García, M.J.***
*Pielęgniarka pediatryczna Hospital SAS de Jerez de la Frontera (Cádiz). E-mail: [email protected]
**Ph.D. Haematologist.
***Nurse Day Hospital of Haematology-Oncology Hospital del SAS de Jerez de la Frontera (Cádiz)
SUMMARY
Abstract: Anaemia has a high prevalence in primary care and paediatric consultations, and ADH accounts for 50% of all cases of anaemia.
Metodologia: Przegląd piśmiennictwa i opisowa analiza dokumentów dotyczących etiopatogenezy niedokrwistości z niedoboru żelaza, podstawowych badań diagnostycznych w kierunku badania ADH i jego znaczenia, z zastosowaniem określonych ram czasowych w wyszukiwaniu dokumentów oraz kryteriów włączenia do badania zgodnie z wymiarami analizowanymi w pracy: Wyobrażenia na temat metabolizmu żelaza. Wyobrażenia o hematopoezie. Diagnostyka laboratoryjna i klasyfikacja anemii. Klinika anemii z niedoboru żelaza. Przyczyny niedoboru żelaza.
Wyniki i wnioski: Przeprowadzone badanie dokumentacyjne wskazuje na istnienie publikacji zawierających treści dotyczące etiopatogenezy niedokrwistości z niedoboru żelaza, podstawowych testów diagnostycznych w badaniu ADH i ich znaczenia, co świadczy o znaczeniu tych treści dla profesjonalisty pielęgniarskiego w obszarze podstawowej opieki zdrowotnej i pediatrii.
Palabras clave: anemia por deficiencia de hierro; anemia en la gestación, anemia en el anciano.
ABSTRACT
Overview: Anemia is very common in primary care consultations and pediatrics, and IDA is the cause of 50% of all cases of anemia.
Metodologia: Przegląd piśmiennictwa i analiza opisowa dokumentów dotyczących patogenezy niedokrwistości z niedoboru żelaza, podstawowych testów diagnostycznych do badania IDA i znaczenia takich z wykorzystaniem określonego okresu czasu w poszukiwaniu dokumentów i kryteriów włączenia, które uwzględniają czynniki, które są analizowane w badaniu: Idee dotyczące metabolizmu żelaza. Poglądy na temat hematopoezy. Diagnostyka laboratoryjna i klasyfikacja niedokrwistości. Cechy kliniczne niedokrwistości z niedoboru żelaza. Przyczyny niedoboru żelaza.
Wyniki i wnioski: Etapowe badanie dokumentalne obejmuje publikacje na temat patogenezy niedokrwistości z niedoboru żelaza, podstawowe testy diagnostyczne do badania IDA i znaczenie takich, i pokazuje, jak ważne są te dane dla profesjonalnego pielęgniarstwa w dziedzinie podstawowej opieki zdrowotnej i pediatrii, aby zidentyfikować je i działać odpowiednio.
Słowa kluczowe: niedokrwistość z niedoboru żelaza; niedokrwistość w ciąży; niedokrwistość u seniorów.
Introducción
La OMS define la anemia como el descenso del nivel de hemoglobina dos desviaciones estándar por debajo de lo normal para la edad y el sexo(1). En términos prácticos podemos adoptar las cifras de 13 gr/dl en el hombre, 12 gr/dl en las mujeres y 11 en la embarazada. U dzieci od 6 miesięcy do 6 lat 11/gr/dl, a od 6 do 14 lat 12 gr/dl. Kryteria te są oparte na badaniach populacyjnych, które nie obejmują osób powyżej 65 roku życia i mogą nie mieć zastosowania u osób starszych.
Anemia jest bardzo rozpowszechniona w konsultacjach podstawowej opieki zdrowotnej, pediatrii i w monitorowaniu ciąży. Niedobór żelaza (IDA) to nie to samo co anemia z niedoboru żelaza (IDA). IDA jest najczęstszą przyczyną anemii na świecie i stanowi poważny problem zdrowotny głównie w krajach słabo rozwiniętych. ADH jest bardzo rozpowszechniona, dlatego do 5% dzieci i młodzieży, 10% kobiet w okresie przedmenopauzalnym i 1% mężczyzn cierpi na anemię z niedoboru żelaza; a u osób starszych objętych opieką domową może ona sięgać nawet 40%.
Większość placówek służby zdrowia posiada wytyczne kliniczne dotyczące postępowania w przypadku niedokrwistości w ogóle i/lub niedokrwistości ciążowej (2,3)
Dokrwistość ciążowa jest uważana za czynnik ryzyka dla ciąży i może powodować niedokrwistość w okresie noworodkowym z powodu niskich zapasów żelaza. (4)
Anemia w dzieciństwie: ADH wpływa na wzrost i rozwój dzieci, zmniejsza odporność na infekcje oraz upośledza rozwój poznawczy i psychomotoryczny.(5,6)
Według raportu WHO z lat 1993-2005 częstość występowania IDA u przedszkolaków może stanowić 47,4%, a dla tej samej agencji obecność ponad 40% stanowi poważny problem zdrowotny. (7).
W ADH u kobiet po menopauzie, dorosłych i osób w podeszłym wieku należy zawsze wykluczyć przeciek pokarmowy.
Cel
Celem pracy jest określenie etiopatogenezy niedokrwistości z niedoboru żelaza, podstawowych testów diagnostycznych do badania ADH i ich znaczenia, poprzez przegląd piśmiennictwa, oraz rozpoznanie różnych etapów niedoboru żelaza wcześnie w konsultacjach podstawowej opieki zdrowotnej, pediatrycznej i opieki nad kobietą ciężarną, jako działanie prewencyjne i możliwość poprawy wszystkich działań pielęgniarskich w tych procesach.
Metodologia
Przegląd bibliograficzny piśmiennictwa opublikowanego na temat etiopatogenezy anemii z niedoboru żelaza oraz testów diagnostycznych do badania ADH i jego znaczenia. Opisowe opracowanie dokumentacyjne z różnych źródeł bibliograficznych i baz danych na badany temat.
Ramy czasowe zastosowane w kwerendzie bibliograficznej koncentrowały się na latach 2000-2014, jak również niektóre inne bibliografie o charakterze referencyjnym na analizowany temat, poza tymi ramami czasowymi.
Kryteria włączenia do kwerendy bibliograficznej opierają się na artykułach i dokumentacjach opublikowanych na dany temat, w wybranym przedziale czasowym, doprecyzowanych według ich zawartości i wymiarów, które mają być analizowane (Notions on iron metabolism. Wyobrażenia o hematopoezie. Diagnostyka laboratoryjna i klasyfikacja anemii. Klinika anemii z niedoboru żelaza. Causes of iron deficiency).
Następujące deskryptory lub słowa kluczowe zostały użyte jako słowa kluczowe wyszukiwania: niedokrwistość z niedoboru żelaza w dzieciństwie (4368 artykułów), niedokrwistość z niedoboru żelaza w ciąży (do 2173 artykułów) i u osób starszych (4605) i z nich dokonano wyboru, zgodnie z kryteriami włączenia do przeprowadzonego przeglądu.
Wyniki
1.-Informacje na temat metabolizmu żelaza
Żelazo jest ważne, ponieważ jest częścią hemoglobiny i cytochromów. Po zakończeniu wzrostu, żelazo w organizmie pozostaje stałe w bardzo wąskim zakresie. Żelazo w organizmie jest poddawane cyklicznej obróbce i recyklingowi w różnych basenach. (8,9)
– Pochłanianie: Żelazo, które przyjmujemy z pożywieniem musi zostać wchłonięte, następnie przetransportowane przez krew i w końcu zmagazynowane w postaci depot żelaza (magazynów żelaza). Żelazo, które przyjmujemy z pożywieniem występuje w postaci Fe +++, ale w dwunastnicy i górnej części jelita czczego jest wchłaniane w postaci Fe ++, dlatego musi przejść proces redukcji z udziałem kwasu askorbinowego. Tylko 10% żelaza zawartego w diecie jest wchłaniane, co stanowi 0,25% całkowitej ilości żelaza w organizmie. Szereg czynników sprzyja lub utrudnia wchłanianie żelaza.
Wchłanianie żelaza jest dostosowane do zapotrzebowania organizmu na żelazo. W przypadku anemii z niedoboru żelaza, wchłanianie żelaza jest uprzywilejowane. Metabolizm żelaza jest wyjątkowy w tym, że równowaga żelaza jest kontrolowana głównie przez wchłanianie, a nie wydalanie.
Żelazo w diecie: zawartość żelaza w diecie wynosi około 10 do 30 mg/dobę dla osoby dorosłej. Przy wchłanianiu 5 do 10% żelaza z diety (0,5 do 1 mgr) proporcja ta wzrasta do 20% w przypadku niedoboru żelaza i maleje w przypadku przeciążenia żelazem.
– Transport: Żelazo we krwi jest związane z jego białkiem transportowym transferyną). Kompleks żelazo-transferyna jest pobierany do komórek przez specyficzny receptor.
Transferyna jest syntetyzowana w wątrobie, a jej stężenie we krwi przekracza zdolność wiązania żelaza i około dwóch trzecich zdolności wiązania jest nienasycona.
Wreszcie, żelazo musi być przechowywane w postaci ferrytyny i/lub hemosyderyny; około 1 mikrogram/L ferrytyny w surowicy odpowiada 10 mg przechowywanego żelaza.
Rozkład żelaza: największa pula żelaza znajduje się w czerwonych krwinkach jako żelazo związane z hemoglobiną i wynosi około 2500 mg. Kolejne 40 mg wchodzi w skład mioglobiny. Narządy depot przechowywać 800 do 1200 mg. Tylko 4 mg jest w postaci żelaza związanego z transferyną.
Zapotrzebowanie na żelazo i bilans żelaza: Zapotrzebowanie zdrowej osoby dorosłej i kobiety po menopauzie wynosi około 1 mg/dobę.
Zapotrzebowanie wzrasta do 5 mg dla kobiet w wieku rozrodczym, dawców krwi itp.
W przypadku kobiet w ciąży zapotrzebowanie wynosi 7 mg/d.
Wydalanie żelaza nie jest tak dobrze uregulowane; około 1 mg żelaza dziennie jest eliminowane przez jelita, mocz i pot. Wraz z miesiączką dochodzi do utraty 15-30 mg żelaza, co może być wyrównane przez zwiększone wchłanianie, ale jest trudniejsze do wyrównania w przypadku menorrhagii; inną przyczyną może być częsta hemodoncja, a w okresie niemowlęcym nadmierna ilość testów analitycznych.
2.-Uwaga o hematopoezie
Tworzenie elementów składowych krwi (leukocytów, krwinek czerwonych i płytek krwi) odbywa się w szpiku kostnym, a proces ten nazywamy hematopoezą. Począwszy od pluripotencjalnej komórki macierzystej i stymulowanej erytropoetyną, ta komórka macierzysta po kilku transformacjach doprowadziłaby do powstania dojrzałego hemocytu, procesu znanego jako erytropoeza(10). Erytropoetyna (EPO) jest głównym czynnikiem wzrostu regulującym erytropoezę. Jest on produkowany w nerkach. Stymuluje proliferację szeregu erytroidalnego i uwalnianie retikulocytów ze szpiku kostnego. Około 20-30% komórek macierzystych różnicuje się w kierunku erytropoezy. Hemocyt jest bezjądrową komórką, której główną funkcją, dzięki hemoglobinie (Hb), jest transport tlenu do tkanek.
Synteza hemoglobiny zachodzi na etapie normoblastu, a gdy hemoglobina jest w pełni zhemoglobinizowana, jądro zostaje uwolnione i daje początek retikulocytowi.
Do utrzymania prawidłowej hematopoezy wymagana jest odpowiednia podaż żelaza oraz odpowiednie stężenie witaminy B-12 i kwasu foliowego.
Hb składa się z części białkowej (globiny) i grupy hemowej (która przenosi atom żelaza).
W miarę starzenia się krwinek czerwonych są one fagocytowane przez komórki jednojądrowego układu fagocytarnego. Następuje to w około 120 dniu i około 0,8% puli krwinek czerwonych jest wykorzystywana, a równowaga jest utrzymywana między tym, co powstaje, a tym, co jest niszczone.
3.- Diagnostyka laboratoryjna i klasyfikacja niedokrwistości
3.1. Przede wszystkim musimy potwierdzić, że pacjent ma niedokrwistość, a następnie, że jest to spowodowane niedoborem żelaza, a w tym celu poprosimy:
– Hemogram jest najbardziej podstawowym badaniem, dostarcza nam wielu informacji, ponieważ podaje nam liczbę czerwonych krwinek, wartość hemoglobiny i wskaźniki korpuskularne VCM, HCM. Oprócz liczby leukocytów i płytek krwi. I to wszystko przydaje się przy klasyfikowaniu anemii. Anemii z niedoboru żelaza często towarzyszy trombocytoza reaktywna.
– Parametry związane z metabolizmem żelaza: sideremia, transferyna, wskaźnik wysycenia transferyny i rozpuszczalny receptor transferyny (RsTf)
– Ocena złogów: ferrytyna w surowicy.
– Przegląd rozmazu krwi: ujawnia zawartość hemoglobiny (hipochromia), zmiany w kształcie (poikilocytoza) i wielkości (anizocytoza), które prowadzą nas do prawidłowej diagnozy.
Znaczenie kliniczne różnych białek zaangażowanych w transport i odkładanie żelaza.
Ferrytyna: Jest to najważniejsze białko odkładające żelazo. Wysokie stężenia występują w wątrobie, śledzionie i szpiku kostnym. Zawiera 15-20% żelaza w organizmie.
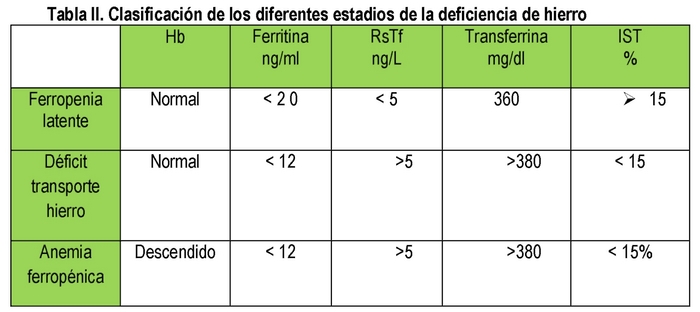
Niewielka ilość wytworzonej ferrytyny jest wydzielana przez komórki i przechodzi do krwiobiegu. Istnieje bezpośrednia korelacja pomiędzy ilością tego białka a zmagazynowanym żelazem, tak więc: 1 mcg/L ferrytyny w surowicy odpowiada 10 mg zmagazynowanego żelaza. Ferrytyna w surowicy jest dobrym wskaźnikiem zapasów żelaza. (11) Jednakże należy również pamiętać, że ferrytyna jest reaktantem ostrej fazy, więc czasami należy również zażądać oznaczenia białka c-reaktywnego (CRP) w celu wykluczenia obecności procesu infekcyjnego/zapalnego. Ferrytyna jest zatem bardzo przydatna do oceny metabolizmu żelaza. Wartości < z 12 ng/ml definiują utajony niedobór żelaza. Podwyższona ferrytyna > o 400 ng/ml może wskazywać na obecność przeciążenia żelazem.
Transferyna, nasycenie transferyny: Transferyna jest białkiem syntetyzowanym w wątrobie i w 15 do 45% jest nasycona żelazem. Jeśli funkcjonalna podaż żelaza jest niewystarczająca, synteza tego białka będzie zwiększona; podwyższone wartości występują w niedoborze żelaza i ciąży.
Receptor transferyny rozpuszczalny (RsTf): Około 75% receptorów transferyny znajduje się w prekursorach erytropoezy. Liczba receptorów transferyny wzrasta, gdy funkcjonalne zaopatrzenie w żelazo jest słabe. Forma rozpuszczalna jest znana jako (RsTf). Jest to jedyny biologiczny marker
, który wskazuje na niedostateczne zaopatrzenie erytropoezy w żelazo. Ma zatem wartość uzupełniającą w stosunku do ferrytyny. Na RsTf nie mają wpływu reakcje ostrej fazy, więc wskazuje ona na niedobór żelaza w obecności infekcji, zapalenia i/lub nowotworów.(12)
3.2- Klasyfikacja niedokrwistości
Praktycznym sposobem klasyfikowania niedokrwistości jest wielkość krwinek czerwonych (MCV) i zawartość hemoglobiny (MCH). Te dwa parametry podaje odczyt dowolnego hemogramu z nowoczesnych liczników komórek.
– Według wielkości mówimy o niedokrwistościach normocytowych, mikrocytowych i makrocytowych, a według zawartości Hb (MCH) o niedokrwistościach normochromowych, hipochromowych i hiperchromowych13 (tab. I)
– Według wielkości mówimy o niedokrwistościach normocytowych, mikrocytowych i makrocytowych. (Tabela I).

W przypadku niedokrwistości z niedoboru żelaza są one zwykle mikrocytarne i hipochromiczne.
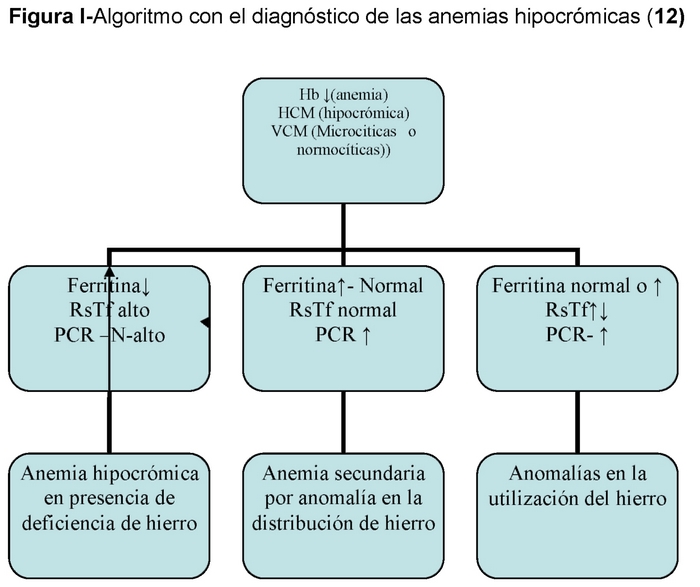
Skróty:
– DH: niedobór żelaza
– ADH: anemia z niedoboru żelaza
– Hb: hemoglobina
– MCV: średnia objętość ciała
– HVM: średnia hemoglobina ciałkowa
– RsTf: rozpuszczalny receptor transferyny
– CRP: białko C-reaktywne
– Zgodnie z ciężkością kliniczną:
– Ciężka anemia: Hb < 7.0 gr/dl
– Umiarkowana anemia 7,1 -10,0 gr/dl
– Łagodna anemia 10,1 – 10.9 gr/dl
ADH jest końcowym etapem procesu, który zaczyna się od utajonego niedoboru żelaza, w którym nie ma anemii, ale jest niedobór ferrytyny, następnie niedobór transportu żelaza, w którym oprócz niskiej ferrytyny jest TSI poniżej 15% i wreszcie ADH z niską ferrytyną, TSI < 15% i anemią. (Tabela II)
– Inne niedokrwistości z zaburzeniami dystrybucji żelaza: 14,15
Anemia chorób przewlekłych (ACD): W tych przypadkach występuje redystrybucja żelaza z podwyższoną zawartością żelaza w depozycie i względnym niedoborem żelaza w komórkach erytropoetycznych w wyniku zmniejszonej syntezy transferyny. Ta zmniejszona dostępność żelaza miałaby działanie ochronne przed infekcjami.
Niedokrwistość z choroby nerek: W tym przypadku zapasy żelaza są normalne, ale mobilizacja żelaza jest upośledzona (niskie nasycenie transferyny), co może prowadzić do upośledzenia erytropoezy i słabej funkcji żelaza. Nie można stosować żelaza doustnie, ponieważ wchłanianie jest upośledzone.
Niedokrwistość wrotna jest czasami powikłana komponentem hemolitycznym.
– Niewywołane żelazem zaburzenia erytropoezy:
Niedobór witaminy B-12 i kwasu foliowego
Talasemie: w tej chorobie występuje zmniejszona synteza łańcucha globiny lub jej brak. Struktura łańcucha globiny jest prawidłowa. W zależności od ilości uszkodzonej globiny, talasemia nazywana jest talasemią alfa, beta, gamma, delta. Zwykle objawiają się mikrocytozą, hipochromią i anemią o różnym nasileniu. 13,14
Z powodu mikrocytozy i hipochromii może być mylona z niedokrwistością z niedoboru żelaza.
Najczęstsze są talasemia alfa minor i talasemia beta minor. Należy zauważyć, że dzieci z talasemią mogą mieć również anemię z niedoboru żelaza i mogą wymagać leczenia doustnymi preparatami żelaza. Wraz ze spadkiem syntezy jednego łańcucha globiny, wzrasta synteza pozostałych globin (Hb A2, Hb F). Oznaczenie ilościowe tych hemoglobin pomaga nam w ich klasyfikacji.
Niemniej jednak nie wszystkie niedokrwistości mikrocytarne i hipochromiczne są niedokrwistościami z niedoboru żelaza i w tej grupie musimy wyróżnić te, w których występuje słabe wykorzystanie żelaza, jak np. niedokrwistość w chorobach przewlekłych itp.
4.
Objawy niedokrwistości z niedoboru żelaza nie różnią się od objawów innych niedokrwistości, tj. są niespecyficzne; są to głównie zmęczenie, zmęczenie, brak siły, ale te objawy będą bardziej zależały od szybkości początku niedokrwistości niż od poziomu hemoglobiny.
Większość objawów może być wyjaśniona przez niedobór żelaza.
Pagofagia: kompulsywna tendencja do jedzenia lodu.
Geofagia: skłonność do jedzenia brudnych rzeczy
Zmiany w nabłonku: koilonychia, kątowe zapalenie jamy ustnej, zanik brodawek językowych, zmiany w błonach śluzowych jelit.
Nietolerancja wysiłku fizycznego Zmiany behawioralne: dziecko staje się apatyczne i drażliwe.
5.-Przyczyny niedoboru żelaza: (16)
Zwiększone potrzeby fizjologiczne: wzrost, menstruacja, ciąża, laktacja.
Utrata krwi: żołądkowo-jelitowa, moczowo-płciowa, jatrogenna
Wchłanianie: resekcje żołądka, przewlekłe zanikowe zapalenie żołądka, leki Nieodpowiednie spożycie: osoby starsze, wegetarianie
ADH jest częścią bardziej złożonej diagnostyki i nie ma takiego samego znaczenia na różnych etapach życia.
A. W niemowlęctwie byłoby to wyjaśnione przez zwiększone potrzeby produkowane przez wzrost. W przypadku chorego dziecka bardzo ważna jest liczba i ilość krwi pobranej do badań(7,18,19)
Noworodek rozpoczyna życie z około 80 mg żelaza na kg masy ciała, a większość tego żelaza wchodzi w skład Hb o masie 50 gr/kg. Ilość żelaza w organizmie noworodka zależy od masy ciała i masy hemoglobiny krążącej. Przecięcie pępowiny zaraz po urodzeniu może spowodować utratę 15-30% całkowitej ilości żelaza. Stężenie Hb u noworodków jest niezależne od stężenia Hb i żelaza u matki. Nie ma również korelacji między poziomem ferrytyny we krwi matki i krwi pępowinowej.
Noworodki urodzone przez matki chore na cukrzycę, pomimo wysokiej masy urodzeniowej, mogą mieć niedobór żelaza.
W ciągu pierwszych 5 miesięcy życia noworodek jest w stanie podwoić swoją masę ciała bez opróżniania zapasów żelaza. Po tym, wchłanianie żelaza jest ważne dla utrzymania równowagi żelaza.
Podczas pierwszego roku życia wymagania są większe niż w pozostałym okresie życia. Dziecko potrzebuje około 0,5 mg/d, aby zaspokoić potrzeby narzucone przez wzrost. Mleko raczej nie jest w stanie dostarczyć takiej ilości żelaza, jednak anemia z niedoboru żelaza jest rzadka u dzieci karmionych wyłącznie piersią. Można to wytłumaczyć faktem, że żelazo z mleka jest wchłaniane do 80%. Stan odżywienia niemowląt karmionych piersią jest lepszy niż niemowląt karmionych mlekiem krowim. Między 6 a 12 miesiącem u niemowląt karmionych mlekiem może wystąpić niedobór żelaza.
Powszechność DH jest związana ze statusem socjoekonomicznym rodziny).
B.- U kobiet w wieku rozrodczym, częstość występowania DH jest związana z funkcjami poznawczymi, a nawet z napadami gorączkowymi.
B.- U kobiet w wieku rozrodczym, częstość występowania DH jest związana ze statusem socjoekonomicznym rodziny. U kobiet w wieku rozrodczym byłoby to wyjaśnione przez żelazo utracone w wyniku menstruacji, ciąży i laktacji.(20)
Utrata menstruacyjna u większości kobiet wynosi 40 ml, co jest równoważne 20 mgr żelaza. W Europie dieta zawiera wystarczającą ilość żelaza, aby zrekompensować utratę krwi w ilości 80 ml lub 1,2 mg/d. Nadmierne krwawienie miesiączkowe jest główną przyczyną anemii i dotyczy 9-14% kobiet (21)
Ciąża powoduje utratę około 680 mg żelaza. Jest to znacznie więcej niż może być wchłonięte, więc suplementacja żelaza jest potrzebna podczas ciąży.
Obecnie ponad 40 milionów kobiet w ciąży w krajach rozwijających się cierpi na niedobór żelaza. Niedokrwistość z niedoboru żelaza stanowi 75-95% anemii w ciąży. Niedokrwistość z niedoboru żelaza w czasie ciąży jest związana z wcześniactwem, niską masą urodzeniową i zachorowalnością matek. Zapotrzebowanie na żelazo zmienia się w czasie ciąży. W II i III trymestrze ciąży należy przyjmować od 4 do 5 mg żelaza. Doustna profilaktyka żelazem jest najlepszym sposobem na wyrównanie tego deficytu. Fizjologiczne zapotrzebowanie na żelazo w czasie ciąży nie może być zaspokojone przez jednoczesne podawanie z kwasem foliowym. Zalecenia mówią o 60 mg żelaza dla kobiet bez anemii plus kwas foliowy.(22)
C. – U kobiet po menopauzie, dorosłych i osób starszych diagnoza może być poważniejsza i należy wykluczyć przeciek trawienny(23).
U osób starszych poziom Hb nie jest tak dobrze określony, aby zdefiniować niedokrwistość.
U osób starszych prawidłowy poziom ferrytyny nie zawsze wyklucza niedobór żelaza, dlatego poziom odcięcia dla przewidywania niedoboru żelaza musi być podniesiony do 50 mikrogramów/L.
Badanie przewodu pokarmowego jest wskazane w tej grupie chorych ze względu na dużą częstość wykrywania zmian utajonych.
W grupie chorych powyżej 75 roku życia z niedokrwistością z niedoboru żelaza do 68% pacjentów, u których wykonano endoskopię, wykryto przyczynę krwawienia, a do 11% przypadków stwierdzono zmianę synchroniczną.
Brak niedoboru żelaza nie wyklucza obecności nowotworu przewodu pokarmowego(24). Nawet u 20-30% osób starszych przyczyna niedokrwistości jest nieznana, co określa się mianem „idiopatycznej niedokrwistości wieku starczego”
Wnioski
– Diagnostyka i klasyfikacja ADH opiera się na podstawowych technikach łatwo dostępnych w każdym laboratorium klinicznym,
– ADH jest końcem procesu, który zaczyna się od niedoboru żelaza.
– Klinika ADH jest podobna do innych niedokrwistości, ale istnieją specyficzne objawy, które mogą być przypisane do niedoboru żelaza.
– ADH jest najczęściej występującą niedokrwistością na wszystkich etapach życia
– W niemowlęctwie między 6 i 12 miesięcy życia dzieci karmione wyłącznie mlekiem krowim może rozwijać niedobór żelaza. U dziecka hospitalizowanego ważną przyczyną jest liczba pobrań krwi.
– ADH odpowiada za 75%-95% niedokrwistości w ciąży
– W przypadku kobiet po menopauzie, dorosłych i osób w podeszłym wieku należy zawsze wykluczyć przeciek pokarmowy.
– U osób w podeszłym wieku do 20-30% przypadków etiologia jest nieznana
Przypisy
1. Światowa Organizacja Zdrowia. Ocena niedokrwistości z niedoboru żelaza, zapobieganie i kontrola. Przewodnik dla kierowników programów. Genewa, Szwajcaria. Światowa Organizacja Zdrowia 2001.
2. Proces opieki nad niedokrwistością. Proceso de anemia. Proceso asistencial integrado (Sewilla) Conserjería de Salud 2013. http://hdl.handle.net/10668/1683.
3. Ministerstwo Zdrowia Publicznego. Wytyczne praktyki klinicznej. Diagnostyka i leczenie anemii w ciąży. Wydanie pierwsze, Quito. Krajowa Dyrekcja Normalizacyjna. 2014. http://saludgob.ec.
4. Mateusz W, Domagalski, JE. Niedokrwistość z niedoboru żelaza: ocena i postępowanie. American Family Physician 2013, vol 87, 2, 98-104.
5. Baker RD. Clinical report Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and Young children (0-3 years of age) Pediatrics vol 126: %, 1040-1051, 2010. http://www.bcguidelines.ca/pdf/iron_deficiency.pdf.
6. Lukens J N. Metabolizm żelaza i niedobór żelaza. Rozdział 6. Choroby krwi niemowląt i dzieciństwa. wydanie 7-o.1995 Mosby.
7. OMS 1993-2005.Częstość występowania anemii na świecie.- 1993-2005 WHO. Global database on anaemia. http://whqlibdoc.who.int/publications/2008/978924159657_eng.pdf.
8. Aisen P. Conceptos actuales sobre el metabolismo del hierro1-18; Clínica Hematológica; vol 10/2. Trastorno del metabolismo del hierro 1984. Salvat Editores.
9. Wick M, Pinggera W, Lehmann P. Aspekty kliniczne i laboratoryjne metabolizmu żelaza, niedokrwistości. Novel concepts in the anemias of malignancies and reumatoid diseases and reumatoid diseases. Piąte, rozszerzone wydanie. 2013 Springer Wien New York.
10. Rapaport S.I. Erytropoeza. Capítulo 1, 2-5 Introducción a la hematología 1974. Salvat Editores.
11. Goddard AF, James MW; Mcintyre AS, Scott BB; British Society of Gastroenterology. Guidelines for the management of iron deficiency anaemia. Gut. 2011; 60 (10): 1309-1316.
12. Mast AE, Blinder MA, Gronosky AM, Chumley C, Scott MG. Clinical utility of the soluble transferrin receptor and comparison with serum ferritin in several populations. Clin Chem. 1998; 44(1): 45-51.
13. Tefferi A, Hansen CA, Inwards DS. Jak interpretować i postępować w przypadku nieprawidłowej pełnej liczby krwinek u dorosłych. Mayo Clin Proc 2005, 80: 923-936.
14. Wick M, Pinggera W, Lehmann P. Clinical aspects and laboratory iron metabolism, anaemias. Diagnostyka zaburzeń metabolizmu żelaza. Zaburzenia erytropoezy. Piąte, rozszerzone wydanie.2003. Springer Wien New York.
15. Goddard AF, James MW, Mcintyre AS, Scott BB; British Society of Gastroenterology. Guidelines for the management of iron deficiency anaemia. Gut. 2011; 60 (10); 1309-1316.
16. Orkin HS, Nathan DG. The thalassemias. Rozdział 21. Hematologia niemowlęca i dziecięca Nathana i Orkina. Wydanie 5a.1998 W. B. Saunders Company.
17. Lee GR. Microcytosis and the anemias associated with impaired hemoglobin synthesis. Rozdział 25. Hematologia kliniczna Wintrobe’a. Ninth Edition.1993. LEA i FEBIGER.
18. Verga M E. Niedobór żelaza w niemowlęctwie: czy imigrant jest bardziej zagrożony? Swiss Med Wkly 2014; 144w14065.
19. Carter RC, Jacobson JL, Burden M et al. Iron deficiency anemia and cognitive function in infancy. Pediatrics 2010; 126 (2) 427-434.
20. Mohammad Reza Sharif, Davood Kheirkhah, et al. The relationship between iron deficiency and febrile convulsion: a case-control study. Global Journal of Health Science. Global Journal of Health Science. 2016. Vol 8 (2)185-189.
21) Breyman C. Niedobór żelaza w ciąży. Seminars in hematol;2015; vol 52 (4) 339-347.
22. Fraser IS, Langhan S, Uhl- Hochgraeber K. Health-related quality of life and economic burden of abnormal uterine bleeding. Expert Rev Obstet Gynecol 2009; 4 (2):179-189.
23. Ioannou GN, Rockey DC, Bzyson C, Weis NS. Iron deficiency and gastrointestinal malignancy: a population based cohort study. Am J Med 2002. 113(4):276-280.
24. Joosten E, Ghesquiere B, Lindhoudt, et al. Górny i dolny przewód pokarmowy ocena starszych impatiens, którzy są z niedoborem żelaza. Am J Med 1999: 107: 24.
.
