15.4 Właściwości fizyczne kwasów karboksylowych
Cele nauczania
- Porównać temperatury wrzenia kwasów karboksylowych z alkoholami o podobnej masie molowej.
- Porównaj rozpuszczalność kwasów karboksylowych w wodzie z rozpuszczalnością porównywalnych alkanów i alkoholi w wodzie.
Wiele kwasów karboksylowych jest bezbarwnymi cieczami o nieprzyjemnym zapachu. Wszystkie kwasy karboksylowe o 5-10 atomach węgla mają „kozi” zapach (wyjaśniający zapach sera Limburger). Kwasy te powstają również w wyniku działania bakterii skórnych na ludzkie sebum (oleje skórne), co tłumaczy nieprzyjemny zapach słabo wentylowanych szatni. Kwasy z więcej niż 10 atomów węgla są woskowate ciała stałe, a ich zapach zmniejsza się wraz ze wzrostem masy molowej i wynikającej z tego zmniejszającej się lotności.
Kwasy karboksylowe wykazują silne wiązanie wodorowe między cząsteczkami. Dlatego mają wysokie temperatury wrzenia w porównaniu z innymi substancjami o porównywalnej masie molowej.
Grupa karboksylowa łatwo angażuje się w wiązanie wodorowe z cząsteczkami wody (rysunek 15.3 „Wiązanie wodorowe między cząsteczką kwasu octowego a cząsteczkami wody”). Kwasy o liczbie atomów węgla od jednego do czterech są całkowicie mieszalne z wodą. Rozpuszczalność maleje wraz ze wzrostem długości łańcucha węglowego, ponieważ siły dipolowe stają się mniej ważne, a bardziej dominują siły dyspersyjne. Kwas heksanowy jest słabo rozpuszczalny w wodzie (około 1,0 g/100 g wody). Kwas palmitynowy, z jego dużym niepolarnym składnikiem węglowodorowym, jest zasadniczo nierozpuszczalny w wodzie. Kwasy karboksylowe są na ogół rozpuszczalne w takich rozpuszczalnikach organicznych, jak etanol, toluen i eter dietylowy.
Rysunek 15.3 Wiązanie wodorowe między cząsteczką kwasu octowego a cząsteczkami wody
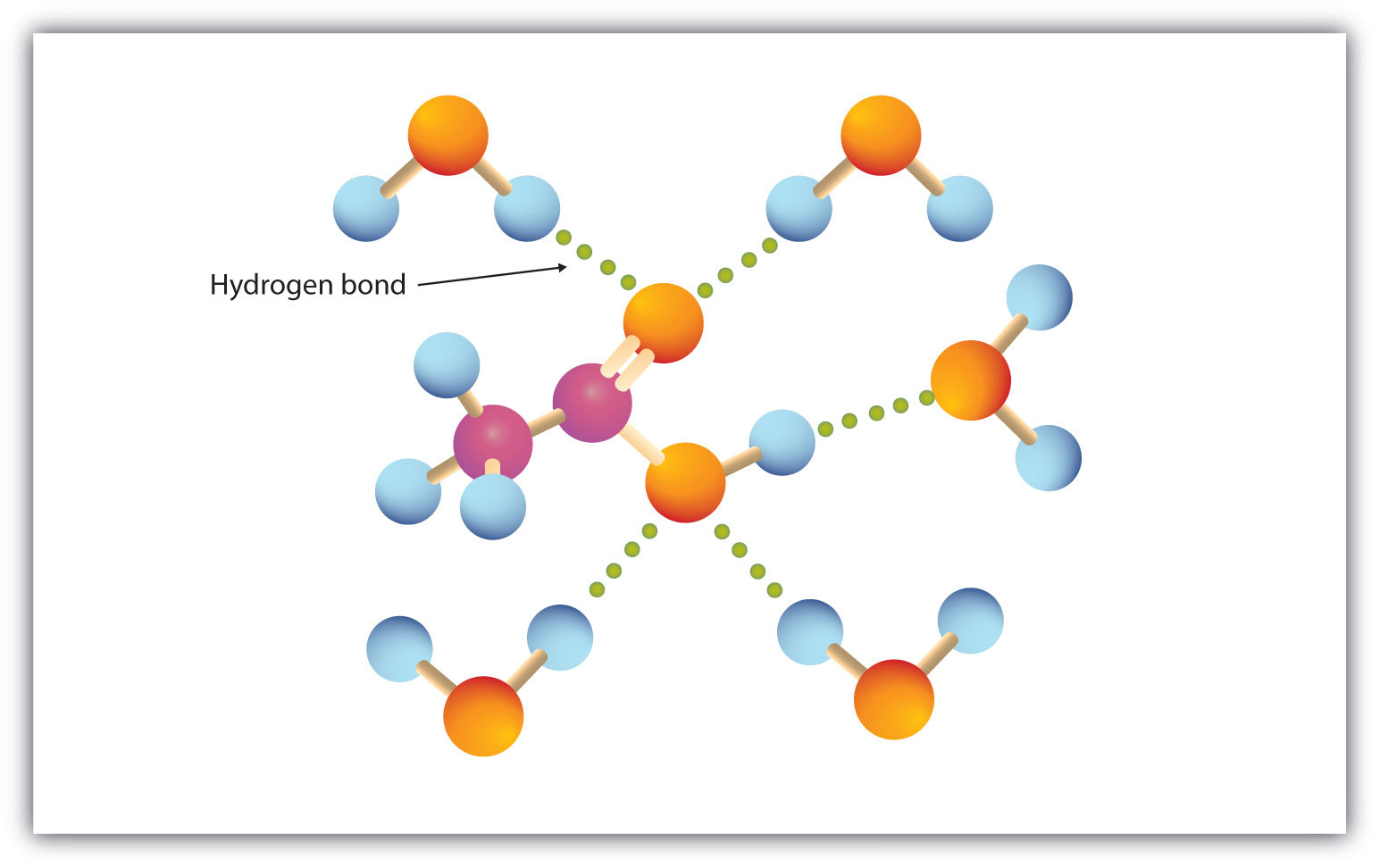
Kwasy karboksylowe o małej masie molowej są dość dobrze rozpuszczalne w wodzie.
Tabela 15.2 „Stałe fizyczne kwasów karboksylowych” zawiera wykaz niektórych właściwości fizycznych wybranych kwasów karboksylowych. Pierwsze sześć z nich to kwasy homologiczne. Zauważ, że punkty wrzenia wzrastają wraz ze wzrostem masy molowej, ale punkty topnienia nie wykazują regularnego wzorca.
Tabela 15.
.
.
.
.
Ćwiczenia sprawdzające pojęcia
-
Który związek ma wyższą temperaturę wrzenia – kwas butanowy (masa molowa 88) czy 2-pentanon (masa molowa 86)? Explain.
-
Would you expect butyric acid (kwas butanowy) to be more or less soluble than 1-butanol in water? Explain.
Answers
-
butyric acid because of hydrogen bonding (There is no intermolecular hydrogen bonding in 2-pentanone.)
-
bardziej rozpuszczalny, ponieważ istnieje bardziej rozległe wiązanie wodorowe
Key Takeaways
- Kwasy karboksylowe mają wysokie temperatury wrzenia w porównaniu do innych substancji o porównywalnej masie molowej. Punkty wrzenia wzrastają wraz z masą molową.
- Kwasy karboksylowe mające od jednego do czterech atomów węgla są całkowicie mieszalne z wodą. Rozpuszczalność maleje wraz z masą molową.
Ćwiczenia
-
Który związek ma wyższą temperaturę wrzenia-CH3CH2CH2OCH2CH3 czy CH3CH2CH2COOH? Wyjaśnij.
-
Który związek ma wyższą temperaturę wrzenia-CH3CH2CH2CH2CH2OH czy CH3CH2CH2COOH? Wyjaśnij.
-
Który związek jest bardziej rozpuszczalny w wodzie-CH3COOH czy CH3CH2CH2CH3? Wyjaśnij.
-
Który związek jest bardziej rozpuszczalny w wodzie-CH3CH2COOH czy CH3CH2CH2CH2COOH? Wyjaśnij.
Odpowiedzi
-
CH3CH2CH2COOH z powodu wiązania wodorowego (Nie ma międzycząsteczkowego wiązania wodorowego z CH3CH2CH2OCH2CH3.)
-
CH3COOH ponieważ angażuje się w wiązanie wodorowe z wodą (Nie ma międzycząsteczkowego wiązania wodorowego z CH3CH2CH2CH3.)
.
