- Roczny raport na temat rogówki
- Co to jest CXL i jak działa?
- Jaka jest rola ryboflawiny podczas CXL?
- Jaki jest cel usuwania nabłonka w standardowym protokole CXL?
- Jak jest wykonywany standardowy protokół CXL?
- Jakie są zalecenia dotyczące wyboru pacjenta?
- Czy progresja KCN jest konieczna, aby zalecić CXL?
- Czy powinienem rozważyć CXL u pacjentów powyżej 40 roku życia?
- Jakie są ogólne wyniki i oczekiwania pooperacyjne CXL?
- Czy pacjenci CXL mogą spodziewać się jakichkolwiek zmian refrakcyjnych?
- Czy zamglenie CXL stanowi problem?
- Czy można wykonać CXL bez usuwania nabłonka?
- 12. Kiedy należy ponownie założyć soczewki kontaktowe po CXL?
Roczny raport na temat rogówki
Przejdź do poniższych linków, aby przeczytać inne artykuły z naszego rocznego raportu na temat rogówki:
Przewodnik lekarza rodzinnego po opcjach przeszczepu rogówki
Poprawianie dziury: How to Heal Persistent Epithelial Defects
Intruder Alert: Diagnosing Corneal Infiltrative Disease
Dla wielu okulistów i pacjentów, leczenie keratoconusa (KCN) może wydawać się utrzymywaniem niepożądanego status quo. Dzięki postępom w technologii specjalistycznych soczewek kontaktowych przeszczep rogówki jest obecnie konieczny jedynie u 10% do 20% pacjentów z KCN.1 Mimo to, pacjenci ci nadal uzyskują podobne wyniki jak pacjenci z zaawansowanym zwyrodnieniem plamki żółtej w kwestionariuszu funkcji wzrokowych Narodowego Instytutu Oka w badaniu CLEK (Collaborative Longitudinal Evaluation of Keratoconus Study).2-5 W innym raporcie tej samej grupy stwierdzono, że samoocena jakości życia pacjentów z KCN z czasem ulega dalszemu pogorszeniu.6 Przy postulowanej częstości występowania KCN sięgającej jednej na 375 osób, stabilizacja choroby i poprawa lub utrzymanie jakości życia są priorytetami.7
Od czasu opracowania w 2003 roku, sieciowanie rogówki (CXL) szybko stało się leczeniem z wyboru dla kontroli progresji KCN.8 Chociaż CXL uzyskało aprobatę amerykańskiej Agencji Żywności i Leków (FDA) dopiero w 2016 roku (system KXL firmy Avedro oraz dwa fotoulepszacze, Photrexa i Photrexa viscous), w Wills Eye Hospital od wielu lat możemy oferować pacjentom zabiegi CXL pod auspicjami badań klinicznych. Jak w przypadku każdej nowej procedury leczenia, istnieje krzywa uczenia się dla klinicystów, aby udoskonalić edukację pacjenta i proces selekcji, jak również inne protokoły związane z zarządzaniem okołooperacyjnym. Otwarty kanał komunikacji pozwala naszemu Corneal Service pomóc lekarzom współpracującym w uzyskaniu komfortu klinicznego z CXL w ich praktykach KCN. Poniżej znajduje się 12 najczęstszych pytań zadawanych przez naszych lekarzy; odpowiedzi na nie mogą pomóc w podjęciu decyzji, jak najlepiej edukować pacjentów KCN na temat CXL.
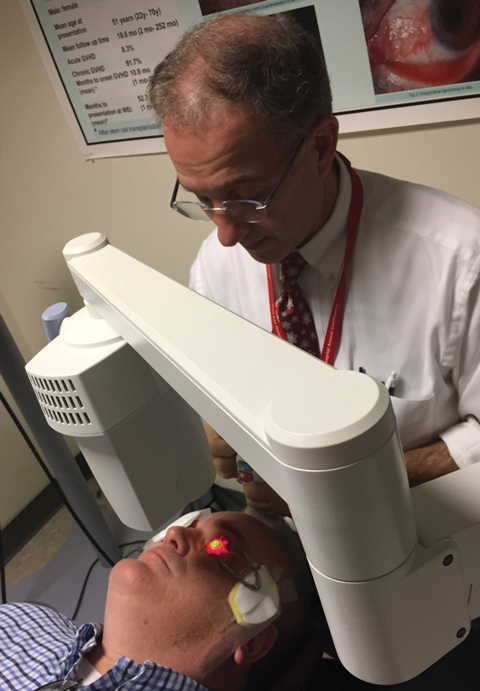
Fig. 1. Christopher Rapuano, MD, wykonuje standardowy protokół sieciowania rogówki za pomocą zatwierdzonego przez FDA systemu KXL.
Co to jest CXL i jak działa?
Sieciowanie jest procesem polimeryzacji, który powoduje rearanżację monomerów w trójwymiarową sieć polimerów w celu zwiększenia solidności struktury molekularnej. Proces ten naturalnie zachodzi w naszym organizmie, ponieważ tkanki łączne z czasem stopniowo sztywnieją. Ułatwiony przez endogenny enzym oksydazę lizylową w uruchomieniu wymaganych reakcji oksydacyjnych, dodatkowe wiązania kowalencyjne (lub tkankowe „wiązania krzyżowe”) są tworzone pomiędzy i wewnątrz włókien kolagenowych – dając zwiększoną wytrzymałość biomechaniczną tkanki.9
Typowo, skumulowane efekty naturalnych reakcji sieciowania są powolne do zamanifestowania. Pod koniec lat 90-tych badacze z Uniwersytetu Drezdeńskiego w Niemczech ustalili, że proces indukcji fotochemicznej jest najbardziej opłacalną klinicznie metodą zwiększenia indukcji wiązań krzyżowych w rogówce, co doprowadziło do powstania CXL.8 W badaniu tym wykorzystano 0,1% ryboflawinę (z 20% dekstranem w roztworze) jako fotouczulacz absorbujący starannie skalibrowaną dawkę energii ultrafioletowej (UV), przekształcając w ten sposób dostępny tlen tkankowy w cząsteczki tlenu singletowego. Powstałe reaktywne formy tlenu posiadają wystarczającą energię do aktywacji szlaku enzymatycznego oksydazy lizylowej, co prowadzi do tworzenia nowych wiązań kowalencyjnych w zrębie rogówki.
Badania z Drezna donoszą, że wszystkie z 23 leczonych oczu z progresywnym KCN zostały ustabilizowane, a 70% wykazało maksymalne spłaszczenie keratometrii o 2,01D. Od tego czasu w wielu badaniach osiągnięto podobną skuteczność z dobrym profilem bezpieczeństwa u pacjentów z KCN, stosując ten sam protokół CXL obejmujący usunięcie nabłonka (ryc. 1).10-13
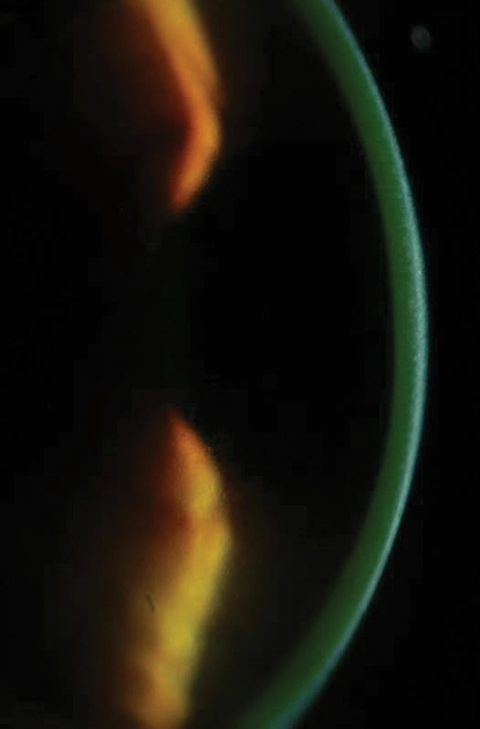
Ryc. 2a i 2b. Powyżej, nasycenie ryboflawiną widoczne w zrębie rogówki po obciążeniu ryboflawiną. Poniżej, po 30 minutach ładowania ryboflawiny w dwuminutowych odstępach, klinicyści muszą sprawdzić czy ryboflawina jest zabarwiona w wodzie. Kliknij dolny obraz, aby powiększyć.
Jaka jest rola ryboflawiny podczas CXL?
Ponieważ biodostępne cząsteczki tlenu w rogówce nie mogą być aktywowane bezpośrednio przez światło UV, substancja fotouczulająca musi działać jako czynnik pośredni. Ryboflawina katalizuje reakcje fotochemiczne CXL poprzez przenoszenie energii UV (konkretnie UVA od 365nm do 370nm) na cząsteczki tlenu w zrębie, przekształcając w ten sposób stabilne cząsteczki tlenu w bardziej reaktywną formę singletową. Te reaktywne formy tlenu inicjują następnie wewnątrzzrazikowe reakcje oksydacyjne.
Zakładając, że energia UV nie jest zasobem ograniczającym, ciągłe uzupełnianie tlenu i aktywne cząsteczki ryboflawiny są niezbędne w utrzymaniu transferu energii wymaganego do utrwalenia procesu CXL.
Dodatkowo, nasycenie rogówki ryboflawiną tworzy „efekt ekranowania”, w którym odpowiednie poziomy energii UV docierające do śródbłonka, soczewki i siatkówki są miareczkowane do znacznie niższej intensywności niż rzeczywiste progi uszkodzeń komórkowych. W rzeczywistości, jeśli rogówka nasycona ryboflawiną ma grubość co najmniej 400µm, natężenie promieniowania UV przekazywanego do śródbłonka wynosi tylko 0,18mW/cm2, podczas gdy rzeczywisty próg uszkodzenia śródbłonka wynosi około 0,35mW/cm2. Następnie, poziom energii przewidywany do osiągnięcia przez soczewkę krystaliczną i siatkówkę jest jeszcze niższy w porównaniu z odpowiednimi progami uszkodzenia tych warstw tkankowych.14,15
Jaki jest cel usuwania nabłonka w standardowym protokole CXL?
Lipofilowa natura nabłonka rogówki i mały rozmiar porów jego ścisłych połączeń sprawiają, że warstwa ta jest zasadniczo nieprzepuszczalna dla cząsteczek ryboflawiny. Te cechy bariery nabłonkowej uniemożliwiają skuteczne i jednorodne wysycenie ryboflawiną docelowej tkanki zrębu.16
Nabłonek zawiera również enzymy o wysokich właściwościach antyoksydacyjnych, takie jak askorbinian i reszty tryptofanowe, które mogą zapobiegać przenikaniu promieniowania UV i wymiatać reaktywne formy tlenu. Co więcej, obecność bariery nabłonkowej spowalnia tempo uzupełniania tlenu podczas zabiegów CXL, zmniejszając tym samym całkowitą ilość nowych wiązań krzyżowych, które mogą zostać utworzone przez komórki. W konsekwencji, gdy ten sam standardowy protokół CXL przeprowadzany jest przy nienaruszonej powierzchni rogówki, ogólna skuteczność zabiegu będzie niższa niż oczekiwana. Z drugiej strony, z powodu niehomogennego nasycenia ryboflawiną i zmniejszonego efektu ekranowania ryboflawiną, transmisja UV dostarczana do śródbłonka i głębiej położonych tkanek oka może być wyższa niż wcześniej obliczono.16,17
Klinicyści nie powinni zakładać, że CXL jest skuteczna tylko wtedy, gdy towarzyszy jej debridement nabłonka. Chociaż zastosowania przezbłonkowego CXL (TE-CXL) nie są obecnie zatwierdzone przez FDA, trwają badania nad zmodyfikowanymi technikami leczenia w celu zwiększenia skuteczności TE-CXL.
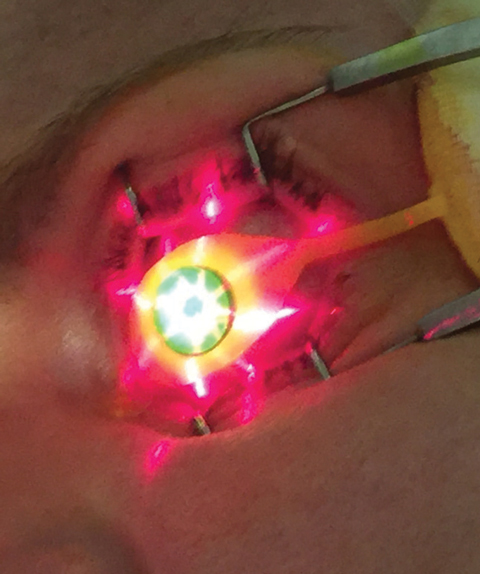
Fig. 3. Naprowadzanie krzyża z urządzenia KXL na miejsce zabiegu.
Jak jest wykonywany standardowy protokół CXL?
Znieczulenie miejscowe jest stosowane podczas usuwania środkowych 9 mm nabłonka w celu zapewnienia komfortu pacjenta i umożliwienia szybszego, bardziej jednorodnego nasycenia zrębu preparatem Photrexa viscous (5′-fosforan ryboflawiny w 20% roztworze dekstranu) podczas CXL. Ta faza trwa 30 minut z podawaniem ryboflawiny w dwuminutowych odstępach.10
Po 30 minutach pacjenci są badani pod lampą szczelinową, aby upewnić się, że ryboflawina nasyciła zamierzony obszar leczenia i że jest obecna w cieczy wodnistej (ryc. 2a i 2b). Zgodnie ze wskazaniami zatwierdzonymi przez FDA, klinicyści muszą wykonać pachymetrię po aplikacji ryboflawiny, aby upewnić się, że grubość rogówki wynosi co najmniej 400µm. Jeśli jest ona mniejsza niż 400µm, należy podawać hipotoniczny ryboflawinę Photrexa co 5-10 sekund, aż rogówka nawodni się do grubości 400µm lub większej.10
Po zweryfikowaniu odpowiedniego poziomu pachymetrii, klinicyści używają urządzenia KXL UV (Avedro) do drugiej fazy leczenia CXL, gdzie 30 minut promieniowania UV (3mW/cm2) daje całkowitą dawkę energii 5,4J/cm2.8 Podczas okresu emisji UV, Photrexa viscous jest podawany w dwuminutowych odstępach, podczas gdy operator utrzymuje właściwą centrację i odległość urządzenie-oko. Prawidłowa pozycja urządzenia KXL może być określona na podstawie projekcji obrazu krzyża (rysunek 3), które pomagają w dostarczeniu optymalnego profilu wiązki oświetleniowej do leczonej rogówki.
Nadmiar ryboflawiny można spłukać zrównoważonym roztworem soli na koniec sesji leczenia. Po wprowadzeniu miejscowych antybiotyków i kortykosteroidów zakładana jest opaskowa soczewka kontaktowa (BCL). BCL powinna być utrzymywana na leczonym oku przez trzy do pięciu dni lub do czasu zamknięcia nabłonka (ryc. 4a i 4b).
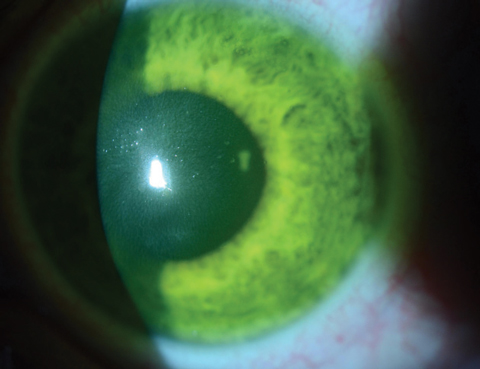
Ryc. 4a. Tutaj, bandażowa miękka soczewka kontaktowa znajduje się na oku bezpośrednio po zabiegu CXL u pacjenta, u którego nasycenie rogówki ryboflawiną jest jeszcze widoczne.
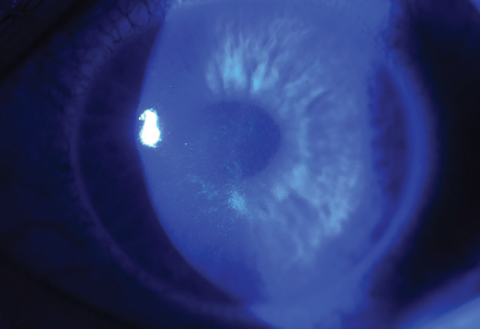
Fig. 4b. Nabłonkowe zamknięcie rany jest w większości całkowite u tego samego pacjenta zaledwie trzy dni po leczeniu metodą CXL.
Jakie są zalecenia dotyczące wyboru pacjenta?
W 2016 roku standardowy protokół CXL otrzymał oznakowane wskazania w Stanach Zjednoczonych do leczenia pacjentów w wieku 14 lat lub starszych z postępującą KCN lub ektazją rogówki po operacjach refrakcyjnych. Jednak wiadomo, że u młodszych pacjentów, gdy choroba pozostaje nieleczona, jej nasilenie i tempo progresji są bardziej agresywne. Dlatego też system KXL oraz Photrexa/Photrexa viscous mogą być rozważane do stosowania off-label u młodszych pacjentów z minimalną grubością rogówki 400µm lub większą. W badaniach klinicznych opisywano pacjentów z KCN w wieku zaledwie ośmiu lat, ale w takich przypadkach należy uzyskać specjalne świadome zgody od pacjentów i ich opiekunów.18
Chociaż FDA nie określiła żadnych przeciwwskazań, klinicyści powinni zachować zdrowy rozsądek, zanim zaproponują CXL matkom karmiącym i pacjentom w wieku powyżej 65 lat. Ponadto, badacze zdecydowanie zalecają unikanie CXL w trakcie ciąży. W jednym z ostatnich badań wykazano topograficzne, pachymetryczne i biomechaniczne dowody progresji KCN u 100% ciężarnych pacjentek.19 Skłoniło to badaczy do zalecenia omówienia profilaktycznego CXL z pacjentkami przed planowaniem rodziny. Niektóre kraje europejskie zaczęły proaktywnie oferować CXL pacjentkom z KCN, które planują ciążę pomimo braku progresji choroby.20
Czy progresja KCN jest konieczna, aby zalecić CXL?
Chociaż progresja KCN jest częścią wskazań on-label do leczenia CXL, pewne okoliczności nie wymagają progresji przed konsultacją CXL. Pacjentki z KCN, które planują ciążę oraz pacjenci z wysokim ryzykiem progresji to tylko dwa potencjalne przykłady kliniczne.19,21
Zgodnie z konwencjonalnym modelem opieki nad KCN, pewna ilość znaczących zmian w parametrach klinicznych musi ujawnić się przed rozpoczęciem nowego kursu leczenia. Jednak znaczna progresja często występuje przed podjęciem działań z powodu braku konsensusu co do dokładnego wskaźnika klinicznego i odpowiadającej mu wielkości zmiany, która stanowi progresję choroby. Wiele badań CXL definiuje progresję KCN jako zmiany w okresie 12 miesięcy w którymkolwiek z następujących pomiarów: 1D lub więcej w maksymalnej keratometrii; 0,5D lub więcej w krótkowzroczności; 1D lub więcej w astygmatyzmie; lub 10µm lub więcej utraty w najcieńszym punkcie pachymetrycznym.10-12,20,22 Jednakże, przy ograniczonej dokładności tradycyjnych topografów podczas obrazowania nieregularnej powierzchni rogówki i zmienności refrakcji u pacjentów z KCN, wytyczne te mogą skutkować wyższym odsetkiem wyników fałszywie dodatnich.
Alternatywnie, jeden z zespołów ekspertów zalecił ostatnio, aby obecność co najmniej dwóch z trzech kryteriów mogła ustalić progresję: stromość przedniej krzywizny rogówki; stromość tylnej krzywizny rogówki; lub ścieńczenie przy porównywaniu pachymetrycznego profilu dystrybucji od peryferii do najcieńszego punktu.21 Chociaż użyteczne, wytyczne te wymagają dostępu do tomografii rogówki zdolnej do śledzenia zmian w czasie, co stanowi potencjalne wyzwanie dla niektórych klinicystów zajmujących się współzależnością.
Czy powinienem rozważyć CXL u pacjentów powyżej 40 roku życia?
Krótka odpowiedź brzmi tak. Pacjenci z KCN mają tendencję do wykazywania wolniejszego tempa progresji lub nawet stabilizacji w czwartej lub piątej dekadzie życia – prawdopodobnie jest to produkt uboczny sieciowania związanego z wiekiem. Jednakże ekspresja KCN jest bardzo zmienna, a sam wiek nie zawsze jest dobrze zdefiniowanym punktem końcowym dla KCN. Retrospektywny przegląd kart z Wills Eye Hospital wykazał, że 24% z 186 oczu, w których nowo zdiagnozowano KCN, należało do pacjentów w wieku 40 lat lub starszych.23
W dodatku, biorąc pod uwagę, że ektazja pooperacyjna może wystąpić w późniejszym okresie życia niż u typowego pacjenta z KCN, konsensus kliniczny nie określił przedziału wiekowego, w którym ektazja zwykle występuje i kiedy progresja może ulec spowolnieniu. W związku z tym klinicyści powinni powstrzymać się od stosowania wieku jako bezwzględnego przeciwwskazania dla kandydatury do CXL.
Jakie są ogólne wyniki i oczekiwania pooperacyjne CXL?
Wstępna faza rekonwalescencji po standardowym CXL jest podobna do każdej procedury związanej z usunięciem nabłonka rogówki. Chociaż BCL zapewniają ochronę terapeutyczną i zwiększony komfort pacjenta, większość pacjentów nadal odczuwa pewien dyskomfort lub ból oczny do czasu zamknięcia ubytku nabłonka, co zwykle następuje w ciągu trzech do pięciu dni.24
Po zamknięciu nabłonka ostrość wzroku generalnie pogarsza się lub ulega znacznym wahaniom przez pierwszy miesiąc, po czym powoli wraca do poziomu wyjściowego w trzecim miesiącu. Pacjenci mogą doświadczać łagodnej poprawy widzenia między trzecim a szóstym miesiącem lub między szóstym a dwunastym miesiącem. Dodatkowo, tendencja stabilizacyjna pojawia się zazwyczaj jako nowa linia podstawowa pomiędzy miesiącem szóstym a dwunastym.10-12
Po standardowej CXL, pomiary keratometrii, pachymetrii i przemijającego zamglenia CXL również przebiegają według podobnego wzorca czasowego, z dalszym stromieniem, ścieńczeniem i zmniejszeniem przejrzystości rogówki w pierwszym miesiącu. Trendy te zwykle odwracają się w ciągu kolejnych dwóch miesięcy, po czym pacjenci powoli wracają do charakterystyki wyjściowej. Czasami pacjenci ci doświadczają nawet łagodnej poprawy przed osiągnięciem plateau stabilizacji (Ryc. 5).10-12
Ważne jest, aby powstrzymać się od błędnego interpretowania tych natychmiastowych tendencji pooperacyjnych jako pogorszenia choroby KCN lub niepowodzenia CXL. Ogólnie rzecz biorąc, pomimo protokołu epi-off CXL, podczas bezpośredniego okresu pooperacyjnego istnieje tylko krótki okres, w którym pacjenci mogą odczuwać pogorszenie wzroku. Dzieje się tak, ponieważ pacjenci są ponownie wyposażani w soczewki kontaktowe lub mogą wznowić noszenie soczewek kontaktowych zanim osiągną stabilizację po CXL.
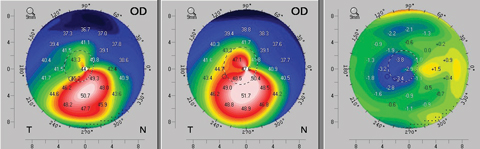
Ryc. 5. Przykład topograficznego spłaszczenia widocznego już po trzech miesiącach od standardowego (epi-off) protokołu crosslinking rogówki. Lewa mapa przedstawia przedoperacyjną topografię osiową pacjenta. Środkowa mapa to topografia pooperacyjna w trzecim miesiącu, a prawa mapa przedstawia kalkulację różnic ujawniającą poprawę topograficzną w trzecim miesiącu. Kliknij obraz aby powiększyć.
Czy pacjenci CXL mogą spodziewać się jakichkolwiek zmian refrakcyjnych?
Badania wykazały zmienne wyniki dla sfery, cylindra i ekwiwalentu sferycznego w 12 miesiącu po leczeniu CXL. Niektóre z nich wykazały istotne statystycznie zmiany refrakcji, podczas gdy inne nie odnotowały znaczących różnic.25-27 Badacze odnotowali poprawę całkowitej aberracji wyższego rzędu, aberracji sferycznej i komy, jak również średnie topograficzne spłaszczenie o 1,6D.10,28 Mimo to, literatura nie dostarcza spójnych korelacji pomiędzy zmianami w tych parametrach klinicznych a leczeniem CXL.
W związku z tym, stabilizacja KCN powinna pozostać głównym celem obecnie dostępnych protokołów CXL. Przed zaleceniem CXL pacjenci powinni być poinformowani, że soczewki kontaktowe lub okulary będą nadal wymagane po CXL, a takie podejście do zarządzania może poprawić jakość życia pacjentów poprzez zmniejszenie frustracji często związanej z częstymi zmianami optycznymi, gdy KCN jest pozostawiony bez leczenia.
Czy zamglenie CXL stanowi problem?
Przemijające zamglenie CXL może wyglądać podobnie do zamglenia rogówki po PRK. Jednak dzięki doświadczeniu klinicyści są w stanie rozróżnić te dwie jednostki pod lampą szczelinową. Zamglenie CXL tworzy pyłopodobną zmianę tkanki w przednich i środkowych warstwach zrębu, podczas gdy zamglenie po PRK objawia się jako siateczkowaty wzór proliferacji włóknistej, który jest zlokalizowany w podnabłonkowych i przednich warstwach zrębu. Biorąc pod uwagę odmienny wygląd anatomiczny i samorozwiązujący się charakter zamglenia CXL, jest mało prawdopodobne, aby miało ono takie same implikacje wizualne jak zamglenie PRK.24
Natychmiast po leczeniu CXL, mikroskopia konfokalna ujawni apoptozę keratocytów i obrzęk lakunarny w obszarze przedniego i środkowego zrębu. Ponieważ obszary zamglenia CXL i obrzęku zrębu zaczynają wykazywać poprawę pod koniec pierwszego miesiąca, klinicyści zobaczą strefy optycznej nieciągłości – lub linie demarkacyjne – z przekrojem optycznym podczas badania lampą szczelinową (Rycina 6).24
Chociaż upośledzenie olśnienia jest możliwe w ciągu pierwszych sześciu do ośmiu tygodni, przejściowe zamglenie CXL i głębokość linii demarkacyjnych są często używane jako wskaźniki odzwierciedlające penetrację leczenia i wynikającą z tego przebudowę kolagenu zrębu. W miarę powolnej repopulacji keratocytów, wsteczne rozpraszanie światła zaczyna ustępować, a obszary zamglenia CXL zaczynają zanikać pomiędzy trzecim a szóstym miesiącem. W rok po zabiegu CXL zamglenie staje się często niezauważalne. Miejscowe steroidy są często odstawiane po pierwszych kilku tygodniach po zabiegu, jednak większość przypadków zamglenia CXL ustępuje samoistnie z czasem bez dalszych interwencji terapeutycznych; dlatego badacze sugerują, że miejscowe steroidy nie łagodzą zamglenia CXL i ich długotrwałe stosowanie nie jest konieczne po standardowym CXL. W jednym z badań zaproponowano jednak, że stosowanie steroidów miejscowych może być uzasadnione, jeśli po roku obserwuje się utrzymujące się zamglenie lub bliznowacenie stromalne.24,29
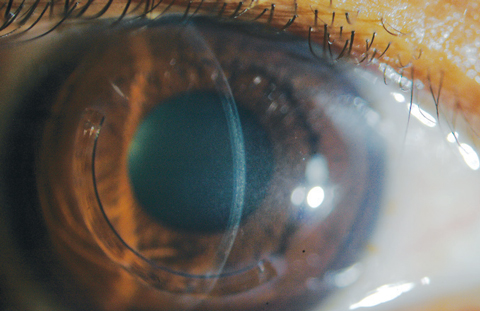
Ryc. 6. Linie demarkacyjne uwidocznione za pomocą przekroju optycznego u pacjenta, u którego zastosowano leczenie off-label CXL i implant rogówki Intacs (AJL Ophthalmic).
Czy można wykonać CXL bez usuwania nabłonka?
Standardowa epi-off CXL jest minimalnie inwazyjna i wysoce skuteczna w zatrzymaniu progresji KCN. Dodatkowo, zdarzenia niepożądane po standardowym CXL są rzadkie.10-13 Jednakże, badacze kontynuują badania nad metodami podawania preparatu, aby zwiększyć komfort podczas i po zabiegu, skrócić czas powrotu wzroku i zmniejszyć ryzyko potencjalnych infekcji.
Utrzymanie nienaruszonego nabłonka zmniejsza szybkość dyfuzji ryboflawiny, światła UV i tlenu, z których wszystkie są niezbędne do reakcji fotochemicznych podczas CXL. Naukowcy byli w stanie ominąć funkcję bariery nabłonkowej poprzez zaburzenie połączeń ścisłych za pomocą chemicznych środków wzmacniających, takich jak chlorek benzalkonium (BAK) i kwas etylenodiaminotetraoctowy (EDTA). Te wzmacniacze rogówki są włączane do roztworu ryboflawiny w celu ułatwienia penetracji do zrębu rogówki. W niektórych badaniach odnotowano płytsze linie demarkacyjne i zmniejszone efekty usztywnienia rogówki po zastosowaniu TE-CXL.30,31
Pomimo że w kilku badaniach odnotowano wyższe wskaźniki regresji przy zastosowaniu TE-CXL, wskaźniki zdarzeń niepożądanych są również niższe niż w przypadku standardowej epi-off CXL. Dodatkowo, mniejsza głębokość zabiegu CXL może być korzystna w przypadku oczu z cieńszą rogówką na początku. Pacjenci z niskim ryzykiem progresji i ci, którzy obawiają się o czas powrotu wzroku, mogą być rozsądnymi kandydatami do TE-CXL.24,30,31
Do czasu poprawy skuteczności TE-CXL będziemy nadal zalecać standardową epi-off CXL dla pacjentów z KCN z wysokim prawdopodobieństwem progresji lub agresywną progresją kliniczną.
12. Kiedy należy ponownie założyć soczewki kontaktowe po CXL?
Badanie z użyciem mikroskopii konfokalnej wykazało, że grubość nabłonka stopniowo powraca do normy pomiędzy trzema a sześcioma miesiącami po standardowej CXL.24 Jednak wielu pacjentów wymaga rehabilitacji soczewkami kontaktowymi, aby funkcjonować i nie może czekać sześciu miesięcy przed wznowieniem noszenia soczewek kontaktowych.
Naszym osobistym podejściem jest przyjęcie strategii dopasowania soczewek, która pozwala na minimalną lub żadną interakcję pomiędzy tylną powierzchnią soczewki a nabłonkiem rogówki, biorąc pod uwagę możliwość utrzymywania się zamglenia przy opóźnionym gojeniu się nabłonka lub zaburzonej przebudowie nabłonka. W osiągnięciu tego celu pomocne mogą być różne konstrukcje soczewek, w tym soczewki z możliwością wysklepienia rogówki, takie jak soczewki hybrydowe, skleralne, piggyback, a nawet niestandardowe soczewki miękkie. Z doświadczenia klinicznego wynika, że idealny czas na ponowne założenie soczewki to około 4-6 tygodni po standardowym zabiegu CXL lub 2 tygodnie po TE-CXL. Rozsądnie jest również podkreślić pacjentom, szczególnie po standardowym CXL, że w ciągu następnych sześciu do 12 miesięcy można spodziewać się częstych modyfikacji refrakcji w ich soczewkach kontaktowych.
Pojawienie się CXL zapoczątkowało nową erę w leczeniu KCN, w której klinicyści nie muszą już przyjmować postawy biernego, reaktywnego postępowania i oferować pacjentom jedynie przymusowy wybór pomiędzy soczewkami kontaktowymi a przeszczepem rogówki. Dzięki wczesnej interwencji CXL u odpowiednich kandydatów i ciągłemu monitorowaniu po CXL, klinicyści mogą pomóc pacjentom utrzymać ich najlepsze funkcje wzrokowe i maksymalnie odroczyć ewentualną potrzebę keratoplastyki. Dzisiejsze podejście kliniczne powinno wykraczać poza zwykłą wymianę soczewek kontaktowych w miarę postępu KCN. Dzięki wczesnemu wykrywaniu KCN, dostępowi do CXL i zaawansowanym projektom soczewek specjalistycznych, klinicyści mogą pomóc swoim pacjentom z KCN żyć pełnią życia.
Dr Chang jest dyrektorem specjalistycznych soczewek rogówkowych w Wills Eye Hospital-Cornea Service oraz dyrektorem usług klinicznych w TLC Vision. Jest członkiem rady doradczej International Keratoconus Academy, Gas Permeable Lens Institute oraz Optometric Cornea, Cataract and Refractive Society.
Dr Rapuano jest szefem Cornea Service w Wills Eye Hospital. Opublikował kilka książek, liczne rozdziały książek i ponad 175 recenzowanych artykułów, w tym jest współautorem podręcznika The Wills Eye Manual.
1. Godefrooij DA, Gans R, Imhof SM, Wisse RP. Nationwide reduction in the number of corneal transplantations for keratoconus following the implementation of cross-linking. Acta Ophthalmol. 2016;94(7):675-8.
2. Davidson AE, Hayes S, Hardcastle AJ, et al. The pathogenesis of keratoconus. Eye (Lond). 2014;28(2):189-95.
3. Tuft SJ, Moodaley LC, Gregory WM, et al. Prognostic factors for the progression of keratoconus. Ophthalmology. 1994;101(3):439-47.
4. Gordon MO, Steger-May K, Szczotka-Flynn L, et al. Baseline factors predictive of incident penetrating keratoplasty in keratoconus. Am J Ophthalmol. 2006;142(6):923-30.
5. Kymes SM, Walline JJ, Zadnik K, Gordon MO. Quality of life in keratoconus. Am J Ophthalmol. 2004;138(4):527-35.
6. Kymes SM, Walline JJ, Zadnik K, et al. Changes in the quality-of-life of people with keratoconus. Am J Ophthalmol. 2008;145(4):611-7.
7. Godefrooij DA, de Wit GA, Uiterwaal CS, et al. Age-specific incidence and prevalence of keratoconus: a nationwide registration study. Am J Ophthalmol. 2017;175:169-72.
8. Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol 2003;135(5):620-7.
9. Schumacher S, Mrochen M, Wernli J, et al. Optimization model for UV-riboflavin corneal cross-linking. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
10. Chang CY, Hersh PS. Corneal collagen cross-linking: a review of 1-year outcomes. Eye Contact Lens. 2014;40(6):345-52.
11. Hersh PS, Stulting RD, Muller D, et al. United States multicenter clinical trial of corneal collagen crosslinking for keratoconus treatment. Ophthalmology. 2017;124(9):1259-70.
12. Hersh PS, Stulting RD, Muller D, et al. US multicenter clinical trial of corneal collagen crosslinking for treatment of corneal ectasia after refractive surgery. Ophthalmology. 2017;124(10):1475-84.
13. Raiskup F, Theuring A, Pillunat LE, Spoerl E. Corneal collagen crosslinking with riboflavin and ultraviolet-a light in progressive keratoconus: ten-year results. J Cataract Refract Surg. 2015;41(1):41-6.
14. Spoerl E, Mrochen M, Sliney D, Trokel S, Seiler T. Safety of UVA-riboflavin cross-linking of the cornea. Cornea. 2007 May;26(4):385-9.
15. Schumacher S, Mrochen M, Wernli J, et al. Optimization model for UV-riboflavin corneal cross-linking. Invest Ophthalmol Vis Sci. 2012;53(2):762-9.
16. Bottós KM, Schor P, Dreyfuss JL, et al. Effect of cornea epithelium on ultraviolet-a and riboflavin absorption. Arq Bras Oftalmol. 2011;74(5):348-51.
17. Richoz O, Hammer A, Tabibian D, et al. The biomechanical effect of corneal collagen cross-Linking (CXL) with riboflavin and UV-A is oxygen dependent. Transl Vis Sci Technol. 2013;2(7):6.
18. Padmanabhan P, Rachapalle Reddi S, Rajagopal R, et al. Corneal collagen cross-linking for keratoconus in pediatric patients-long-term results. Cornea. 2017;36(2):138-43.
19. Naderan M, Jahanrad A. Topographic, tomographic and biomechanical corneal changes during pregnancy in patients with keratoconus: a cohort study. Acta Ophthalmol. 2017;95(4):e291-e296.
20. Sandvik GF, Thorsrud A, Råen M, et al. Does corneal collagen cross-linking reduce the need for keratoplasties in patients with keratoconus? Cornea. 2015;34(9):991-5.
21. Gomes JA, Tan D, Rapuano CJ, et al. Global consensus on keratoconus and ectatic diseases. Cornea. 2015;34(4):359-69.
22. Nordström M, Schiller M, Fredriksson A, Behndig A. Refractive improvements and safety with topography-guided corneal crosslinking for keratoconus: 1-year results. Br J Ophthalmol. 2017;101(7):920-5.
23. Yildiz EH, Diehl GF, Cohen EJ, et al. Demographics of patients older than 50 years with keratoconus. Eye Contact Lens. 2009;35(6):309-11.
24. Mazzotta C, Hafezi F, Kymionis G, et al. In vivo confocal microscopy after corneal collagen crosslinking. Ocul Surf. 2015;13(4):298-314.
25. Cınar Y, Kürs¸at Cingü A, Turkcu FM, et al. Accelerated corneal collagen cross-linking for progressive keratoconus. Cutan Ocul Toxicol. 2014;33:168-71.
26. Kanellopoulos AJ. Long-term results of a prospective randomized bilateral eye comparison trial of higher fluence, shorter duration ultraviolet a radiation, and riboflavin collagen cross-linking for progressive keratoconus. Clin Ophthalmol. 2012;6:97-101.
27. Cummings AB, McQuaid R, Naughton S, et al. Optimizing corneal cross-linking in the treatment of keratoconus: a comparison of outcomes after standard- and high-intensity protocols. Cornea. 2016;35(6):814-22.
28. Vinciguerra P, Albè E, Trazza S, et al. Analiza refrakcyjna, topograficzna, tomograficzna i aberrometryczna oczu keratokonicznych poddanych zabiegowi corneal cross-linking. Ophthalmology. 2009;116(3):369-78.
29. Kim BZ, Jordan CA, McGhee CN, Patel DV. Natural history of corneal haze after corneal collagen crosslinking in keratoconus using Scheimpflug analysis. J Cataract Refract Surg. 2016;42(7):1053-9.
30. Wollensak G, Iomdina E. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement. J Cataract Refract Surg. 2009;35(3):540-6.
31. Caporossi A, Mazzotta C, Paradiso AL, et al. Transepithelial corneal collagen crosslinking for progressive keratoconus: 24-month clinical results. J Cataract Refract Surg. 2013;39(8):1157-63.
.
