 |
|
Reakcje kwasowo-zasadowe są wszechobecne. W roztworach wodnych kwasy zwiększają stężenie jonów wodorowych (H+). Z drugiej strony zasady zwiększają stężenie jonów wodorotlenkowych (OH-). Kiedy kwas i zasada reagują w roztworze wodnym, jony H+ i OH- łączą się, tworząc wodę. Jony te w ten sposób „neutralizują” się wzajemnie:
Większość kwasów ma ogólny wzór HA, gdzie A- jest anionem, a większość zasad ma postać BOH, gdzie B+ jest odpowiednim kationem. Kwasy i zasady można podzielić na dwa ogólne rodzaje: mocne i słabe kwasy i zasady. Różnica pomiędzy nimi jest prosta: mocny kwas w roztworze wodnym rozkłada się w 100% na proton (H+) i anion (A-)
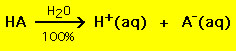
Z drugiej strony większość słabych kwasów rozkłada się znacznie mniej niż 100% w roztworze wodnym:
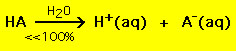 .
.Innymi słowy większość cząsteczek słabych kwasów pozostaje nienaruszona w wodzie. Podobne równania chemiczne obowiązują dla mocnych i słabych zasad.
Istnieje tylko kilka słabych kwasów i zasad, są to:
H2SO4 (kwas siarkowy)
NaOH (wodorotlenek sodu)
KOH (wodorotlenek potasu)
Ca(OH)2 (wodorotlenek wapnia)
Wszystkie inne kwasy i zasady są słabe. Słaby kwas powstaje w wyniku działania dowolnego anionu. Przykłady są podane poniżej
| |
|
|
F- (fluorek) Br- (bromek) I- (jodek) HCO3-. (wodorowęglan) C2H3O2- (octan) MnO4- (nadmanganian) PO4-3 (fosforan) CrO4-2 (chromian) CN- (cyjanek) NO2- (azotyn) SO3- H2CO3 (kwas węglowy) HC2H3O2 (kwas octowy) HMnO4 (kwas nadmanganowy) H3PO4 (kwas H2CrO4 (kwas chromowy) HCN (kwas cyjanowodorowy) HNO2 (kwas azotawy) H2SO3 (kwas siarkowy) |
W typowej reakcji kwasu z zasadą kwas i zasada reagują tworząc sól i wodę np.g., kwas cyjanowodorowy i wodorotlenek sodu:
