Wprowadzenie cykliny
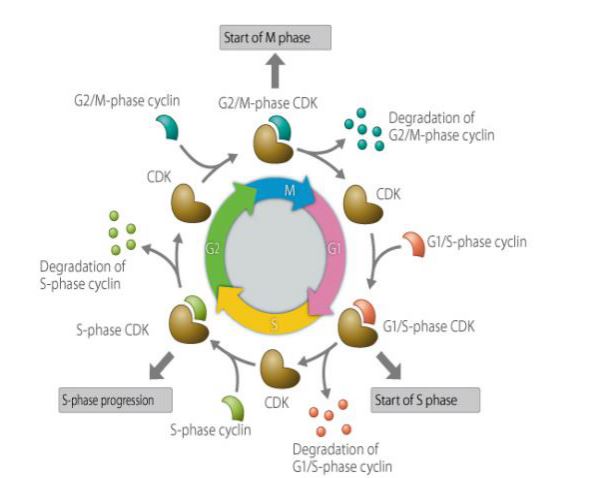
Cyklina jest rodzajem białka, które ulega ekspresji, gromadzi się i rozkłada w cyklu komórkowym, i współdziała z kinazami zależnymi od cykliny, aby wpływać na funkcję cyklu komórkowego. Cyklina ma udział w cyklu komórkowym-regulowane białka, a jego stężenie jest cykliczny i cykliczny w cyklu komórkowym. W zależności od fazy cyklu komórkowego, czasami stężenie jest tak wysokie, jak kilka tysięcy razy, a czasami spada do zera. Jako podjednostka regulatorowa, cyklina wiąże się z kinazami białkowymi zależnymi od cykliny i aktywuje je. Różne cykliny ulegają ekspresji w różnych okresach cyklu komórkowego. W komórkach ssaków cyklina A zaczyna ulegać ekspresji i stopniowo gromadzić się we wczesnej fazie G1, docierając do złącza G1/S, a jej zawartość osiąga maksimum i utrzymuje się w fazie G2/M. Cyklina B ulega ekspresji od późnej fazy G1 i stopniowo gromadzi się. Osiąga maksimum w późnej fazie G2 i utrzymuje się do połowy fazy M, a następnie ulega szybkiej degradacji. Cyklina D, która jest cykliną fazy G1, ulega ciągłej ekspresji w cyklu komórkowym, natomiast cyklina E zaczyna ulegać ekspresji i stopniowo gromadzić się w późnej fazie M i wczesnej fazie G1, osiągając maksimum w późnej fazie G1, a następnie stopniowo osiągając maksymalną zawartość, maleje aż do późnej fazy G2. Cyklina odgrywa ważną rolę w regulacji cyklu komórkowego. Badanie mechanizmu działania cyklin ma duże znaczenie dla leczenia nowotworów.
Członkowie rodziny cyklin i ich funkcje odpowiednio
Do tej pory ludzkie cykliny zostały wyizolowane i nazwane w sumie w 8 kategoriach, a mianowicie od A do H, i obejmują niektóre podklasy (takie jak cyklina D1, D2, D3), z których F, G, H są najnowszymi odkrywcami. Wszystkie cykliny wykazuj± pewne podobieństwa w sekwencji aminokwasów, służ±c tym samym jako molekularne markery strukturalne cyklin. Ten homologiczny region aminokwasowy w cyklinie to tzw. kaseta cykliny, która jest wysoce konserwowanym regionem sekwencji 100-150 aminokwasów pomiędzy cyklinami różnych organizmów. Ludzka cyklina zawiera również wadliwą kasetę lub region sekwencji aminokwasowej bogaty w reszty proliny, kwasu glutaminowego, kwasu asparaginowego, seryny i treoniny (zwany dalej regionem sekwencji aminokwasowej PEST). Wiązanie cykliny B z kinazą zależną od cykliny p34CDC2 kontroluje wejście i wyjście z mitozy, która jest syntetyzowana od fazy S do fazy G2 /M, stopniowo gromadzi się i wiąże z p34CDC2. W fazie M ulega ona stopniowej degradacji, natomiast wyjście z fazy M zależy od szybkiej degradacji cykliny w późnej fazie podziału, co skutkuje uwolnieniem nieaktywnej podjednostki p34CDC2. W komórkach ludzkich cyklina B gromadzi się w cytoplazmie i przedostaje się do jądra przed zanikiem błony jądrowej. Po aktywacji, cyklina B/CDC fosforyluje grupę białek, w tym laminę, wimentyny i wapń, co odgrywa ważną rolę w koncentracji chromosomów, rozpadzie błony jądrowej, depolimeryzacji filamentów pośrednich i reorganizacji mikrofilamentów. Cyklina B odgrywa również istotn± rolę w przej¶ciu fazowym mitozy, jest klasycznym białkiem cyklu rozszczepienia. Cyklina A odgrywa rolę zarówno w przej¶ciach fazowych G2/M jak i G1/S. Pojawia się przed rozpoczęciem syntezy DNA i stopniowo wzrasta aż do fazy przed podziałami, a w fazie środkowej ulega degradacji. Kiedy indukuje mitozę, różni się od prawdziwej mitotycznej cykliny B pod wieloma względami. Zawartość cykliny C zmienia się w niewielkim stopniu w całym cyklu komórkowym, z niewielkim tylko wzrostem we wczesnym G1. MRNA cykliny C osiąga szczyt w połowie G1 w zsynchronizowanych komórkach HeLa, czyli wcześniej niż cyklina A, która może odgrywać pewną rolę w G1. Cyklina E ma wyraźną okresową ekspresję w cyklu komórkowym, a jej szczyt przypada na przejście faz G1 /S. Pełni ona funkcję kontrolującą wejście komórki w fazę S, co może być czynnikiem limitującym tempo przejścia faz G1 /S. W komórkach ssaków, podobnie jak cyklina A, wiąże się z p33CDK2, kompleksem, który ma aktywność kinazy histonu H1 we wczesnych fazach G1 i S, ale cyklina A i E może oddziaływać z białkiem retinoblastoma w celu oddzielenia kompleksów, co sugeruje, że kompleksy CDK2/cyklina A lub E mogą pośrednio regulować ekspresję genów w fazach G1 i S. Cyklina E może odgrywać rolę w cyklinie D, która odgrywa ważną rolę w inicjacji replikacji DNA, konwersji G1 /S, a jej nadekspresja przyspiesza wejście komórki w fazę S. Cyklina D może kontrolować wczesną fazę G1 procesu, przed lub w tym samym czasie co cyklina E. Cyklina D ma trzy podtypy (D1, D2, D3), a jej ekspresja różni się w zależności od komórki i jest kontrolowana przez różne regiony chromosomalne (D1: 11q13; D2: 12p13; D3: 6p21). Podtypy mogą mieć różne efekty działania. Niezwykłymi cechami cykliny D są: indukowana do ekspresji w odpowiedzi na bodźce zewnętrzne, wykazująca wysoką indukowalność czynnikami wzrostu, działająca jako sensor czynników wzrostu, odgrywająca ważną rolę w łączeniu sygnałów zewnętrznych z wewnętrznym cyklem komórkowym. Rola ta z kolei pozwala wnioskować, że jej niekontrolowana ekspresja sprawia, że cykl komórkowy przestaje być zależny od czynników wzrostu lub staje się mniej zależny i może indukować nowotworzenie. Kompleks cyklina D-CDK jest najlepszym kandydatem na kinazę białkową retinoblastoma (Rb) w fazie G1. Cyklina D wiąże się z N-końcowym regionem białka Rb, fosforyluje Rb w późnej fazie G1, a synteza i aktywacja cykliny D1 prowadzi do inaktywacji fosforylacji Rb i down-regulation cykliny D1, a kompleks D1-CDK4 tworzy ujemne sprzężenie zwrotne w fazie G1, co z kolei wyłącza ekspresję cykliny D1. Cyklina D i Rb odgrywają ważną rolę w proliferacji i różnicowaniu komórek, gdy cyklina D1 jest różna w fazie G1. W ekspresji źródłowej fosforylacja Rb jest wcześniejsza niż normalna; faza G1 jest przyspieszona, a przeciwciało antycyklinowe D1 jest mikroiniekcją do komórek G1 wczesnych do metafazy; większość komórek jest zatrzymana przed fazą S, a brak funkcjonalnego Rb nie może spowodować tego bloku; stwierdza się, że ważną rolą cykliny D1 jest unieczynnienie fosforylacji Rb, indukując w ten sposób wejście w fazę S i replikację DNA. CyklinaF jest najobficiej występującym białkiem cykliny (masa cząsteczkowa 87 kDa), a jej mRNA ulega powszechnej ekspresji w różnych komórkach tkanki ludzkiej, przy czym występują istotne zmiany w cyklu komórkowym. Szczyt znajduje się w fazie G2, podobnie jak cyklina A, i zmniejsza się przed obniżeniem poziomu mRNA cykliny B. Białko cykliny F gromadzi się w fazie międzykomórkowej i ulega zniszczeniu w fazie mitozy. W większości komórek znajduje się w jądrze. Nadekspresja lub mutacja w komórkach ludzkich powoduje brak regionów sekwencji aminokwasowej PEST, co prowadzi do zwiększenia liczby komórek w fazie G2. Cyklina G jest najbardziej podobna do cykliny B z drożdży rozszczepionych, która odgrywa rolę w przemianie G1/S, ale mRNA cykliny G nie ma oczywistej zależności od komórki, ale może być stymulowane przez wzrost komórki. Czynnik ten indukuje i utrzymuje podwyższony poziom. Gen cykliny g zawiera dwa różne miejsca wiążące p53, z których jedno znajduje się przed miejscem inicjacji transkrypcji, co sugeruje, że p53 ma potencjał do efektywnej aktywacji genu cykliny g. Cyklina H, która jest mediatorem downstream p53 przynajmniej w działaniu biologicznym, jest białkiem o masie cząsteczkowej 37 kD znalezionym poprzez izolację i oczyszczanie kinazy aktywującej CDK (CAK).
Funkcja cykliny
Badanie zależności pomiędzy cyklem komórkowym a nowotworami ma znaczenie przewodnie dla badań onkologii klinicznej. Może zapewnić pewne cele dla leczenia klinicznego, takie jak blokowanie cykliny D, lub naśladować działanie inhibitorów cyklu komórkowego w celu zahamowania podziału komórek nowotworowych, a także zapewnić pewne wskaźniki dla diagnostyki klinicznej, diagnostyki różnicowej i prognozy. Michaelet al przeanalizował rearanżację genu bcl-1 i ekspresję białka cykliny D1 w 32 przypadkach chłoniaka z komórek płaszcza, w 17 przypadkach rearanżacji genu bcl-1 i 24 przypadkach cytoplazmatycznej ekspresji cykliny D1, a w 40 przypadkach grupy kontrolnej tylko 9 przypadków chłoniaka z komórek B nie-MCL było pozytywnych. Uważają oni, że cyklina D1 może być wykorzystywana w diagnostyce różnicowej MCL oraz w diagnostyce różnicowej chłoniaków B-komórkowych. Cyklina ulega okresowej ekspresji w cyklu komórkowym, a pewne specyficzne kompleksy cyklina-CDK są wymagane do przejścia przez określony cykl komórkowy, co sugeruje, że cyklina może być wykorzystywana jako wskaźnik stanu proliferacyjnego komórek. Stosunek ekspresji określonej cykliny może przewidywać proporcje komórek w określonej tkance w określonym cyklu komórkowym. Im wyższa złośliwość komórek nowotworowych, tym poważniejsze zaburzenia cyklu komórkowego, dlatego możliwe jest odzwierciedlenie rokowania pacjentów poprzez informacje pokazane w cyklu komórkowym i działanie jako możliwy wskaźnik prognostyczny. Keyomarsi i wsp. wykorzystali 9 przypadków próbek chirurgicznych raka piersi i sąsiednie nienowotworowe tkanki jako badania kontrolne: W 8 przypadkach tkanki nowotworowej cyklina E ulegała nieprawidłowej ekspresji jakościowej i ilościowej, występowały co najmniej 3 różne masy cząsteczkowe. Cyklina E była nadekspresyjna, podczas gdy c-erbB2 jest nadekspresyjna tylko w 3 przypadkach. Wraz ze wzrostem zaawansowania nowotworu istotnie wzrastała zawartość białka cykliny E, podczas gdy poziom antygenu jądrowego komórek proliferujących (PCNA) wzrastał tylko nieznacznie. Strukturę cykliny E obserwowano w 4 spośród najwyższych stopni zaawansowania. Dutta i wsp. użyli przeciwciał przeciwko cyklinie A, B, E do wykrywania 48 parafinowych wycinków raka piersi i stwierdzili, że średni pozytywny indeks cykliny A i B wzrastał istotnie wraz ze wzrostem fazy S (P < 0,05). Cyklina A była dodatnio skorelowana z Ki-67 i z frakcją fazy S (P < 0,05). Bellacosa i wsp. badali 51 przypadków pierwotnego raka płaskonabłonkowego krtani i obserwowali je przez 29 miesięcy. Uważa się, że amplifikacja genu cykliny może być wykorzystana jako niezależny wskaźnik prognostyczny dla raka krtani. Jednak Bettiche i wsp. badali 53 przypadki niedrobnokomórkowego raka płuca z resekcją chirurgiczną i w 25 przypadkach stwierdzono nadekspresję cykliny D1, co wiązało się ze słabym zróżnicowaniem tkankowym, mniejszym naciekiem limfocytarnym w guzie i mniejszym odsetkiem nawrotów miejscowych (P < 0. 05). Uważają, że potrzebne są większe badania kliniczne, aby dalej testować znaczenie prognostyczne ekspresji cykliny D1.
Reference
- He G, Kuang J, Koomen J, et al. Rekrutacja trimerycznego antygenu jądrowego komórek proliferujących przez kinazy zależne od cykliny w fazie G1 po uszkodzeniu DNA za pomocą środków przeciwnowotworowych opartych na platynie. British Journal of Cancer. 2013, 109(9):2378-2388.
- Gang W, Cao J, Chen P, et al. Temporal and Spatial Expression of Cyclin H in Rat Spinal Cord Injury. Neuromolecular Medicine. 2011, 13(3):187-196.
- Ibrahim N, Nazimi A J, Ajura A J, et al. The Clinical Features and Expression of bcl-2, Cyclin D1, p53, and Proliferating Cell Nuclear Antigen in Syndromic and Nonsyndromic Keratocystic Odontogenic Tumor. Journal of Craniofacial Surgery. 2016, 27(5):1.
- Wang X, Wolgemuth D J, Baxi L V. Overexpression of HOXB5, cyclin D1 and PCNA in congenital cystic adenomatoid malformation. Fetal Diagnosis & Therapy. 2011, 29(4):315-320.
