Nazwa ogólna: lidokainy chlorowodorek
Postać dawkowania: galaretka do stosowania miejscowego
Medically reviewed by Drugs.com. Ostatnia aktualizacja w dniu 1 października 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Interactions
- More
Rx only
DESCRIPTION
Lidocaine HCI 2% Jelly jest sterylnym, wodnym produktem, który zawiera miejscowy środek znieczulający i jest podawany miejscowo. (Patrz WSKAZANIA dotyczące szczególnych zastosowań.)
Lidokaina HCI 2% Galaretka zawiera lidokainę HCI, która jest chemicznie określana jako acetamid, 2-(dietyloamino)-N-(2,6-dimetylofenylo)-,monohydrochlorek i ma następujący wzór strukturalny:
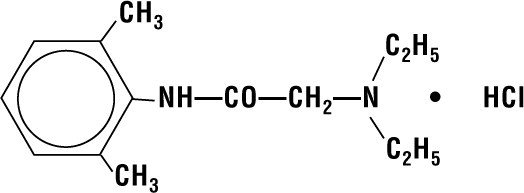
Jej wzór cząsteczkowy to C14H22N2O – HCI, a jej masa cząsteczkowa wynosi 270.80.
Lidocaine HCI 2% Jelly zawiera również hypromelozę, a powstała w ten sposób mieszanina maksymalizuje kontakt z błoną śluzową i zapewnia smarowanie przy instrumentacji. Niewykorzystaną część należy wyrzucić po pierwszym użyciu.
Skład Lidocaine HCI 2% Jelly Tuby o pojemności 30 mL i 5 mL: Każdy mL zawiera 20 mg lidokainy HCI. Preparat zawiera również metyloparaben, propyloparaben, hypromelozę oraz sodu wodorotlenek i (lub) kwas solny w celu dostosowania pH w zakresie od 6,0 do 7,0.
FARMAKOLOGIA KLINICZNA
Mechanizm działania: Lidokaina stabilizuje błonę komórkową neuronów poprzez hamowanie przepływu jonów niezbędnych do inicjacji i przewodzenia impulsów, co powoduje miejscowe działanie znieczulające.
Zaczątek działania: Początek działania wynosi od 3 do 5 minut. Jest nieskuteczny w przypadku stosowania na nieuszkodzoną skórę.
Hemodynamika: Nadmierne stężenie we krwi może powodować zmiany w rzucie serca, całkowitym oporze obwodowym i średnim ciśnieniu tętniczym. Zmiany te mogą wynikać z bezpośredniego działania depresyjnego miejscowego środka znieczulającego na różne elementy układu sercowo-naczyniowego.
Farmakokinetyka i metabolizm: Lidokaina może być wchłaniana po podaniu miejscowym na błony śluzowe, przy czym szybkość i zakres wchłaniania zależy od stężenia i całkowitej podanej dawki, konkretnego miejsca zastosowania i czasu trwania ekspozycji. Na ogół szybkość wchłaniania miejscowych środków znieczulających po zastosowaniu miejscowym jest największa po podaniu dotchawiczym. Lidokaina jest również dobrze wchłaniana z przewodu pokarmowego, ale niewielka ilość nienaruszonego leku może pojawić się w krążeniu z powodu biotransformacji w wątrobie.
Lidokaina jest szybko metabolizowana przez wątrobę, a metabolity i niezmieniony lek są wydalane przez nerki. Biotransformacja obejmuje oksydacyjną N-dealkilację, hydroksylację pierścienia, rozszczepienie wiązania amidowego i koniugację. N-dealkilacja, główny szlak biotransformacji, prowadzi do powstania metabolitów: monoetyloglicynoksylidu i glicynoksylidu. Działania farmakologiczne/toksykologiczne tych metabolitów są podobne do działania lidokainy, ale mniej silne niż lidokainy. Około 90% podanej lidokainy jest wydalane w postaci różnych metabolitów, a mniej niż 10% jest wydalane w postaci niezmienionej. Podstawowym metabolitem w moczu jest koniugat 4-hydroksy-2, 6-dimetyloaniliny.
Wiązanie lidokainy w osoczu jest zależne od stężenia leku, a frakcja związana zmniejsza się wraz ze wzrostem stężenia. W stężeniach od 1 do 4 mcg wolnej zasady na mL, 60 do 80 procent lidokainy jest związane z białkami. Wiązanie zależy również od stężenia glikoproteiny alfa-I-kwasowej w osoczu.
Lidokaina przekracza barierę krew-mózg i barierę łożyskową, przypuszczalnie na drodze dyfuzji biernej.
Badania metabolizmu lidokainy po podaniu dożylnym w postaci bolusa wykazały, że okres półtrwania eliminacji tego środka wynosi zwykle 1,5 do 2,0 godzin. Ze względu na szybkie tempo metabolizowania lidokainy, każdy stan, który wpływa na czynność wątroby, może zmieniać kinetykę lidokainy. Okres półtrwania może być wydłużony dwukrotnie lub więcej u pacjentów z zaburzeniami czynności wątroby. Zaburzenia czynności nerek nie wpływają na kinetykę lidokainy, ale mogą zwiększać kumulację metabolitów.
Czynniki takie jak kwasica oraz stosowanie środków pobudzających i depresyjnych OUN wpływają na stężenie lidokainy w OUN wymagane do wywołania jawnych działań ogólnoustrojowych. Obiektywne objawy niepożądane stają się coraz bardziej widoczne wraz ze wzrostem stężenia w osoczu krwi żylnej powyżej 6 mcg wolnej zasady na mL. U małpy rhesus wykazano, że stężenie we krwi tętniczej wynoszące od 18 do 21 mcg/ml stanowi wartość progową dla wystąpienia drgawek.
INDICATIONS AND USAGE
Lidocaine HCI 2% Jelly jest wskazana w zapobieganiu i kontroli bólu podczas zabiegów dotyczących męskiej i żeńskiej cewki moczowej, w leczeniu miejscowym bolesnego zapalenia cewki moczowej oraz jako środek znieczulający do intubacji dotchawiczej (doustnej i nosowej).
Przeciwwskazania
Lidokaina jest przeciwwskazana u pacjentów ze stwierdzoną w wywiadzie nadwrażliwością na środki znieczulenia miejscowego typu amidowego lub na inne składniki produktu Lidocaine HCI 2% Jelly.
Ostrzeżenia
EKSYMALNA DAWKA LUB KRÓTKIE PRZERWY MIĘDZY DAWKAMI MOGĄ SPOWODOWAĆ WYSOKIE POZIOMY LEKU I POWAŻNE DZIAŁANIA NIEPOŻĄDANE. PACJENTÓW NALEŻY POINSTRUOWAĆ, ABY ŚCIŚLE PRZESTRZEGALI ZALECANYCH DAWEK I ZALECEŃ DOTYCZĄCYCH PODAWANIA, PRZEDSTAWIONYCH W NINIEJSZEJ ULOTCE DOŁĄCZONEJ DO OPAKOWANIA. Postępowanie w przypadku wystąpienia poważnych działań niepożądanych może wymagać zastosowania sprzętu do resuscytacji, tlenu i innych leków resuscytacyjnych.
Lidocaine HCI 2% Jelly należy stosować z zachowaniem szczególnej ostrożności w przypadku sepsy lub poważnych urazów błony śluzowej w miejscu zastosowania, ponieważ w takich warunkach istnieje możliwość szybkiego wchłaniania ogólnoustrojowego.
W przypadku stosowania do smarowania rurki dotchawiczej należy zachować ostrożność, aby uniknąć wprowadzenia produktu do światła rurki. Nie należy używać galaretki do smarowania końcówek dotchawiczych. Jeśli galaretka dostanie się do wewnętrznego światła rurki, może zaschnąć na jej wewnętrznej powierzchni, pozostawiając osad, który ma tendencję do zbijania się przy zginaniu, zwężając światło rurki. Istnieją rzadkie doniesienia, w których ta pozostałość spowodowała zamknięcie światła. (Patrz również DZIAŁANIA NIEPOŻĄDANE oraz DAWKOWANIE I ADMINISTRACJA.)
STOSUNKI UBOCZNE
Ogólne: Bezpieczeństwo i skuteczność stosowania lidokainy zależą od właściwego dawkowania, prawidłowej techniki, odpowiednich środków ostrożności i gotowości do działania w nagłych przypadkach. (Patrz OSTRZEŻENIA i DZIAŁANIA NIEPOŻĄDANE.) Należy stosować najmniejszą dawkę, która powoduje skuteczne znieczulenie, aby uniknąć wysokiego stężenia w osoczu i poważnych działań niepożądanych. Powtarzane dawki lidokainy mogą powodować znaczne zwiększenie stężenia leku we krwi z każdą kolejną dawką z powodu powolnej kumulacji leku lub jego metabolitów. Tolerancja na podwyższone stężenie leku we krwi różni się w zależności od stanu pacjenta. Pacjenci osłabieni, w podeszłym wieku, ostro chorzy i dzieci powinni otrzymywać zmniejszone dawki, proporcjonalne do ich wieku i stanu fizycznego. Lidokainę należy również stosować ostrożnie u pacjentów z ciężkim wstrząsem lub blokiem serca.
Lidokainę HCI 2% Jelly należy stosować ostrożnie u pacjentów ze znaną wrażliwością na lek. Pacjenci uczuleni na pochodne kwasu para-aminobenzoesowego (prokaina, tetrakaina, benzokaina, itp.) nie wykazali wrażliwości krzyżowej na lidokainę.
Wiele leków stosowanych podczas prowadzenia znieczulenia jest uważanych za potencjalne czynniki wyzwalające rodzinną hipertermię złośliwą. Ponieważ nie wiadomo, czy środki znieczulenia miejscowego typu amidowego mogą wywołać tę reakcję i ponieważ nie można z góry przewidzieć konieczności zastosowania dodatkowego znieczulenia ogólnego, sugeruje się, że powinien być dostępny standardowy protokół postępowania. Wczesne niewyjaśnione objawy tachykardii, tachypnea, niestabilne ciśnienie krwi i kwasica metaboliczna mogą poprzedzać podwyższenie temperatury. Pomyślny wynik zależy od wczesnego rozpoznania, szybkiego przerwania stosowania podejrzanego czynnika (czynników) wyzwalającego i rozpoczęcia leczenia, w tym tlenoterapii, wskazanych środków wspomagających i dantrolenu (przed użyciem należy zapoznać się z ulotką dołączoną do opakowania dantrolenu sodowego podawanego dożylnie).
Informacje dla pacjentów: W przypadku stosowania środków miejscowo znieczulających w jamie ustnej, pacjent powinien być świadomy, że wytwarzanie znieczulenia miejscowego może upośledzać połykanie, a tym samym zwiększać niebezpieczeństwo aspiracji. Z tego powodu nie należy spożywać pokarmów przez 60 minut po zastosowaniu preparatów miejscowo znieczulających w okolicy jamy ustnej lub gardła. Jest to szczególnie ważne u dzieci ze względu na częstość spożywania posiłków.
Dumność języka lub błony śluzowej policzków może zwiększać niebezpieczeństwo niezamierzonego urazu przy gryzieniu. Nie należy przyjmować pokarmu ani gumy do żucia, gdy obszar jamy ustnej lub gardła jest znieczulony.
Karcynogeneza – Nie przeprowadzono długotrwałych badań na zwierzętach w celu oceny potencjału rakotwórczego lidokainy.
Mutageneza – Potencjał mutagenny lidokainy został zbadany w teście odwrotnej mutacji Salmonella Amesa, teście aberracji chromosomowych in vitro w limfocytach ludzkich oraz w teście mikrojądrowym in vivo u myszy. W badaniach tych nie wykazano działania mutagennego.
Upośledzenie płodności – Wpływ lidokainy na płodność badano w modelu szczurzym. Podanie 30 mg/kg, s.c. (180 mg/m2) parze kryjącej nie spowodowało zmian w płodności lub ogólnej wydajności reprodukcyjnej szczurów. Nie ma badań, w których badano by wpływ lidokainy na parametry nasienia. Nie było dowodów na zmienioną płodność.
Stosowanie w ciąży:
Działanie teratogenne: Kategoria B w ciąży.
Badania nad rozrodczością lidokainy przeprowadzono zarówno u szczurów, jak i u królików. Nie stwierdzono szkodliwego działania na płód w przypadku podskórnych dawek do 50 mg/kg lidokainy (300 mg/m2 w przeliczeniu na powierzchnię ciała) w modelu szczurzym. W modelu królika nie stwierdzono szkodliwego działania na płód po podaniu dawki 5 mg/kg s.c. (60 mg/m2 w przeliczeniu na powierzchnię ciała). Podanie królikom dawki 25 mg/kg (300 mg/m2) spowodowało wystąpienie toksyczności u matki oraz dowodów na opóźnienie rozwoju płodu, w tym nieistotne zmniejszenie masy ciała płodu (7%) oraz zwiększenie liczby drobnych anomalii szkieletowych (ubytek czaszki i kości skroniowej, zmniejszone kostnienie paliczków). Wpływ lidokainy na rozwój pourodzeniowy badano u szczurów, podając ciężarnym samicom szczurów codziennie podskórnie dawki 2, 10 i 50 mg/kg (12, 60 i 300 mg/m2) od 15. dnia ciąży do 20. dnia po porodzie. Nie zaobserwowano żadnych oznak szkodliwego działania ani u matek ani u szczeniąt do dawki 10 mg/kg (60 mg/m2) włącznie; jednakże liczba szczeniąt, które przeżyły była zmniejszona przy dawce 50 mg/kg (300 mg/m2), zarówno przy urodzeniu jak i w okresie laktacji, efekt ten był najprawdopodobniej wtórny do toksyczności u matki. W badaniu tym nie zaobserwowano żadnego innego wpływu na wielkość miotu, masę miotu, nieprawidłowości u szczeniąt i rozwój fizyczny szczeniąt.
W drugim badaniu badano wpływ lidokainy na rozwój postnatalny u szczurów, które obejmowało ocenę szczeniąt od odsadzenia do osiągnięcia dojrzałości płciowej. Szczury były leczone przez 8 miesięcy lidokainą w dawce 10 lub 30 mg/kg, s.c. (odpowiednio 60 mg/m2 i 180 mg/m2 w przeliczeniu na powierzchnię ciała). Okres ten obejmował 3 okresy krycia. Nie było dowodów na zmieniony rozwój pourodzeniowy u żadnego potomstwa; jednakże obie dawki lidokainy znacząco zmniejszyły średnią liczbę szczeniąt w miocie przeżywających do odsadzenia potomstwa z pierwszych 2 okresów krycia.
Nie istnieją jednak odpowiednie i dobrze kontrolowane badania u kobiet w ciąży. Ponieważ badania nad rozrodczością zwierząt nie zawsze pozwalają przewidzieć odpowiedź u ludzi, lek ten powinien być stosowany w czasie ciąży tylko w przypadku zdecydowanej konieczności.
Rozród i poród: Lidokaina nie jest przeciwwskazana do stosowania podczas porodu. W przypadku jednoczesnego stosowania Lidocaine HCl 2% Jelly z innymi produktami zawierającymi lidokainę, należy pamiętać o całkowitej dawce podawanej przez wszystkie preparaty.
Karmiące matki: Lidokaina jest wydzielana do mleka ludzkiego. Znaczenie kliniczne tej obserwacji nie jest znane. Należy zachować ostrożność, gdy lidokaina jest podawana kobiecie karmiącej.
Stosowanie u dzieci: Chociaż nie ustalono bezpieczeństwa i skuteczności stosowania produktu Lidocaine 2% Jelly u pacjentów pediatrycznych, w badaniu 19 wcześniaków (wiek ciążowy <33 tygodnie) nie stwierdzono korelacji między stężeniem lidokainy lub monoetyloglicynidylu w osoczu a masą ciała noworodka, gdy do smarowania rurek donosowych i dotchawiczych stosowano umiarkowane ilości lidokainy (tj. 0,3 mL/kg żelu lidokainowego 20 mg/ml). U żadnego noworodka stężenie lidokainy w osoczu nie przekraczało 750 mcg/L. Dawki u dzieci powinny być zmniejszone, odpowiednio do wieku, masy ciała i stanu fizycznego. (Patrz: DAWKOWANIE I ADMINISTRACJA.)
Działania niepożądane
Doświadczenia niepożądane po podaniu lidokainy mają podobny charakter do doświadczeń obserwowanych w przypadku innych amidowych środków znieczulenia miejscowego. Te działania niepożądane są, ogólnie rzecz biorąc, związane z dawką i mogą wynikać z wysokiego stężenia w osoczu spowodowanego nadmierną dawką lub szybkim wchłanianiem, lub mogą wynikać z nadwrażliwości, idiosynkrazji lub zmniejszonej tolerancji ze strony pacjenta. Poważne działania niepożądane mają na ogół charakter ogólnoustrojowy. Następujące rodzaje są najczęściej zgłaszane:
Były rzadkie doniesienia o niedrożności rurki intubacyjnej związanej z obecnością pozostałości zaschniętej galaretki w wewnętrznym świetle rurki. (Patrz również OSTRZEŻENIA oraz DAWKOWANIE I ADMINISTRACJA.)
Centralny układ nerwowy: Objawy ze strony OUN są pobudzające i (lub) depresyjne i mogą charakteryzować się światłowstrętem, nerwowością, niepokojem, euforią, dezorientacją, zawrotami głowy, sennością, szumem w uszach, niewyraźnym lub podwójnym widzeniem, wymiotami, uczuciem gorąca, zimna lub zdrętwienia, drgawkami, drżeniem, konwulsjami, utratą przytomności, depresją oddechową i zatrzymaniem oddechu. Objawy pobudzenia mogą być bardzo krótkotrwałe lub mogą w ogóle nie wystąpić, w którym to przypadku pierwszym objawem toksyczności może być senność łącząca się z utratą przytomności i zatrzymaniem oddechu.
Senność po podaniu lidokainy jest zwykle wczesnym objawem wysokiego stężenia leku we krwi i może wystąpić jako konsekwencja szybkiego wchłaniania.
Układ sercowo-naczyniowy: Objawy sercowo-naczyniowe są zwykle depresyjne i charakteryzują się bradykardią, niedociśnieniem i zapaścią sercowo-naczyniową, która może prowadzić do zatrzymania akcji serca.
Układ alergiczny: Reakcje alergiczne charakteryzują się zmianami skórnymi, pokrzywką, obrzękiem lub reakcjami anafilaktoidalnymi. Reakcje alergiczne mogą wystąpić w wyniku wrażliwości na miejscowy środek znieczulający lub inne składniki preparatu. Reakcje alergiczne w wyniku nadwrażliwości na lidokainę występują niezwykle rzadko, a w przypadku ich wystąpienia należy postępować zgodnie z konwencjonalnymi metodami. Wykrywanie nadwrażliwości za pomocą testów skórnych ma wątpliwą wartość.
NADWYŻKA
Ostre stany nagłe po podaniu środków znieczulenia miejscowego są na ogół związane z dużymi stężeniami w osoczu, występującymi podczas terapeutycznego stosowania środków znieczulenia miejscowego. (Patrz: DZIAŁANIA NIEPOŻĄDANE, OSTRZEŻENIA i PRZECIWWSKAZANIA.)
Zarządzanie nagłymi przypadkami związanymi ze środkami znieczulenia miejscowego: Pierwszą kwestią jest zapobieganie, najlepiej osiągane przez staranne i stałe monitorowanie parametrów życiowych układu krążenia i oddechowego oraz stanu świadomości pacjenta po każdym podaniu środka znieczulenia miejscowego. Przy pierwszych oznakach zmian należy podać tlen.
Pierwszym krokiem w postępowaniu w przypadku drgawek jest natychmiastowe zwrócenie uwagi na utrzymanie drożności dróg oddechowych i wspomaganej lub kontrolowanej wentylacji z użyciem tlenu i systemu dostarczania umożliwiającego natychmiastowe uzyskanie dodatniego ciśnienia w drogach oddechowych przez maskę. Natychmiast po wprowadzeniu tych środków wentylacyjnych należy ocenić adekwatność krążenia, pamiętając, że leki stosowane w leczeniu drgawek czasami powodują depresję krążenia, gdy są podawane dożylnie. Jeżeli drgawki utrzymują się pomimo odpowiedniego wsparcia oddechowego i jeżeli stan krążenia na to pozwala, można podać dożylnie małe dawki ultrakrótko działającego barbituranu (takiego jak tiopental lub tiamylal) lub benzodiazepiny (takiej jak diazepam). Przed zastosowaniem środków znieczulenia miejscowego klinicysta powinien być zaznajomiony z tymi lekami przeciwdrgawkowymi. Leczenie podtrzymujące depresji układu krążenia może wymagać podawania płynów dożylnych i, w razie potrzeby, wazopresora zgodnie z zaleceniami klinicznymi (np. efedryna).
Jeżeli nie są natychmiast leczone, zarówno drgawki, jak i depresja układu krążenia mogą prowadzić do niedotlenienia, kwasicy, bradykardii, zaburzeń rytmu serca i zatrzymania akcji serca. Jeśli dojdzie do zatrzymania krążenia, należy zastosować standardowe środki resuscytacji krążeniowo-oddechowej.
Dializa ma znikomą wartość w leczeniu ostrego przedawkowania lidokainy.
LD50 doustnej dawki lidokainy HCI u nie karmionych samic szczurów wynosi 459 (346 do 773) mg/kg (jako sól) i 214 (159 do 324) mg/kg (jako sól) u karmionych samic szczurów.
DAWKOWANIE I ADMINISTRACJA
Gdy Lidocaine HCI 2% Jelly jest stosowana jednocześnie z innymi produktami zawierającymi lidokainę, należy pamiętać o całkowitej dawce wniesionej przez wszystkie preparaty.
Dawkowanie jest zróżnicowane i zależy od obszaru, który ma być znieczulony, unaczynienia tkanek, indywidualnej tolerancji oraz techniki znieczulenia. Należy podawać najniższą dawkę potrzebną do zapewnienia skutecznego znieczulenia. Dawki należy zmniejszyć u dzieci oraz u pacjentów w podeszłym wieku i osłabionych. Chociaż częstość występowania działań niepożądanych w przypadku stosowania produktu Lidocaine HCI 2% Jelly jest dość niska, należy zachować ostrożność, szczególnie w przypadku stosowania dużych ilości, ponieważ częstość występowania działań niepożądanych jest wprost proporcjonalna do całkowitej dawki podanego środka znieczulenia miejscowego.
Do znieczulenia powierzchniowego cewki moczowej u dorosłych mężczyzn: W przypadku stosowania tub Lidocaine 2% Jelly 30 mL, plastikowy stożek należy sterylizować przez 5 minut we wrzącej wodzie, ostudzić i dołączyć do tuby. Stożek może być sterylizowany gazem lub na zimno, zależnie od preferencji. Powoli wpuścić około 15 mL (300 mg lidokainy HCI) do cewki moczowej lub do momentu, gdy pacjent poczuje napięcie. Następnie należy założyć zacisk na prącie na kilka minut przy koronie. Dodatkowa dawka nie większa niż 15 mL (300 mg) może być wstrzyknięta w celu uzyskania odpowiedniego znieczulenia.
Przed sondowaniem lub cystoskopią należy zastosować zacisk na prąciu przez 5 do 10 minut w celu uzyskania odpowiedniego znieczulenia. Całkowita dawka 30 mL (600 mg) jest zwykle wymagana do wypełnienia i rozszerzenia męskiej cewki moczowej.
Przed cewnikowaniem, mniejsze objętości 5 do 10 mL (100 do 200 mg) są zwykle wystarczające do smarowania.
Do znieczulenia powierzchniowego cewki moczowej u dorosłych kobiet: W przypadku używania tubek Lidocaine 2% Jelly 30 mL, wysterylizować plastikowy stożek przez 5 minut we wrzącej wodzie, ostudzić i dołączyć do tubki. Stożek może być sterylizowany gazem lub na zimno, zależnie od preferencji. Powoli wprowadzić 3 do 5 mL (60 do 100 mg lidokainy HCI) galaretki do cewki moczowej. Jeśli jest to pożądane, część galaretki można nanieść na wacik i wprowadzić do cewki moczowej. W celu uzyskania odpowiedniego znieczulenia, przed wykonaniem zabiegów urologicznych należy odczekać kilka minut.
Lubrykacja przy intubacji dotchawiczej: Nałożyć umiarkowaną ilość galaretki na zewnętrzną powierzchnię rurki intubacyjnej na krótko przed użyciem. Należy uważać, aby nie wprowadzić produktu do światła rurki. Nie używać galaretki do smarowania końcówek dotchawiczych. Patrz OSTRZEŻENIA i DZIAŁANIA NIEPOŻĄDANE dotyczące rzadkich doniesień o okluzji światła wewnętrznego. Zaleca się również unikanie stosowania rurek dotchawiczych z zaschniętą galaretką na powierzchni zewnętrznej ze względu na brak działania smarującego.
MAKSYMALNA DAWKA
Nie należy podawać więcej niż 600 mg lidokainy HCI w dowolnym okresie 12 godzin.
Dzieci: Trudno jest zalecić maksymalną dawkę jakiegokolwiek leku dla dzieci, ponieważ zmienia się ona jako funkcja wieku i masy ciała. W przypadku dzieci w wieku poniżej dziesięciu lat, które mają prawidłową masę ciała i prawidłowy rozwój ciała szczupłego, dawka maksymalna może być określona przez zastosowanie jednego ze standardowych wzorów na leki pediatryczne (np. zasada Clarka). Na przykład, u dziecka w wieku pięciu lat ważącego 50 funtów, dawka chlorowodorku lidokainy nie powinna przekraczać 75 do 100 mg przy obliczaniu według zasady Clarka. W każdym przypadku maksymalna ilość podawanej lidokainy HCI nie powinna przekraczać 4,5 mg/kg (2 mg/lb) masy ciała.
Jak podawać
Lidocaine HCI 2% Jelly jest dostarczana w wymienionych postaciach dawkowania.
NDC 17478-840-30 Tuba aluminiowa 30 mL
NDC 17478-840-05 Tuba aluminiowa 5 mL
Do kartonika 30 mL dołączony jest odłączany stożek aplikatora oraz klucz do wyrażania zawartości.
Przechowywanie: Przechowywać w temperaturze 20° do 25°C (68° do 77°F) .
PREMIERProRx®
Wyprodukowano przez:
Akorn, Inc.
Lake Forest, IL 60045
PremierProRx® jest zarejestrowanym znakiem towarowym firmy Premier Inc, używanym na podstawie licencji.
PLD00N Rev. 10/15
Principal Display Panel Text for Container Label:
NDC 17478-840-05 Premier Logo
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Sterile 5 mL

Principal Display Panel Text for Carton Label:
NDC 17478-840-05 Sterylne 5 mL
Lidocaine Hydrochloride Jelly USP, 2%
Rx only
Premier Logo

| LIDOCAINE lidocaine hydrochloride jelly |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Wytwórca -. Akorn, Inc. (117696770)
Rejestrator – Akorn Operating Company LLC (117696770). Akorn Operating Company LLC (117693100)
| Przedsiębiorstwo | |||
| Nazwa | Adres | ID/FEI | Operacje |
| Akorn, Inc | 117696840 | PRZYGOTOWANIE(17478-840), ANALIZA(17478-840), STERYLIZA(17478-840), PAKOWANIE(17478-840), NAKLEJANIE(17478-840) | |
Więcej o lidokaina miejscowo
- Skutki uboczne
- W czasie ciąży lub karmienia piersią
- Informacje dotyczące dawkowania
- Interakcje lekowe
- Porównaj alternatywy
- Ceny &Kupony
- En Español
- 208 Recenzje
- Klasa leków: środki znieczulające miejscowo
- Alerty FDA (5)
.
Zasoby dla konsumentów
- Informacje dla pacjentów
- Lidokaina do stosowania miejscowego (Lektura zaawansowana)
Zasoby dla profesjonalistów
.
- Informacje dla pacjenta
- Lidokaina (miejscowo) (Profesjonalna porada dla pacjenta)
- Krem z lidokainą (FDA)
- Żel z lidokainą (FDA)
- Roztwór krtaniowo-tchawiczny z lidokainą (FDA)
- … +9 więcej
Inne marki Lidocaine Viscous, ZTlido, Xylocaine Jelly, Xylocaine Topical, … +24 więcej
Przewodniki po leczeniu
- Świąd jamy ustnej
- Chirurgia przewodu pokarmowego
- Anestezja
- Oparzenia, zewnętrzne
- … +9 więcej
Zastrzeżenia medyczne
.
