Wyniki nauczania
- Zdefiniuj zasadę oktetu i jej rolę w wiązaniach chemicznych
Nie wszystkie pierwiastki mają wystarczającą ilość elektronów do wypełnienia ich skrajnych powłok, ale atom jest najbardziej stabilny kiedy wszystkie pozycje elektronów w skrajnej powłoce są wypełnione. Z powodu tych wolnych miejsc w najbardziej zewnętrznych powłokach, widzimy tworzenie się wiązań chemicznych lub interakcji pomiędzy dwoma lub więcej takimi samymi lub różnymi elementami, które skutkują tworzeniem się cząsteczek. Aby osiągnąć większą stabilność, atomy dążą do całkowitego wypełnienia swoich zewnętrznych powłok i wiążą się z innymi pierwiastkami, aby osiągnąć ten cel poprzez dzielenie się elektronami, przyjmowanie elektronów od innego atomu lub oddawanie elektronów innemu atomowi. Ponieważ najbardziej zewnętrzne powłoki pierwiastków o niskich liczbach atomowych (aż do wapnia, o liczbie atomowej 20) mogą pomieścić osiem elektronów, nazywa się to regułą oktetu. Element może oddawać, przyjmować lub dzielić elektrony z innymi elementami, aby wypełnić swoją zewnętrzną powłokę i spełnić regułę oktetu.
Wczesny model atomu został opracowany w 1913 roku przez duńskiego naukowca Nielsa Bohra (1885-1962). Model Bohra pokazuje atom jako centralne jądro zawierające protony i neutrony, z elektronami w okrągłych powłokach elektronowych w określonych odległościach od jądra, podobnych do planet krążących wokół słońca. Każda powłoka elektronowa ma inny poziom energetyczny, przy czym powłoki znajdujące się najbliżej jądra mają niższą energię niż te znajdujące się dalej od jądra. Umownie, każdej powłoce przypisany jest numer i symbol n – na przykład, powłoka elektronowa najbliżej jądra nazywana jest 1n. Aby poruszać się pomiędzy powłokami, elektron musi zaabsorbować lub uwolnić ilość energii odpowiadającą dokładnie różnicy energii pomiędzy powłokami. Na przykład, jeżeli elektron zaabsorbuje energię z fotonu, może zostać wzbudzony i przejść do powłoki o wyższej energii; odwrotnie, kiedy wzbudzony elektron spada z powrotem do powłoki o niższej energii, uwolni energię, często w postaci ciepła.
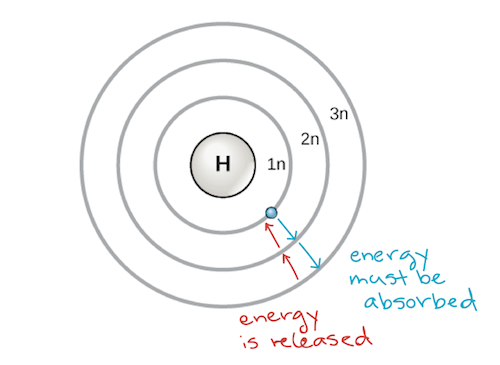
Model atomu Bohra, pokazujący poziomy energetyczne jako koncentryczne okręgi otaczające jądro. Energia musi być dodana, aby przesunąć elektron na wyższy poziom energetyczny, a energia jest uwalniana, gdy elektron spada z wyższego poziomu energetycznego na bliższy. Image credit: modified from OpenStax Biology
Atomy, jak inne rzeczy rządzone prawami fizyki, mają tendencję do przyjmowania najniższej energii, najbardziej stabilnej konfiguracji jaką mogą. Tak więc, powłoki elektronowe atomu są zaludnione od wewnątrz na zewnątrz, z elektronami wypełniającymi niskoenergetyczne powłoki bliżej jądra, zanim przejdą do wyżejenergetycznych powłok dalej. Powłoka najbliżej jądra, 1n, może pomieścić dwa elektrony, podczas gdy następna powłoka, 2n, może pomieścić osiem, a trzecia powłoka, 3n, może pomieścić do osiemnastu.
Liczba elektronów w najbardziej zewnętrznej powłoce danego atomu określa jego reaktywność, lub skłonność do tworzenia wiązań chemicznych z innymi atomami. Ta najbardziej zewnętrzna powłoka jest znana jako powłoka walencyjna, a elektrony znajdujące się w niej są nazywane elektronami walencyjnymi. Ogólnie rzecz biorąc, atomy są najbardziej stabilne, najmniej reaktywne, kiedy ich najbardziej zewnętrzna powłoka elektronowa jest pełna. Większość pierwiastków ważnych w biologii potrzebuje ośmiu elektronów w swojej najbardziej zewnętrznej powłoce, aby być stabilnymi, a ta zasada kciuka znana jest jako reguła oktetu. Niektóre atomy mogą być stabilne z oktetem, nawet jeśli ich powłoka walencyjna jest powłoką 3n, która może pomieścić do 18 elektronów. Będziemy badać powód tego, gdy omówimy orbitale elektronowe poniżej.
Przykłady niektórych neutralnych atomów i ich konfiguracje elektronowe są pokazane poniżej. W tej tabeli można zobaczyć, że hel ma pełną powłokę walencyjną, z dwoma elektronami w pierwszej i jedynej, 1n, powłoce. Podobnie, neon ma pełną zewnętrzną powłokę 2n zawierającą osiem elektronów. Te konfiguracje elektronowe sprawiają, że hel i neon są bardzo stabilne. Chociaż argon nie posiada technicznie pełnej zewnętrznej powłoki, ponieważ powłoka 3n może zawierać do osiemnastu elektronów, jest on stabilny jak neon i hel, ponieważ posiada osiem elektronów w powłoce 3n i tym samym spełnia regułę oktetu. Dla kontrastu, chlor ma tylko siedem elektronów w swojej najbardziej zewnętrznej powłoce, podczas gdy sód ma tylko jeden. Wzory te nie wypełniają najbardziej zewnętrznej powłoki lub spełniają regułę oktetu, co sprawia, że chlor i sód są reaktywne, chętne do zdobycia lub utraty elektronów, aby osiągnąć bardziej stabilną konfigurację.
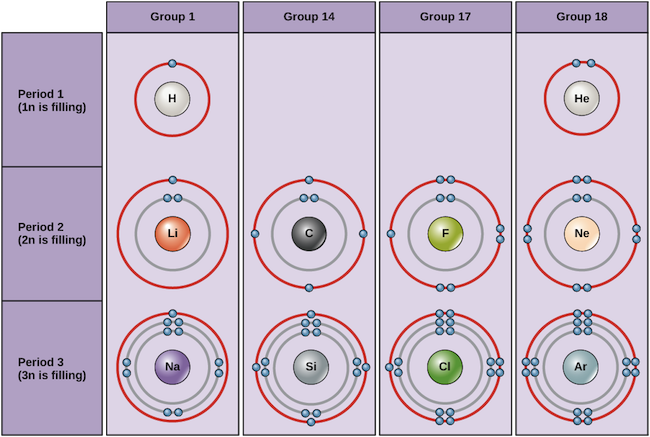
Schematy Bohra różnych pierwiastków Image credit: OpenStax Biology
Konfiguracje elektronowe i układ okresowy
Pierwiastki są umieszczane w kolejności na układzie okresowym w oparciu o ich liczbę atomową, czyli ile mają protonów. W neutralnym atomie liczba elektronów będzie równa liczbie protonów, więc możemy łatwo określić liczbę elektronów z liczby atomowej. Ponadto, pozycja pierwiastka w układzie okresowym – jego kolumna lub grupa i rząd lub okres – dostarcza użytecznych informacji o tym, jak rozmieszczone są elektrony.
Jeśli weźmiemy pod uwagę tylko trzy pierwsze rzędy tabeli, które zawierają główne pierwiastki ważne dla życia, każdy rząd odpowiada wypełnieniu innej powłoki elektronowej: hel i wodór umieszczają swoje elektrony w powłoce 1n, podczas gdy pierwiastki drugiego rzędu, takie jak Li, zaczynają wypełniać powłokę 2n, a pierwiastki trzeciego rzędu, takie jak Na, kontynuują wypełnianie powłoki 3n. Podobnie, numer kolumny pierwiastka daje informacje o jego liczbie elektronów walencyjnych i reaktywności. Ogólnie rzecz biorąc, liczba elektronów walencyjnych jest taka sama w obrębie kolumny i wzrasta od lewej do prawej w obrębie rzędu. Pierwiastki z grupy 1 mają tylko jeden elektron walencyjny, a pierwiastki z grupy 18 mają ich osiem, z wyjątkiem helu, który ma tylko dwa elektrony. Tak więc, numer grupy jest dobrym predyktorem tego, jak reaktywny każdy element będzie:
- Hel (He), neon (Ne) i argon (Ar), jako grupa 18 elementów, mają zewnętrzne powłoki elektronowe, które są pełne lub spełniają regułę oktetu. To czyni je bardzo stabilnymi jako pojedyncze atomy. Ze względu na ich brak reaktywności, są one nazywane gazami obojętnymi lub szlachetnymi.
- Wodór (H), lit (Li) i sód (Na), jako pierwiastki grupy 1, mają tylko jeden elektron w swoich najbardziej zewnętrznych powłokach. Są one niestabilne jako pojedyncze atomy, ale mogą stać się stabilne poprzez utratę lub współdzielenie ich jednego elektronu walencyjnego. Jeśli pierwiastki te całkowicie tracą elektron – jak to zwykle ma miejsce w przypadku Li i Na – stają się dodatnio naładowanymi jonami: Li+, Na+.
- Fluor (F) i chlor (Cl), jako pierwiastki grupy 17, mają siedem elektronów w swoich najbardziej zewnętrznych powłokach. Mają one tendencję do osiągania stabilnego oktetu poprzez pobieranie elektronów od innych atomów, stając się ujemnie naładowanymi jonami: F- i Cl-.
- Węgiel (C), jako pierwiastek grupy 14, posiada cztery elektrony w swojej zewnętrznej powłoce. Węgiel zazwyczaj dzieli się elektronami, aby osiągnąć pełną powłokę walencyjną, tworząc wiązania z wieloma innymi atomami.
Tak więc, kolumny układu okresowego odzwierciedlają liczbę elektronów znalezionych w powłoce walencyjnej każdego elementu, co z kolei określa, jak element będzie reagować.
Spróbuj tego
Przyczyń się!
Popraw tę stronęDowiedz się więcej
