Cele nauczania
- Zapisz wzór chemiczny dla prostego związku jonowego.
- Rozpoznaj jony wieloatomowe we wzorach chemicznych.
Zetknęliśmy się już z niektórymi wzorami chemicznymi dla prostych związków jonowych. Wzór chemiczny to zwięzła lista pierwiastków wchodzących w skład związku oraz proporcje tych pierwiastków. Aby lepiej zrozumieć, co oznacza wzór chemiczny, musimy rozważyć, w jaki sposób związek jonowy jest zbudowany ze swoich jonów.
Związki jonowe istnieją jako naprzemienne jony dodatnie i ujemne w regularnych, trójwymiarowych tablicach zwanych kryształami (rysunek \PageIndex{1}}). Jak widać, w tablicy nie ma pojedynczych „cząsteczek” NaCl; zamiast tego jest ciągła siatka naprzemiennie występujących jonów sodu i chlorku. Możemy jednak użyć stosunku jonów sodu do jonów chlorkowych, wyrażonego w możliwie najmniejszych liczbach całkowitych, jako sposobu opisania związku. W przypadku chlorku sodu, stosunek jonów sodu do jonów chlorkowych, wyrażony najniższymi liczbami całkowitymi, wynosi 1:1, więc do opisu związku używamy NaCl (jeden symbol Na i jeden symbol Cl). Zatem NaCl to wzór chemiczny chlorku sodu, który jest zwięzłym sposobem opisania względnej liczby różnych jonów w związku. Makroskopowa próbka składa się z niezliczonych par NaCl; każda para nazywana jest jednostką wzoru. Chociaż wygodnie jest myśleć, że kryształy NaCl składają się z pojedynczych jednostek NaCl, rysunek pokazuje, że żaden pojedynczy jon nie jest wyłącznie związany z żadnym innym pojedynczym jonem. Każdy jon jest otoczony przez jony o przeciwnym ładunku.
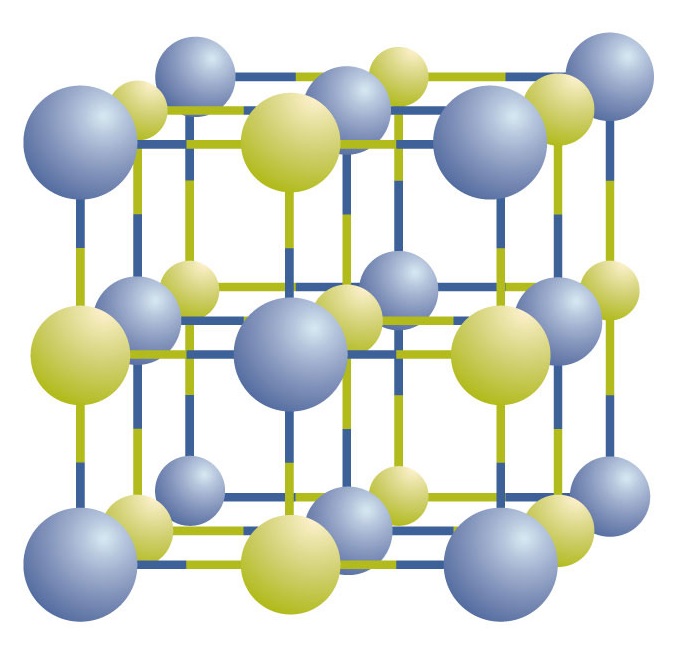
Rysunek \(\PageIndex{1}}) Kryształ chlorku sodu. Kryształ zawiera trójwymiarowy układ naprzemiennie występujących jonów dodatnich i ujemnych. Dokładny wzór zależy od związku. Kryształ chlorku sodu, pokazany tutaj, jest zbiorem naprzemiennie występujących jonów sodu i chloru.
Wzór na związek jonowy jest zgodny z kilkoma konwencjami. Po pierwsze, kation jest napisany przed anionem. Ponieważ większość metali tworzy kationy, a większość niemetali tworzy aniony, wzory zazwyczaj wymieniają najpierw metal, a następnie niemetal. Po drugie, ładunki nie są zapisywane we wzorze. Pamiętaj, że w związku jonowym składnikami są jony, a nie obojętne atomy, nawet jeśli wzór nie zawiera ładunków. Wreszcie, prawidłowy wzór związku jonowego jest zawsze zgodny z następującą zasadą: całkowity ładunek dodatni musi być równy całkowitemu ładunkowi ujemnemu. Aby określić właściwy wzór dowolnej kombinacji jonów, należy określić, ile każdego jonu potrzeba do zrównoważenia całkowitych ładunków dodatnich i ujemnych w związku.
Reguła ta opiera się ostatecznie na fakcie, że materia jest, ogólnie rzecz biorąc, elektrycznie obojętna.
Przyjętą konwencją jest przyjmowanie, że istnieje tylko jeden atom, jeśli indeks dolny nie jest obecny. Nie używamy 1 jako indeksu.
Jeśli przyjrzymy się związkowi jonowemu składającemu się z jonów litu i jonów bromku, zobaczymy, że jon litu ma ładunek 1+, a jon bromku ma ładunek 1-. Tylko jeden jon każdego z nich jest potrzebny do zrównoważenia tych ładunków. Wzór dla bromku litu jest LiBr.
Gdy związek jonowy jest utworzony z magnezu i tlenu, jon magnezu ma ładunek 2+, a atom tlenu ma ładunek 2-. Chociaż oba te jony mają większe ładunki niż jony w bromku litu, nadal równoważą się w stosunku jeden do jednego. Dlatego właściwy wzór dla tego związku jonowego to MgO.
Rozważmy teraz związek jonowy utworzony przez magnez i chlor. Jon magnezu ma ładunek 2+, podczas gdy jon chloru ma ładunek 1:
Mg2+ Cl-
Połączenie po jednym jonie każdego z nich nie równoważy całkowicie ładunków dodatnich i ujemnych. Najłatwiejszym sposobem zrównoważenia tych ładunków jest założenie obecności dwóch jonów chlorkowych dla każdego jonu magnezu:
Mg2+ Cl- Cl-
Teraz ładunki dodatnie i ujemne są zrównoważone. Moglibyśmy zapisać wzór chemiczny tego związku jonowego jako MgClCl, ale konwencją jest używanie liczbowego indeksu, gdy jest więcej niż jeden jon danego typu-MgCl2. Ten wzór chemiczny mówi, że w tym wzorze jest jeden jon magnezu i dwa jony chlorkowe. (Nie należy odczytywać części „Cl2” wzoru jako cząsteczki dwuatomowego pierwiastka chloru. Chlor nie istnieje jako pierwiastek dwuatomowy w tym związku. Istnieje on raczej jako dwa pojedyncze jony chlorkowe). Zgodnie z konwencją, we wzorach związków jonowych stosuje się najniższy stosunek liczb całkowitych. Wzór Mg2Cl4 ma zrównoważone ładunki z jonami w stosunku 1:2, ale nie jest to najniższy stosunek liczb całkowitych.
Zgodnie z konwencją, najniższy stosunek liczb całkowitych jonów jest używany we wzorach jonowych. Istnieją wyjątki dla niektórych jonów, takich jak Hg22+
Przykład
Pisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon sodu i jon siarki
- jon glinu i jon fluorkowy
- jon żelaza 3+ i jon tlenu
Rozwiązanie
- Aby uzyskać oktet powłok walencyjnych, sód tworzy jon o ładunku 1+, natomiast jon siarki ma ładunek 2-. Dwa jony 1+ sodu są potrzebne do zrównoważenia ładunku 2- na jonie siarki. Zamiast pisać wzór jako NaNaS, skracamy go umownie do Na2S.
- Jon glinu ma ładunek 3+, podczas gdy jon fluorkowy utworzony przez fluor ma ładunek 1-. Trzy jony fluoru 1- są potrzebne do zrównoważenia ładunku 3+ na jonie glinu. To połączenie jest zapisywane jako AlF3.
- Żelazo może tworzyć dwa możliwe jony, ale jon z ładunkiem 3+ jest określony tutaj. Atom tlenu jako jon ma ładunek 2. Aby zrównoważyć ładunki dodatnie i ujemne, patrzymy na najmniejszą wspólną wielokrotność-6: dwa jony żelaza 3+ dadzą 6+, podczas gdy trzy jony tlenu 2- dadzą 6-, równoważąc w ten sposób ogólne ładunki dodatnie i ujemne. Tak więc wzór tego związku jonowego to Fe2O3.
Ćwiczenie \(\PageIndex{1})
Napisz wzór chemiczny związku jonowego składającego się z każdej pary jonów.
- jon wapnia i jon tlenu
- jon miedzi 2+ i jon siarki
- jon miedzi 1+ i jon siarki
Jony poliaatomowe
Niektóre jony składają się z grup atomów połączonych ze sobą i mają ogólny ładunek elektryczny. Ponieważ jony te zawierają więcej niż jeden atom, nazywa się je jonami poliaatomowymi. Jony wieloatomowe mają charakterystyczne wzory, nazwy i ładunki, które powinny być zapamiętane. Na przykład NO3- to jon azotanowy; ma jeden atom azotu i trzy atomy tlenu oraz całkowity ładunek 1. Tabela zawiera listę najczęściej występujących jonów wieloatomowych.
| Name | Formula |
|---|---|
| jon amonowy | NH4+ |
| jon octanowy | C2H3O2- |
| jon węglanowy | CO32- |
| jon wodorowęglanowy (jon wodorowęglanowy) | HCO3- |
| jon cyjankowy | CN- |
| jon wodorotlenkowy | OH- |
| jon fosforanowy | PO43- |
| jon wodorofosforanowy | HPO42- |
| jon dwuwodorofosforanowy | H2PO4- |
| jon azotanowy | NO3- |
| jon siarczynowy | SO32- |
Zasada konstruowania wzorów dla związków jonowych zawierających jony wieloatomowe jest taka sama jak dla wzorów zawierających jony monatomowe (jedno-atom) jonów: ładunki dodatnie i ujemne muszą się równoważyć. Jeżeli do zrównoważenia ładunku potrzeba więcej niż jednego jonu wieloatomowego, cały wzór na jon wieloatomowy musi być ujęty w nawias, a indeks liczbowy umieszczony poza nawiasem. Ma to na celu pokazanie, że indeks odnosi się do całego jonu wieloatomowego. Przykładem jest Ba(NO3)2.
Przykład
Pisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon potasowy i jon siarczanowy
- jon wapniowy i jon azotanowy
Rozwiązanie
- Jony potasowe mają ładunek 1+, natomiast jony siarczanowe mają ładunek 2-. Będziemy potrzebować dwóch jonów potasu, aby zrównoważyć ładunek jonu siarczanowego, więc właściwy wzór chemiczny to K2SO4.
- Jony wapnia mają ładunek 2+, podczas gdy jony azotanowe mają ładunek 1-. Będziemy potrzebować dwóch jonów azotanowych, aby zrównoważyć ładunek każdego jonu wapnia. Wzór na azotan musi być ujęty w nawias. Tak więc piszemy Ca(NO3)2 jako wzór tego związku jonowego.
Ćwiczenie ‖
Napisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon magnezu i jon węglanowy
- jon glinu i jon octanowy
Rozpoznawanie związków jonowych
Są dwa sposoby rozpoznawania związków jonowych. Po pierwsze, związki pomiędzy elementami metalowymi i niemetalowymi są zazwyczaj jonowe. Na przykład CaBr2 zawiera pierwiastek metaliczny (wapń, metal grupy 2A) i pierwiastek niemetaliczny (brom, niemetal grupy 7A). Dlatego też, jest to najprawdopodobniej związek jonowy. (W rzeczywistości jest to związek jonowy.) Natomiast związek NO2 zawiera dwa pierwiastki, które są niemetalami (azot z grupy 5A i tlen z grupy 6A). Nie jest to związek jonowy; należy on do kategorii związków kowalencyjnych omówionych w innym miejscu. Zauważ również, że to połączenie azotu i tlenu nie ma określonego ładunku elektrycznego, więc nie jest to jon azotynowy.
Po drugie, jeśli rozpoznasz wzór jonu wieloatomowego w związku, związek jest jonowy. Na przykład, jeśli widzisz wzór Ba(NO3)2, możesz rozpoznać część „NO3” jako jon azotanowy, \(\NO_3^-}). (Pamiętaj, że konwencja pisania wzorów dla związków jonowych nie uwzględnia ładunku jonowego). Jest to wskazówka, że druga część wzoru, Ba, jest w rzeczywistości jonem Ba2+, z ładunkiem 2+ równoważącym całkowity ładunek 2- pochodzący od dwóch jonów azotanowych. Tak więc, ten związek jest również jonowy.
Przykład
Zidentyfikuj każdy związek jako jonowy lub nie jonowy.
- Na2O
- PCl3
- NH4Cl
- OF2
Rozwiązanie
- Sód jest metalem, a tlen niemetalem; dlatego oczekuje się, że Na2O jest jonowy.
- Oba fosfor i chlor są niemetalami. Dlatego, PCl3 nie jest jonowy.
- NH4 we wzorze reprezentuje jon amonowy, NH4+, co wskazuje, że ten związek jest jonowy.
- Obaj tlen i fluor są niemetalami. Dlatego OF2 nie jest jonowy.
Ćwiczenie
Zidentyfikuj każdy związek jako jonowy lub niejonowy.
- N2O
- FeCl3
- (NH4)3PO4
- SOCl2
Patrząc bliżej: Blood and Seawater
Nauka od dawna uznaje, że krew i woda morska mają podobny skład. W końcu oba płyny mają rozpuszczone w sobie związki jonowe. Podobieństwo to może być czymś więcej niż zwykłym zbiegiem okoliczności; wielu naukowców uważa, że pierwsze formy życia na Ziemi powstały w oceanach. Jednak bliższe przyjrzenie się pokazuje, że krew i woda morska są zupełnie różne. Roztwór chlorku sodu o stężeniu 0,9% jest zbliżony do stężenia soli występującej we krwi. Natomiast woda morska to głównie 3% roztwór chlorku sodu, czyli ponad trzykrotnie większe stężenie niż we krwi. Oto porównanie ilości jonów we krwi i wodzie morskiej:
| Jon | Procent w wodzie morskiej | Procent we krwi |
|---|---|---|
| Na+ | 2.36 | 0,322 |
| Cl- | 1,94 | 0,366 |
| Mg2+ | 0,13 | 0,002 |
| SO42- | 0.09 | – |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3- | 0.002 | 0.165 |
| HPO42-, H2PO4- | – | 0,01 |
Większość jonów występuje obficiej w wodzie morskiej niż we krwi, z kilkoma ważnymi wyjątkami. We krwi znajduje się znacznie więcej jonów wodorowęglanowych (HCO3-) niż w wodzie morskiej. Różnica ta jest istotna, ponieważ jon wodorowęglanowy i niektóre jony pokrewne odgrywają kluczową rolę w kontrolowaniu właściwości kwasowo-zasadowych krwi. Ilość jonów wodorofosforanowych-HPO42- i H2PO4- w wodzie morskiej jest bardzo niska, ale są one obecne w większych ilościach we krwi, gdzie również wpływają na właściwości kwasowo-zasadowe. Inną zauważalną różnicą jest to, że krew nie posiada znaczących ilości jonu siarczanowego (SO42-), ale jon ten jest obecny w wodzie morskiej.
Kluczowe wnioski
- Właściwe wzory chemiczne dla związków jonowych równoważą całkowity ładunek dodatni z całkowitym ładunkiem ujemnym.
- Grupy atomów o całkowitym ładunku, zwane jonami wieloatomowymi, również istnieją.
Współautorzy i przypisy
-
Anonim
.
